Analisis stereokimia dan konformasi
Stereokimia adalah cabang kimia yang berhubungan dengan aspek tiga dimensi molekul dan reaktivitasnya. Kimia Organik tidak dapat dipahami tanpa mempertimbangkan Stereokimia. Sistem biologis sangat selektif dan sering membedakan molekul dengan perbedaan stereokimia yang sangat kecil.
Analisis konformasi adalah bagian dari studi spasial molekul, yaitu Stereokimia.
KONSTITUSI, KONFIGURASI DAN KONFORMASI
Senyawa dengan rumus yang sama disebut isomer.
empiris tetapi strukturnya berbeda.
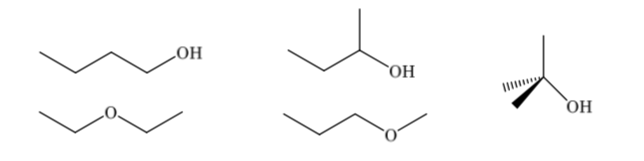
Isomer konstitusional berbeda dalam urutan pengikatannya, mereka menghadirkan konektivitas yang berbeda. Senyawa dengan rumus molekul C4H10O dapat memiliki konstitusi yang berbeda:
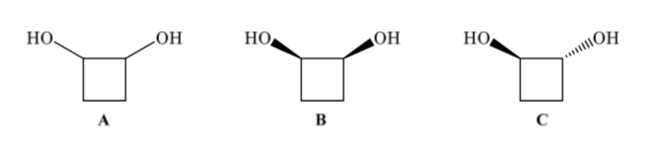
Isomer konfigurasi memiliki konektivitas yang sama tetapi berbeda dalam susunan spasial atom. 1,2-Cyclobutanediol (A) dapat memiliki dua isomer konfigurasi tergantung pada apakah kedua gugus OH berada di sisi yang sama (B) atau di sisi yang berlawanan (C)
Isomer konformasi memiliki konstitusi yang sama, konfigurasi yang sama, tetapi mereka berbeda secara spasial karena mereka berpindah dari satu isomer ke isomer lainnya dengan rotasi ikatan yang sederhana. Berbagai bentuk yang diperoleh molekul sebagai hasil rotasi di sekitar ikatan tunggal disebut konformasi, yang masing-masing merupakan konformer.
Salah satu representasi karbon tetrahedron yang paling banyak digunakan adalah apa yang disebut representasi perspektif.
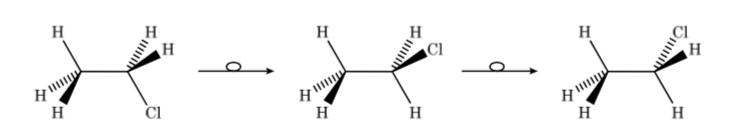
Jadi, dalam kasus chloroethane kita dapat mewakili konformer yang berbeda dalam perspektif sebagai berikut:
Isomer konfigurasi dan konformasi adalah stereoisomer. Stereoisomer memiliki konektivitas yang sama tetapi berbeda dalam orientasi beberapa atomnya di ruang angkasa. Mereka sering menghadirkan perbedaan yang cukup besar dalam sifat fisik, kimia dan biologisnya.
KONFORMASI DALAM MOLEKUL ORGANIK ASIKLIK
Representasi molekul organik
Ada beberapa cara untuk merepresentasikan molekul dalam bidang.
Representasi dalam Perspektif atau Kuda-kuda
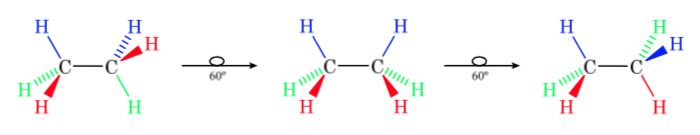
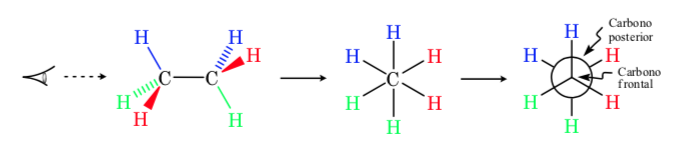
Proyeksi Newman
Dalam proyeksi Newman, dua atom karbon yang berdekatan dalam sebuah molekul digambarkan di dalam sebuah lingkaran. Di depan adalah atom karbon yang terlihat dari depan dan di belakang lingkaran adalah atom karbon yang tumpang tindih. Tiga substituen dari setiap karbon keluar dari pusat lingkaran di depan dan di belakang.
Representasi nelayan
Dalam representasi Fischer, atom karbon tetrahedral diwakili oleh pusat salib dan substituen ditempatkan di ujung sedemikian rupa sehingga garis vertikal menunjukkan bahwa ikatan diarahkan ke bagian belakang bidang kertas dan yang mendatar ke depan. . Rantai utama disusun secara vertikal.
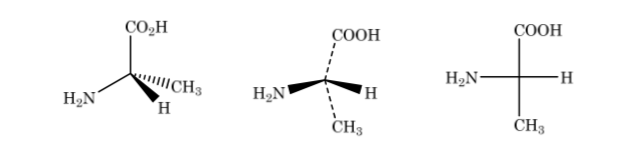
Seperti yang ditunjukkan di atas representasi asam 2-aminopropanoat
Jika senyawa tersebut memiliki atom karbon yang berbeda, rantai karbon ditarik secara vertikal dengan substituen setiap karbon secara horizontal, selalu mempertahankan aturan bahwa ikatan vertikal berada di belakang bidang dan ikatan horizontal di depan.
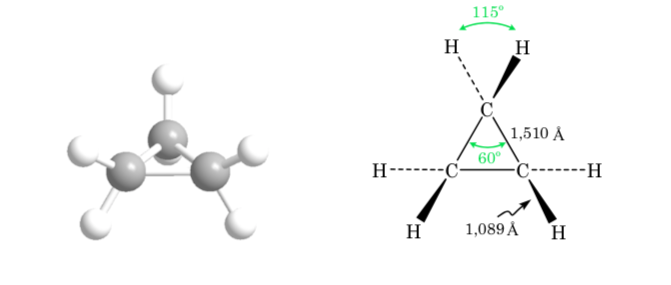
konformasi etana
Ikatan σ yang bergabung dengan atom karbon dalam etana berbentuk silinder simetris dan memungkinkan rotasi bebas di sekelilingnya. Rotasi di sekitar ikatan C–C mengubah konformasi etana yang berbeda. Studi tentang perilaku termodinamika dan kinetiknya disebut Analisis Konformasi.
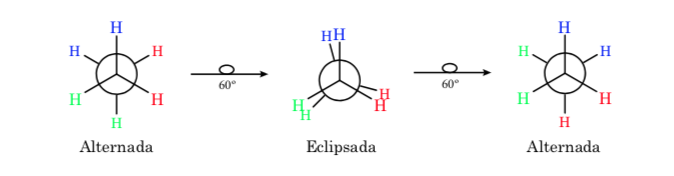
Gambar pertama mewakili molekul etana di mana atom hidrogen berada sejauh mungkin dengan interaksi minimal di antara mereka. Ini disebut konformasi alternatif.
Yang kedua berasal dari putaran 60o ke ikatan C–C dan di mana atom hidrogen terhalang.
Sekali lagi, putaran 60o ke ikatan C–C menghasilkan konformasi alternatif.
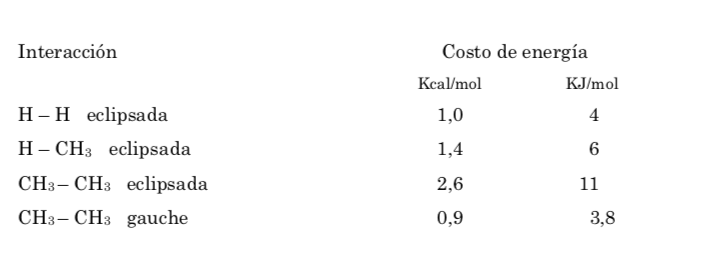
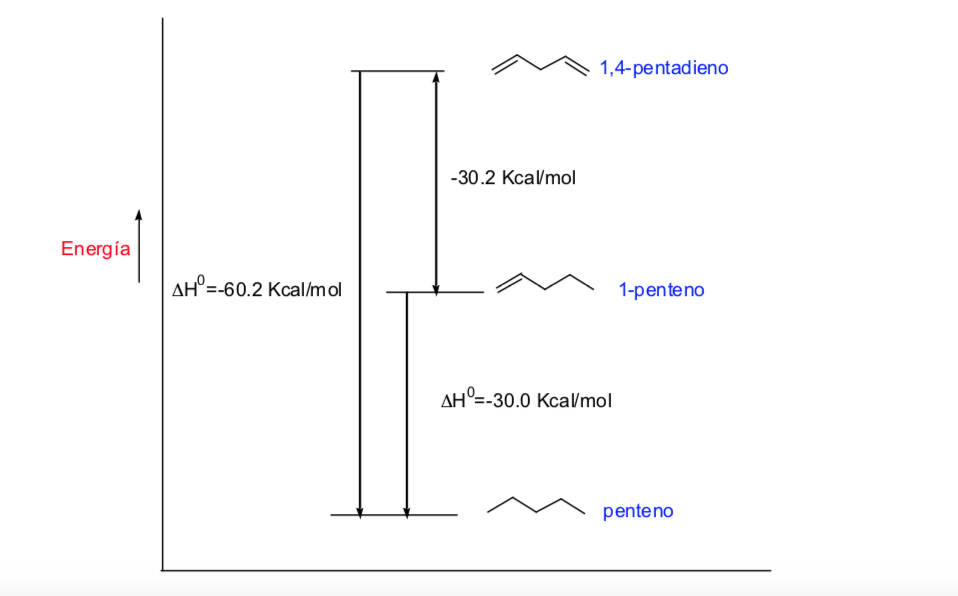
Energi potensial molekul minimal untuk konformasi terhuyung-huyung, meningkat dengan rotasi, dan mencapai maksimum untuk konformasi gerhana. Perbedaan energi atau hambatan energi yang harus diatasi untuk berpindah dari satu konformasi ke konformasi lainnya berorde 3 kkal (lihat gambar).
Sebagian besar molekul etana ada secara alami dalam konformasi yang paling stabil. Karena penghalang energi tidak terlalu tinggi pada suhu kamar, jumlah tumbukan dengan energi yang cukup cukup besar sehingga interkonversi konformer berlangsung cepat. Energi yang dibutuhkan untuk memutar molekul di sekitar ikatan C–C disebabkan oleh regangan torsional.
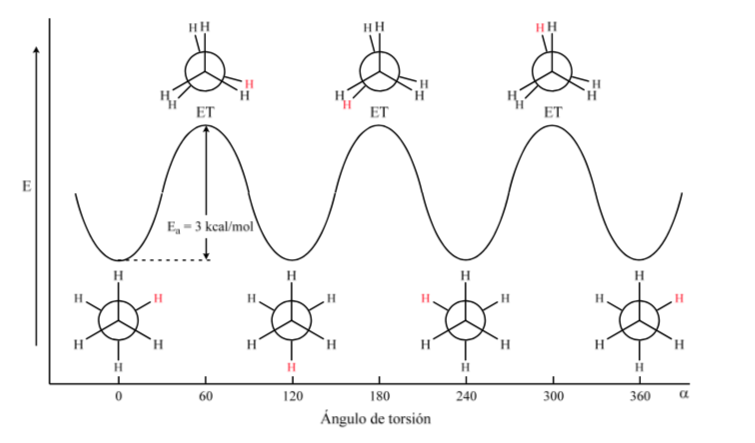
Diagram di atas menunjukkan perubahan energi ketika berpindah dari satu konformasi ke konformasi lainnya selama rotasi ikatan tunggal C–C.
Ketika hidrogen etana digantikan oleh atom atau gugus lain, tingkat energi konformasi akan berubah dan studinya harus dilakukan untuk setiap kasus.
konformasi propana
Dalam kasus molekul propana, jika kita merepresentasikan proyeksi Newman menurut salah satu ikatan C-C dan kita memutar ikatan tersebut, kita menemukan diri kita, seperti dalam kasus etana, dengan konformasi gerhana dan alternatif.
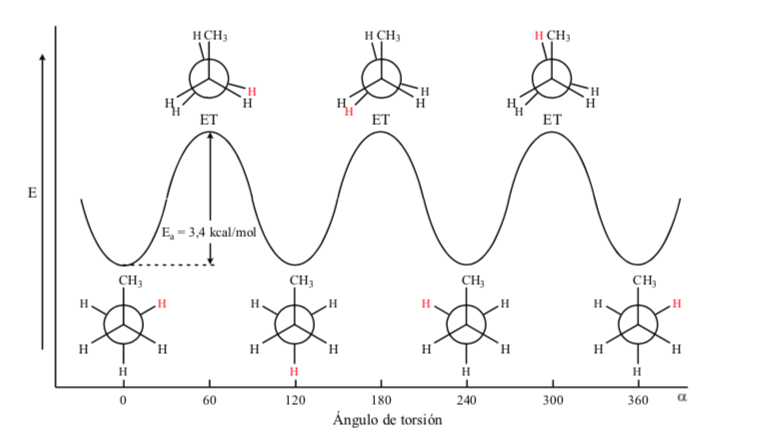
Penghalang energi antara bentuk pengganti dan bentuk gerhana lebih besar daripada etana (3,4 kkal mol-1) karena gugus metil lebih besar daripada hidrogen dan interaksinya lebih besar. Konformasi terhuyung-huyung lebih stabil daripada konformasi gerhana.
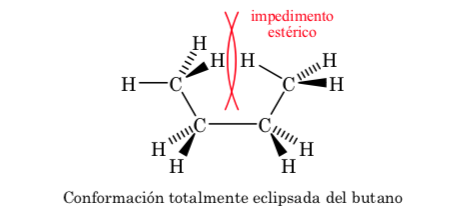
Konformasi n-Butana
Jika kita melihat ikatan C–C pusat, kita dapat mempertimbangkan butana saat merepresentasikannya di Newman sebagai molekul yang mirip dengan etana di mana dua atom hidrogen telah digantikan oleh dua gugus metil.
Seperti pada etana, konformasi alternatif memiliki energi yang lebih rendah dan lebih stabil daripada yang gerhana: 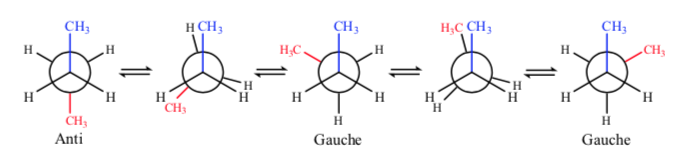
Dari semua konformasi alternatif, konformasi dengan dua gugus metil pada posisi yang paling berlawanan (sudut dihedral 180o) disebut konformasi anti dan paling stabil. Dua konformasi alternatif lainnya memiliki energi yang sama satu sama lain dan disebut konformasi gauche di mana gugus metil bertemu pada sudut dihedral 60o satu sama lain. Dua konformasi seperti itu ada tergantung pada rotasi di sekitar ikatan C–C.
Dari tiga konformasi gerhana, pertama-tama kami menyoroti salah satu di mana dua gugus metil gerhana, yang menghasilkan interaksi yang lebih besar dan oleh karena itu stabilitasnya lebih rendah. Dua konformasi gerhana lainnya memiliki kandungan energi yang lebih rendah dan agak lebih stabil. Lihat diagram energi.
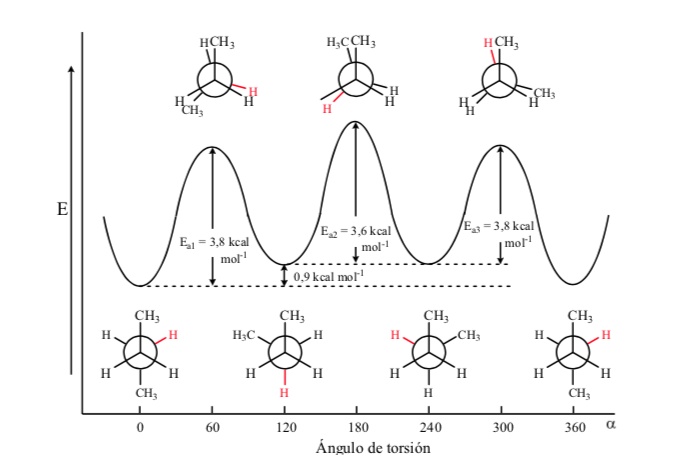
Tabrakan memberikan energi yang dibutuhkan untuk mengatasi penghalang energi aktivasi.
KONFORMASI DALAM MOLEKUL ORGANIK SIKLIK
Sikloalkana mengalami regangan cincin yang disebut regangan Bayer karena struktur sikliknya. Ketegangan ini adalah hasil dari tiga faktor:
- Tegangan Tautan
- Gerhana atom dan ikatan - Steric Strain
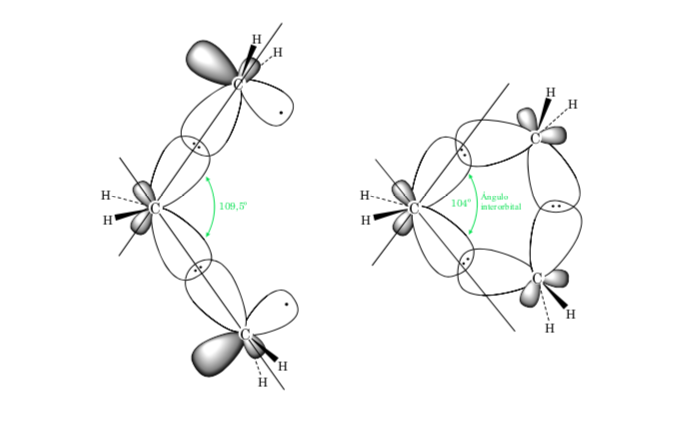
A. Strain Ikatan dalam sikloalkana disebabkan oleh perbedaan tumpang tindih orbital sehubungan dengan alkana asiklik. Semakin dekat nilai sudut C–C–C dengan tetrahedral (109,5o), semakin besar overlap dan semakin rendah tegangan ikatan.
Efek sterik disebabkan oleh interaksi atom melalui ruang. Untuk menghindari interaksi antar atom yang tinggi, molekul memperoleh konformasi preferensial, ini yang paling stabil. Untuk mengurangi tekanan dan dengan demikian mencapai stabilitas, konformasi yang disukai adalah salah satu di mana kelompok-kelompok besar terpisah sejauh mungkin.
KONFORMASI DALAM SIKLUS TIGA, EMPAT DAN LIMA ATOM KARBON
siklopropana
Penyimpangan sudut ikatan cincin beranggota tiga dari sudut yang sesuai dengan hibridisasi sp3 besar, sehingga siklopropana memiliki regangan sudut yang sangat tinggi.
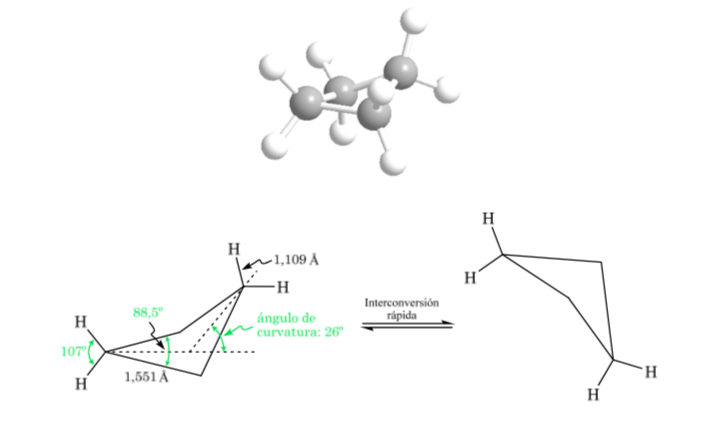
Cyclobutane: Konformasi kupu-kupu
Molekul memiliki struktur yang sedikit melengkung. Ikatan C–C kurang melengkung dan reaktivitasnya lebih kecil daripada kasus siklopropana. Interkonversi antara konformasi yang berbeda cepat.
Cyclopentane: Konformasi pada
Cyclopentane, jika planar, akan memiliki regangan gerhana yang tinggi, karena sepuluh interaksi H–H gerhana, menghasilkan lipatan pada cincin. Lipat melepaskan tegangan torsional. Cyclopentane tidak menunjukkan reaktivitas cincin beranggota tiga dan empat.
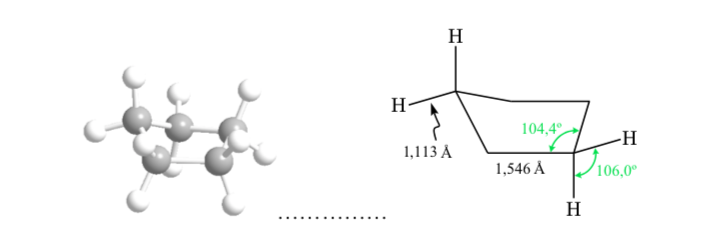
ANALISIS KONFORMASI SIKLOHEKSAN : Konformasi kursi
Jika sikloheksana memiliki struktur planar, ia akan memiliki sudut ikatan 120o. Karbon hibridisasi sp3 bebas regangan memiliki sudut tetrahedral 109,5o, yang menyebabkan sikloheksana mengasumsikan konformasi non-planar dan lebih stabil: konformasi kursi.
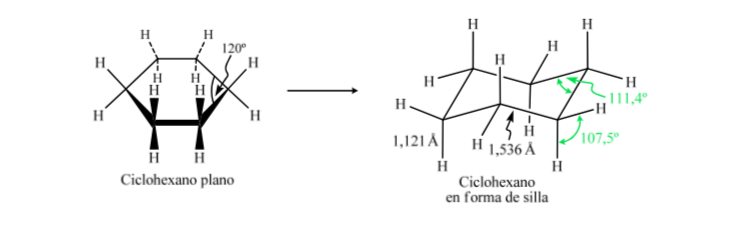
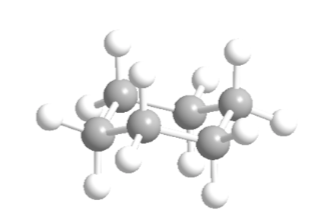
Sikloheksana dalam konformasi kursi memiliki 6 atom hidrogen aksial dan 6 hidrogen ekuatorial. Hidrogen aksial diarahkan ke atas dan ke bawah cincin, sedangkan hidrogen ekuator diarahkan keluar dari cincin.
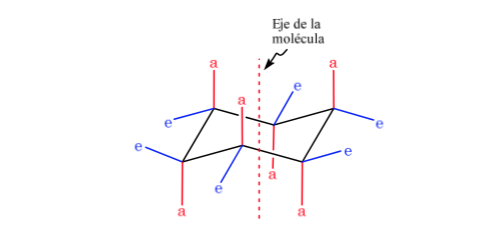
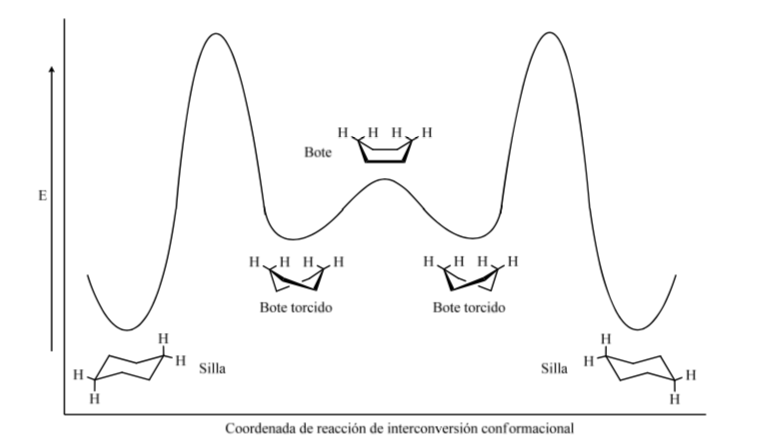
Sikloheksana dalam konformasi kursi rentan untuk mengubah konformasinya dengan kursi lain dengan stabilitas yang sama. Fenomena ini disebut interkonversi dua bentuk kursi.
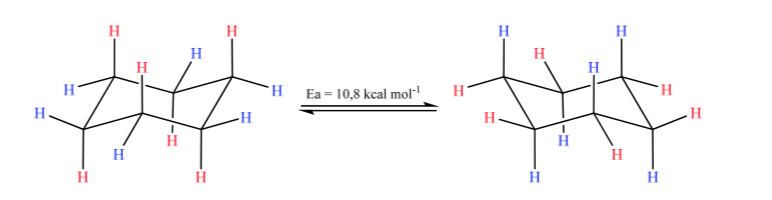
Melihat lebih dekat pada interkonversi, diamati bahwa ikatan C-H aksial menjadi ekuatorial dan sebaliknya, ekuatorial menjadi aksial.
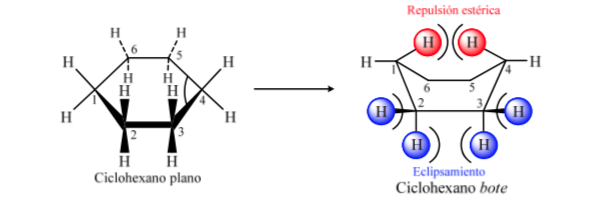
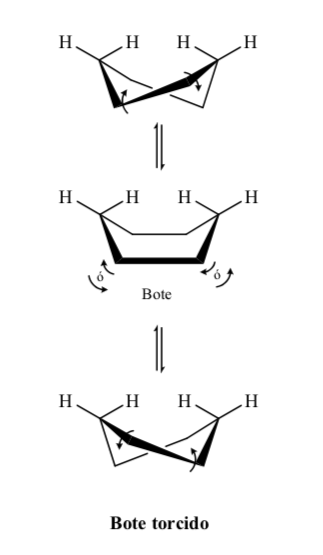
Tingkat energik konformer sikloheksana:
Jika kita mengamati konformasi kursi sikloheksana sedemikian rupa sehingga atom C-2 tumpang tindih dengan atom C-3 dan atom C-6 tumpang tindih dengan C-5, kita dapat menggambar proyeksi sikloheksana Newman:
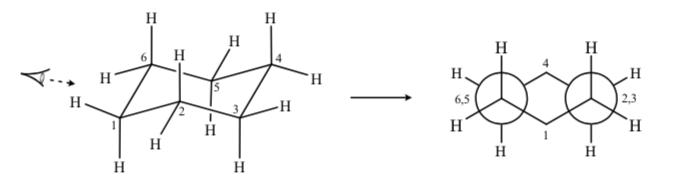
SIKLOHEKSAN TERGANTI
Jika kita mempertimbangkan metilsikloheksana, kita dapat mengusulkan dua struktur yang mewakilinya bergantung pada apakah gugus metil berada dalam posisi aksial atau ekuatorial.
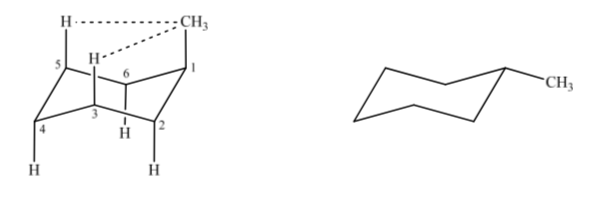
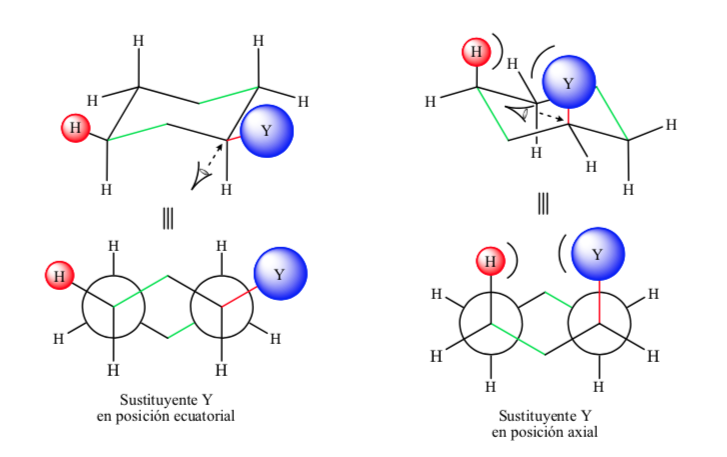
Jika substituen non-hidrogen berada pada posisi aksial, interaksi dengan hidrogen pada posisi 3 dan 5 cincin terjadi karena kedekatan spasial. Jika berada pada posisi ekuator, substituen diarahkan keluar dari ring dan interaksinya lebih kecil. Seperti yang diharapkan, konformasi dengan substituen ekuator ditemukan sekitar 1,8 kkal lebih stabil daripada jika substituen berada pada posisi aksial. Dengan demikian dikatakan bahwa substituen pada posisi aksial menyajikan interaksi 1,3-diaxial yang membuatnya kurang stabil dibandingkan pada posisi ekuator.
Gambar berikut mewakili Newman dua konformasi sikloheksana tersubstitusi dengan kedua substituen pada posisi ekuator dan aksial.
Sikloheksana tersubstitusi
A. 1,1-dimetilsikloheksana B. 1,2-dimetilsikloheksana C. 1,3-dimetilsikloheksana D. 1,4-dimetilsikloheksana
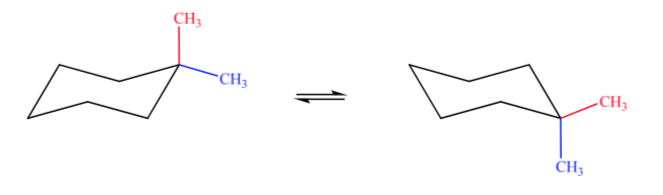
Dalam kasus A, satu gugus metil akan berada pada posisi aksial dan yang lainnya pada posisi ekuator, sehingga dua konformasi yang mungkin akan sama-sama stabil.
Dalam setiap kasus yang tersisa kita dapat mewakili dua struktur yang berbeda tergantung pada apakah kedua metil berada di cis (diarahkan ke sisi bidang yang sama) atau di trans (diarahkan ke sisi yang berlawanan).
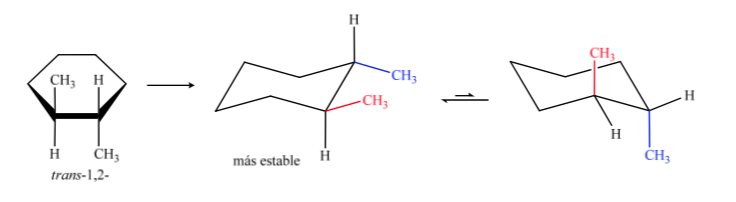
Dalam B, isomer cis harus memiliki kedua metil pada sisi yang sama dari bidang pusat, sehingga satu metil akan aksial dan ekuator lainnya.
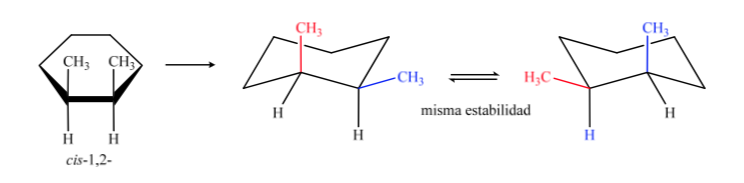
Isomer trans adalah isomer dengan dua metil menghadap sisi yang berlawanan, sehingga akan menampilkan kedua metil dalam posisi aksial atau keduanya dalam posisi ekuatorial. Konformasi yang keduanya hadir di ekuator lebih stabil daripada di aksial, oleh karena itu kita dapat mengatakan bahwa isomer trans-1,2-dimetilsikloheksana lebih stabil daripada isomer cis-1,2-dimetilsikloheksana.
Dalam kasus 1,3-dimethylcyclohexane kami dapat mewakili:
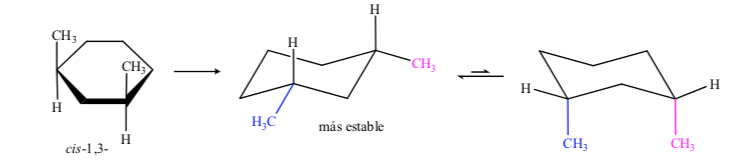
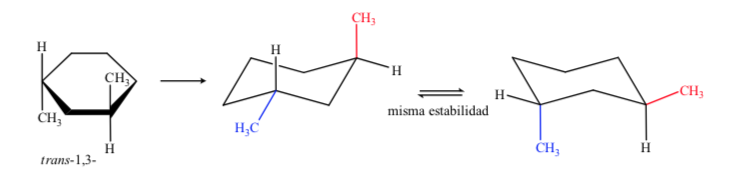
Disimpulkan bahwa isomer cis, yang menghadirkan dua substituen di ekuator, lebih stabil daripada trans, yang akan selalu memiliki satu metil di aksial dan lainnya di ekuator.
Dalam kasus D, 1,4-dimethylcyclohexane kita akan mendapatkan:
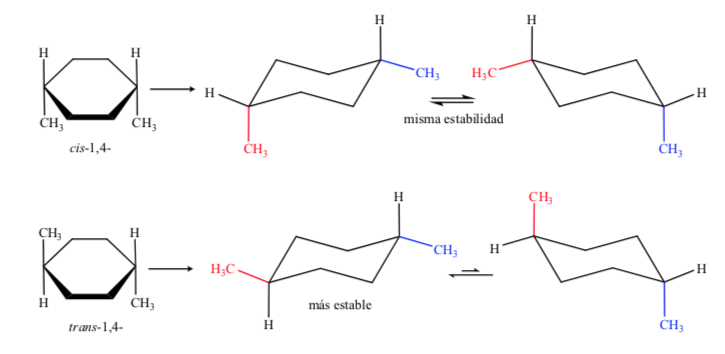
Dalam hal ini, isomer trans lebih stabil karena kedua metil tersusun secara ekuatorial.
Ketika berhadapan dengan sikloheksana tersubstitusi dengan gugus yang berbeda, isomer yang paling stabil adalah isomer dengan gugus ekuatorial terbesar.
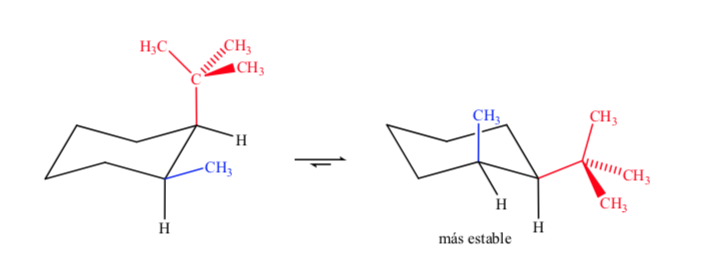
Akhirnya, dalam kasus sikloheksana polisubstitusi yang memiliki substituen yang berbeda, konformasi yang lebih disukai adalah konformasi dengan jumlah gugus besar terbesar pada posisi ekuatorial.
KONFORMASI DALAM HETEROSIKLUS BERANGGOTA ENAM:
EFEK ANOMERIK
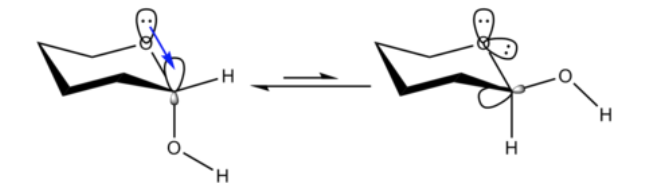
Dalam kimia organik, efek anomerik atau efek Edward-Lemieux adalah efek stereoelektronik yang menjelaskan kecenderungan substituen heteroatomik yang berdekatan dengan heteroatom dalam cincin sikloheksana untuk memilih orientasi aksial daripada orientasi ekuatorial yang kurang tertutup, seperti yang diharapkan. pertimbangan sterik. Efek ini awalnya diamati pada cincin piranosa oleh JT Edward pada tahun 1955; pada saat itu, N.-J. Chii dan Raymond U. Lemieux mulai mempelajari kesetimbangan anomerisasi turunan asetat penuh dari beberapa aldohexopyranoses. Istilah "efek anomerik" diperkenalkan pada tahun 1958.
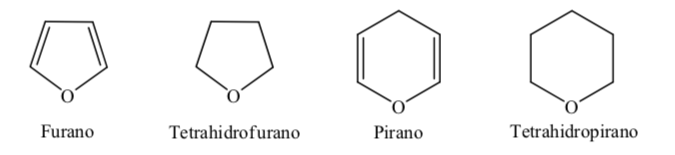
Beberapa heterosiklik beranggota lima dan enam yang paling umum dalam proses biologis adalah:
A. Heterocycles teroksigenasi:
B. Heterocycles nitrogen:
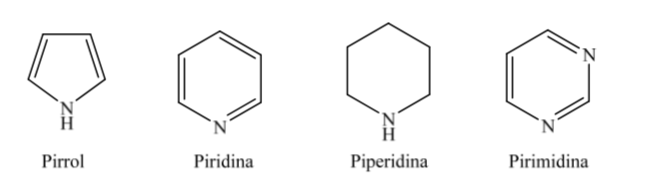
Ketika berbicara tentang heterosiklik terhidrogenasi penuh dengan anggota lima dan enam seperti tetrahidrofuran dan tetrahidropiran, konformasi paling stabil yang mereka hadirkan serupa dengan masing-masing siklopentana dan sikloheksana, yaitu konformasi pada atau kursi konformasi.
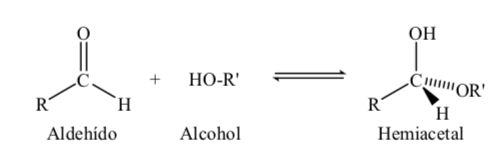
Gula dengan atom karbon 5 dan 6 memperoleh struktur siklik ketika ikatan hemiasetal dibentuk oleh reaksi karbonil (gula aldehida atau keton) dengan gugus hidroksil.
Reaksi pembentukan hemiasetal dapat digambarkan sebagai berikut:
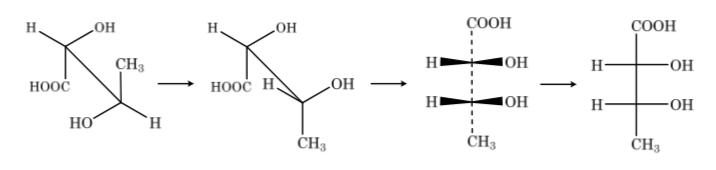
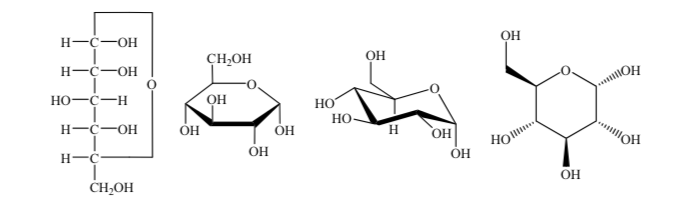
Untuk studi mereka, gula diwakili oleh struktur linier mengikuti aturan proyeksi Fischer.
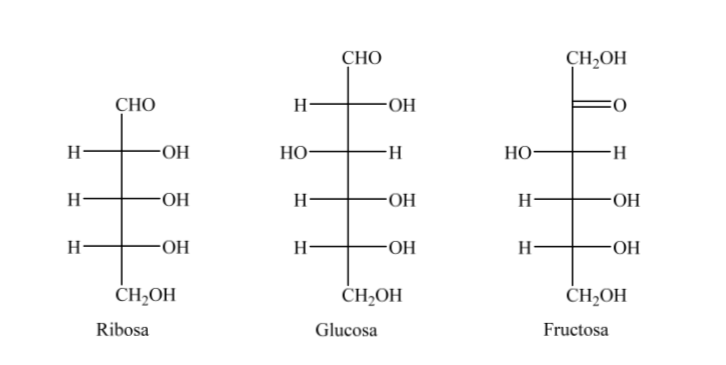
Jadi, sebagai contoh, kita dapat merepresentasikan ribosa, glukosa, dan fruktosa:
Ketika hemiasetal terbentuk, molekul memperoleh susunan melengkung di mana fungsi aldehida aldosa pada karbon 1 terletak dekat dengan hidroksil pada karbon 5, menambah ikatan rangkap karbonil, menghasilkan hemiasetal siklik beranggota enam (cincin piranosida). ).
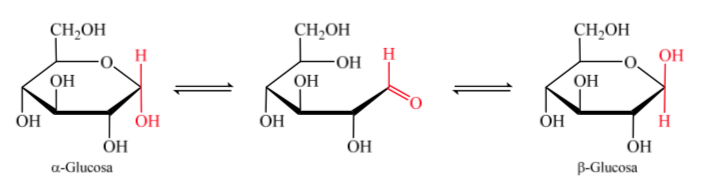
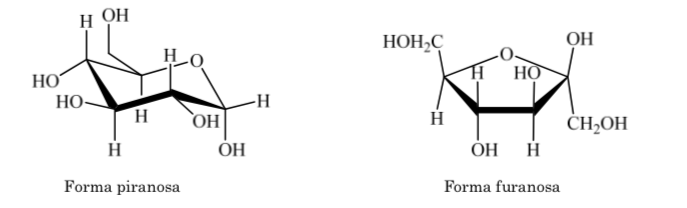
Hal yang sama terjadi dengan ketosa, tetapi dalam hal ini ikatan hemiasetal terjadi antara karbon 2 dan karbon 5, membentuk cincin beranggota lima. (cincin furanosida).
Berbagai cara untuk merepresentasikan struktur glukosa dalam bentuk siklik digunakan:
anomer
Isomer monosakarida dengan lebih dari 5 atom karbon yang telah mengembangkan ikatan hemiasetal disebut anomer, yang memungkinkannya mengambil struktur siklik dan menentukan 2 posisi berbeda untuk gugus hidroksil (α atau β) di pusat baru yang dibuat. .
Cincin piranosa harus mirip dengan sikloheksana dan ada di konformasi kursi lebih disukai daripada konformasi kapal pelintir untuk meminimalkan tekanan torsional. Analisis sinar-X menunjukkan asumsi ini benar.
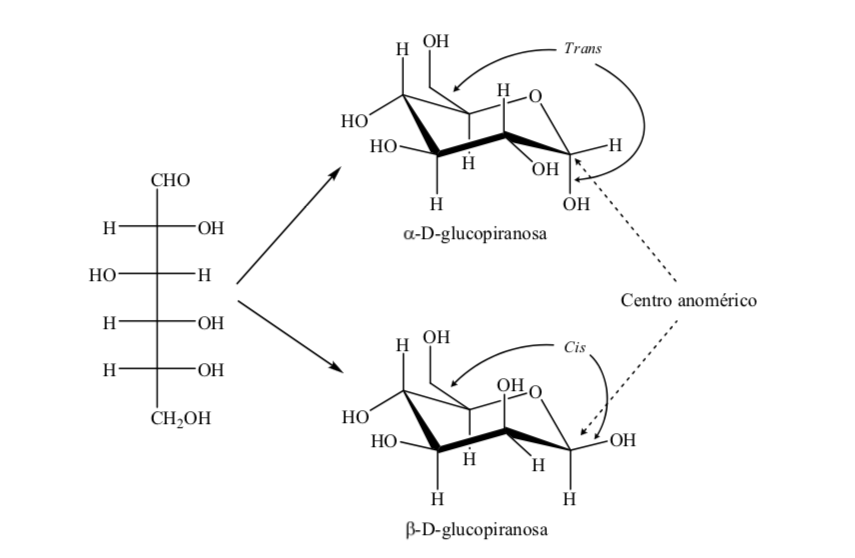
Kedua anomer disebut anomer alfa (α) atau beta (β), sesuai dengan hubungan konfigurasi antara pusat anomerik dan atom referensi anomerik. Pusat anomerik berada pada karbon hemiasetal dan merupakan karbon anomerik C-1, yang terikat melalui oksigen ke C-5, yang terikat pada oksigen hemiketal.
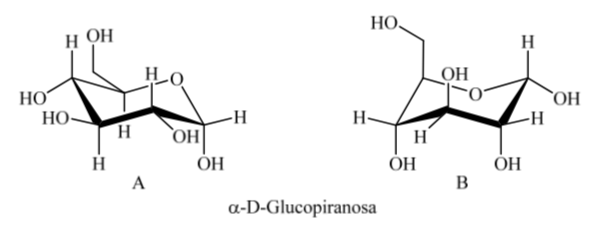
Akan tetapi, ada dua kemungkinan konformasi kursi untuk anomer D-(+)-glukopiranosa yang sama.
Jadi, untuk β-D-(+)-glukopiranosa ada dua kemungkinan konformasi. Salah satu yang menghadirkan kelompok paling banyak di ekuator (A) akan lebih stabil.
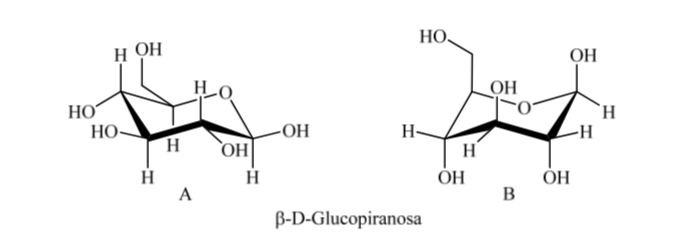
Apa yang terjadi pada α-D-(+)-glukosa? Dalam hal ini, konformasi yang paling stabil adalah konformasi di mana OH pada karbon anomerik adalah aksial dan gugus besar adalah ekuatorial (A).
Sangat menarik untuk dicatat bahwa dari semua D-aldohexoses, hanya β-D-(+)-glucopyranose dapat mengambil konformasi di mana masing-masing kelompok besar dapat menempati posisi ekuatorial. Hal ini sesuai dengan fakta bahwa β -D-(+)-glukopiranosa merupakan gula dengan kandungan tertinggi di alam.
efek elektronik
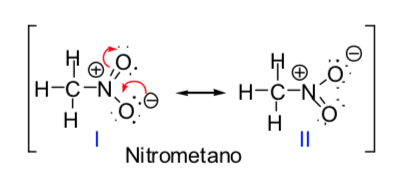
Beberapa molekul organik dapat diwakili oleh dua atau lebih struktur Lewis, yang berbeda satu sama lain hanya dalam penempatan elektron dan disebut struktur s-resonansi. Dalam kasus ini, molekul akan memiliki karakteristik dari kedua struktur, dan molekul tersebut sebenarnya dikatakan sebagai hibrid resonansi dari struktur resonansi. Metode resonansi memungkinkan kita untuk mengetahui, secara kualitatif, stabilisasi yang dapat dicapai molekul dengan delokalisasi elektronik. Semakin besar jumlah struktur resonansi yang dapat menggambarkan suatu spesies kimia, semakin besar stabilitasnya.
Konsep struktur resonansi dapat diterapkan dalam deskripsi nitrometana, yang dapat diwakili oleh dua struktur Lewis di bawah ini:
Ikatan konjugasi dan energinya
Analisis konformasi aromatisitas
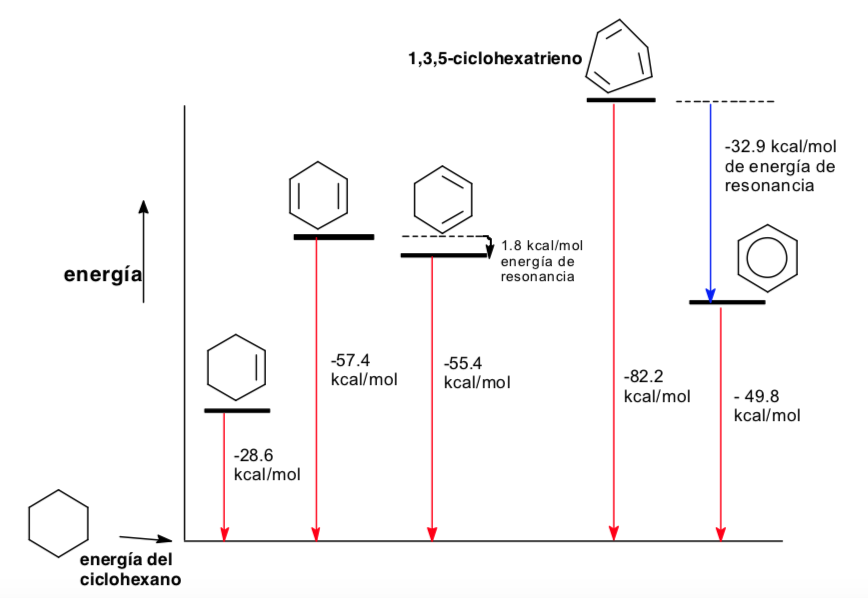 Analisis termodinamika dan konformasi (efek stereoelektronik)
Analisis termodinamika dan konformasi (efek stereoelektronik)
Hal ini tidak mengherankan bahwa substituen metoksi pada cincin sikloheksana lebih memilih untuk mengadopsi konformasi ekuatorial.
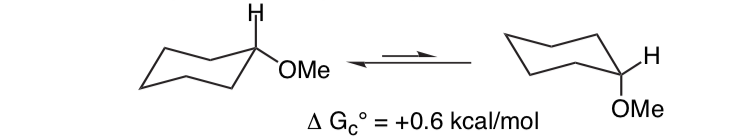
Apa yang tidak terduga adalah bahwa 2-methoxytetrahydropyran ClH O yang terkait erat lebih menyukai konformasi aksial:
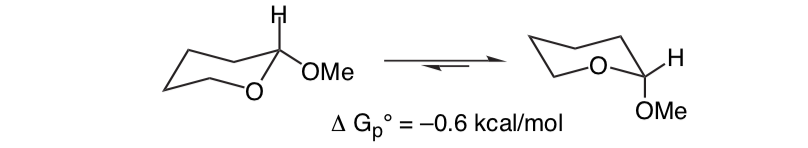
Efek ini yang menyediakan stabilisasi pembentuk-O aksial yang membatalkan bias sterik inheren dari substituen disebut efek anomerik.
Hubungan energi bebas sehubungan dengan efek anomerik adalah sebagai berikut:
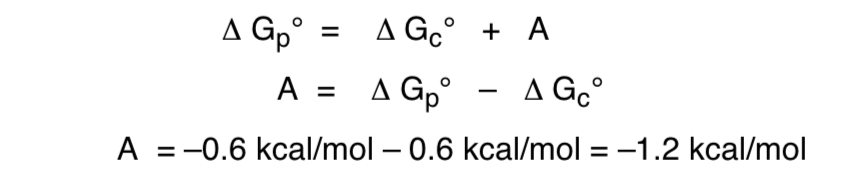
Sumber yang disarankan untuk memperluas pencarian:
1) Juaristi E. “Konsep dasar teori orbital”. CINVESTAV, Meksiko, 1988 Juaristi E. "Fisikokimia Organik." CINVESTAV, Meksiko, 1994.
2) Neil SI “Kimia Organik Fisik” Longman, Milan, 1995.
3) March J., “Kimia Organik Tingkat Lanjut” John Wiley & Sons, New York, 1992 4) Jones RAY “Kimia Organik Fisik dan Mekanistik”, ke-2. Ed Cambridge University Press, Cambridge, 1984.
5) Woodward RB dan Hoffmann R. “The Conservation of Orbital Symmetry”, Academic Press, New York, 1979.
6) Carpenter BK “Penentuan Mekanisme Reaksi Organik”, John Wiley & Sons, New York, 1984 .