Stereochimica
La stereochimica è lo studio dei composti organici nello spazio. Per comprendere le proprietà dei composti organici è necessario considerare tutte e tre le dimensioni spaziali. Le basi della stereochimica furono poste da Jacobus van't Hoff e Le Bel, nell'anno 1874, così come da Ernest L. Eliel nel XX secolo. Hanno proposto in modo indipendente che i quattro sostituenti su un carbonio puntino verso i vertici di un tetraedro, con il carbonio al centro del tetraedro.
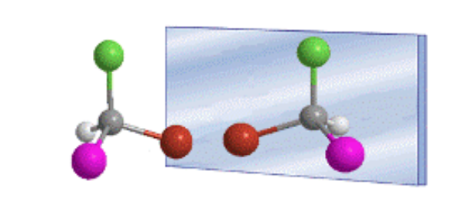
La disposizione tetraedrica dei sostituenti su un carbonio sp 3 dà origine all'esistenza di due possibili composti, che sono immagini speculari non sovrapponibili, chiamati enantiomeri.
In generale, le molecole che differiscono per la disposizione spaziale dei loro atomi sono chiamate stereoisomeri.
Isomeria
Gli isomeri sono quei composti che hanno formule molecolari identiche ma che differiscono nella natura o nella disposizione dei legami tra i loro atomi o nella disposizione dei loro atomi nello spazio.
Per interpretare le differenze nelle proprietà, i chimici del secolo scorso hanno immaginato che gli atomi di una molecola avessero particolari disposizioni spaziali che spiegassero i loro diversi comportamenti.
La classificazione per funzione chimica, stabilita in base al comportamento dei composti, è stata messa in relazione alla presenza nella molecola di un gruppo di atomi chiamato gruppo funzionale.
Oltre all'importanza del gruppo funzionale, c'è una differenza di comportamento indotta da lievi differenze nella disposizione dei diversi atomi che compongono il resto della molecola. Queste differenze possono rispondere a diverse classi di isomeria:
funzione isomerismo
Gli isomeri costituzionali, che differiscono l'uno dall'altro in quanto i loro gruppi funzionali sono diversi, appartengono a questo tipo di isomeria.
Il gruppo funzionale in entrambi gli isomeri è diverso
C2H6O _
Etanolo (CH 3 -CH 2 -OH) e dimetil etere (CH 3 -O-CH 3 )
L'alcool reagisce con il sodio mentre con l'etere non si osserva alcuna reazione.
Dal punto di vista fisico l'alcol è un liquido con punto di ebollizione a 78,5°C, mentre l'etere è un gas che liquefa a -23°C.
Isomeria di posizione e/o scheletro.
I gruppi funzionali sono identici ma si trovano in posizioni diverse sullo scheletro molecolare (isomeri posizionali).
Es: 2-esanolo e 3-esanolo:
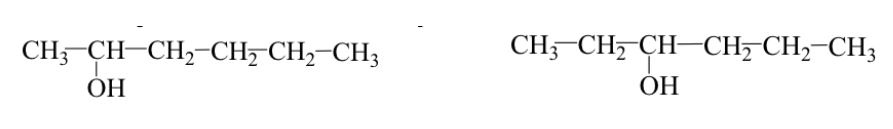
A volte il gruppo alchilico ha una disposizione diversa (dorsale o isomeri ramificati).
Es: 3-metil-2-pentanolo e 2-esanolo
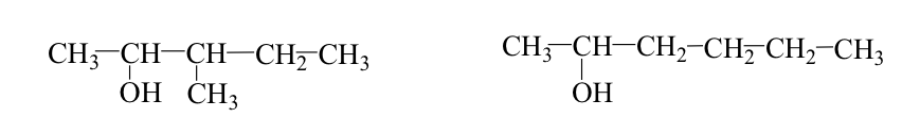
Entrambi i casi possono verificarsi contemporaneamente:
Es: 3-metil-2-pentanolo e 3-esanolo
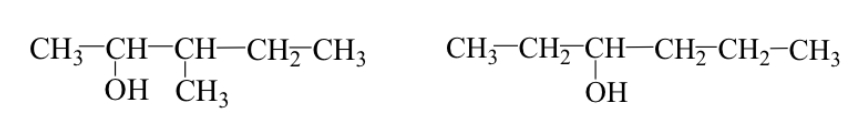
tautomerismo
Sono isomeri costituzionali di facile interconversione perché sono in rapido equilibrio tra loro. Il fenomeno è chiamato tautomerismo e di solito consiste in un atomo, solitamente idrogeno, situato in una triade di atomi, e un doppio legame che cambia posizione contemporaneamente.
L'esempio più classico è l'equilibrio cheto-enolico ( -ene per il doppio legame e -olo per l'alcol).
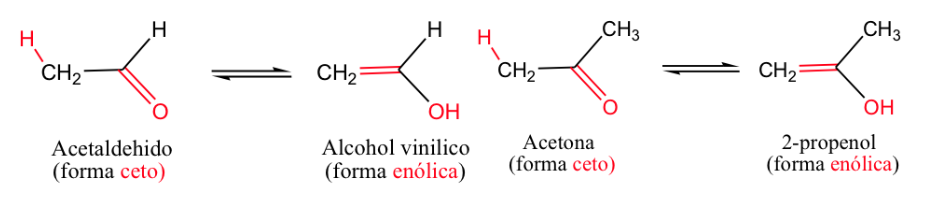
Generalmente, le forme chetoniche sono le più stabili, ma quando la forma enolica si stabilizza (mediante legame idrogeno o risonanza) l'equilibrio si sposta.
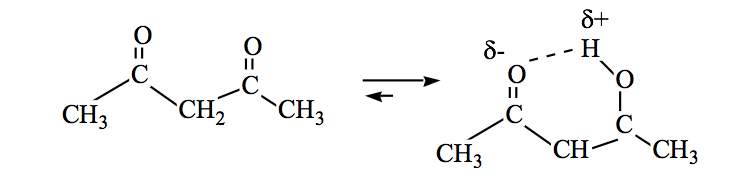
Le ammidi possono anche essere in equilibrio cheto-enolico:
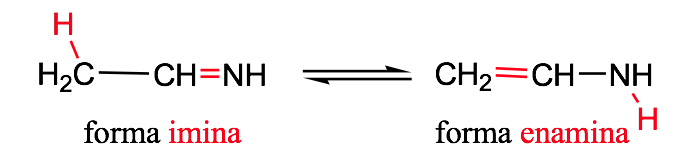
tautomerismo immina-enamminico :
nitro-aci
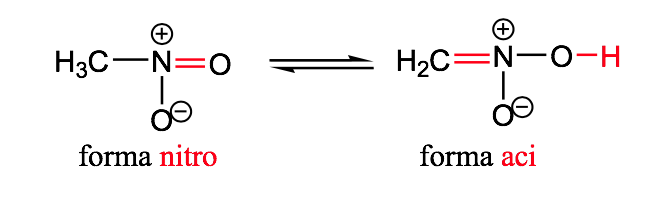
isomeria geometrica
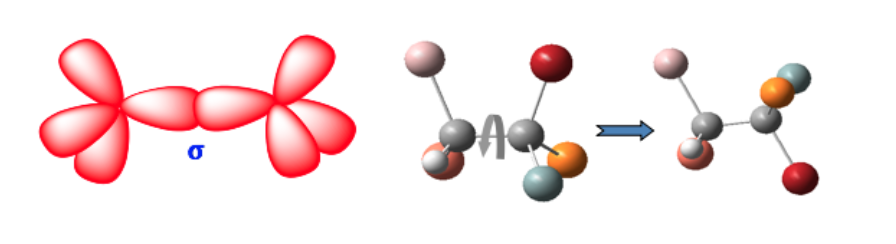
Queste due forme non sono isomeri geometrici poiché la rotazione libera attorno al singolo legame converte una forma in un'altra (conformatori).
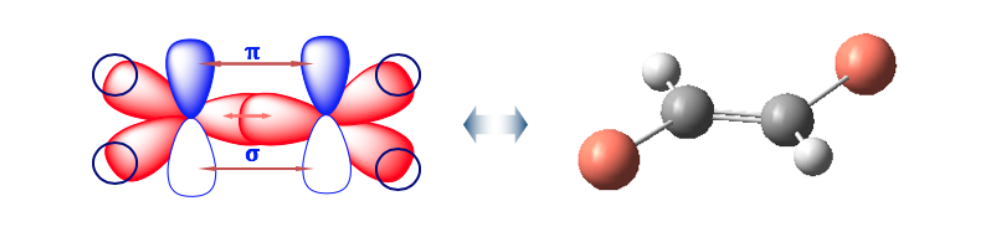
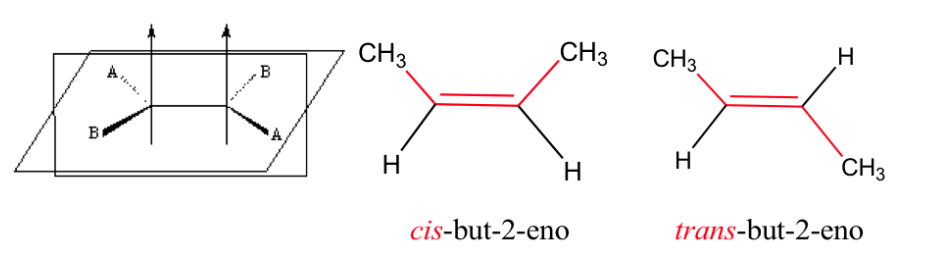
Il doppio legame non consente la rotazione libera, che può generare due strutture diverse a seconda della posizione dei gruppi A e B nello spazio: sono isomeri geometrici .
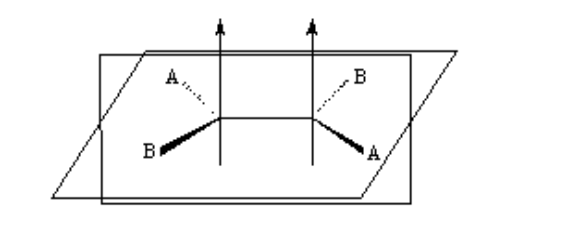
isomerismo negli alcheni
Affinché esista l'isomerismo geometrico, devono essere soddisfatte due condizioni:
1.- Rotazione impedita (ad esempio da un doppio legame)
2.- Due diversi gruppi (A e B) fissati su entrambi i lati del collegamento
Effetto dell'isomerismo geometrico sulle proprietà fisiche

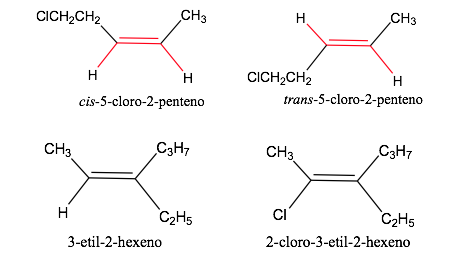
Nomenclatura geometrica degli isomeri
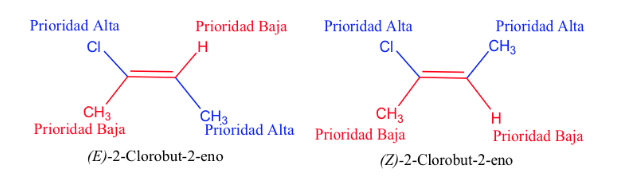
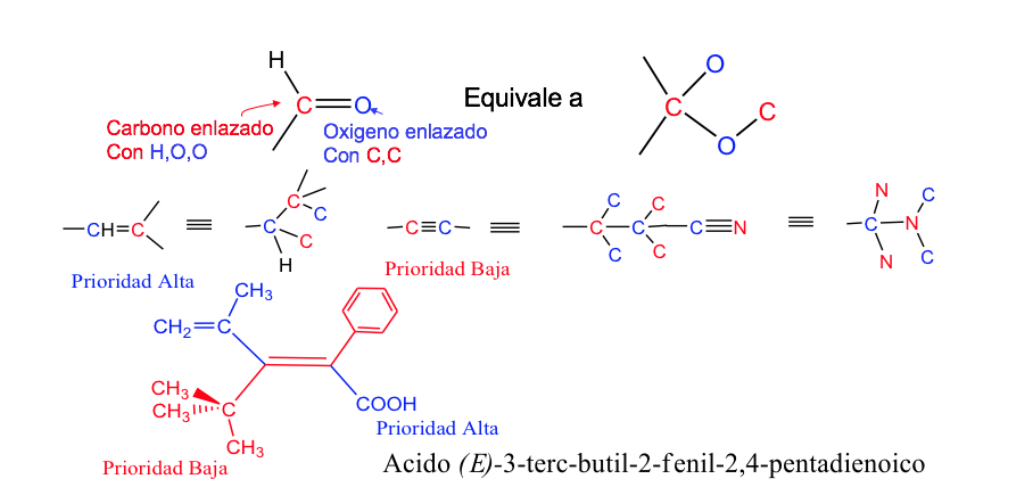
 Regole di sequenza o priorità
Regole di sequenza o priorità
Le regole che devono essere prese in considerazione per stabilire l'ordine di priorità o preferenza di atomi o gruppi di atomi sono state stabilite nel 1956 da Cahn , Ingold e Prelog e modificate più volte per evitare ambiguità.
Quando i gruppi ad alta priorità giacciono sui lati opposti del piano perpendicolare alla molecola, l'isomero è chiamato E.
Quando sono sullo stesso lato di questo piano, l'isomero è chiamato Z.
Esempio: but-2-ene:
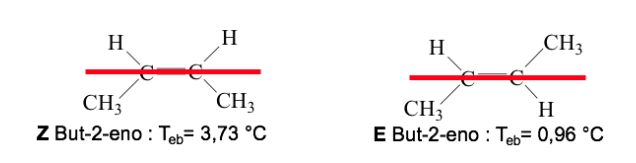
La priorità dei sostituenti sui carboni del doppio legame può essere dedotta dalle seguenti regole:
- Regola 1:
- Se gli atomi attaccati all'atomo di carbonio in studio sono diversi, quelli con il numero atomico più alto hanno la priorità su quelli con il numero atomico più basso e se ci sono due isotopi, sono considerati in ordine decrescente di massa atomica.
Es: Br (35)> Cl (17)> O (8)> N (7)> C (6)> H (1)
D> H e 13 C> 12 C
Regola 2 :
Quando gli atomi attaccati all'atomo di carbonio sono identici (e la prima regola non funziona), si segue la sequenza, cioè si confrontano gli atomi ad essi attaccati e, se necessario perché anch'essi uguali, gli atomi ad essi attaccati seguenti, ecc., tenendo conto che se gli atomi sono uguali ma in numero diverso, ha priorità il sostituente con più atomi di rango superiore.
Es: -CH 2 -OH> -CH 3 perché O> H
-CH 2 -Br> -CH 2 -OH perché Br> OH
-CH 2 -CH 3> -CH 3 perché C> H
Regola 3:
I doppi e tripli legami sono trattati come se fossero singoli, raddoppiando o triplicando rispettivamente gli atomi della catena.
. Isomeria di cicli e sistemi complessi.
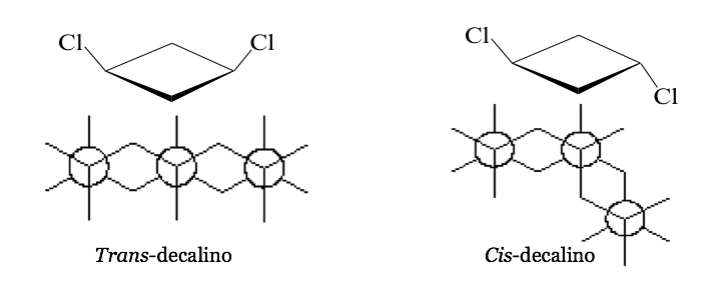
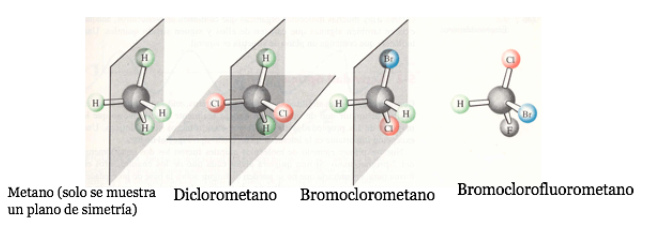
In alcune molecole cicliche simmetriche (almeno disostituite), gli atomi del ciclo definiscono un piano. Un sostituente giace verso una faccia di questo piano mentre l'altro può giacere verso lo stesso lato o verso il lato opposto.
cis -1,3-Diclorociclobutano trans- 1,3-Diclorociclobutano
Rappresentazione proiettiva (CRAM)
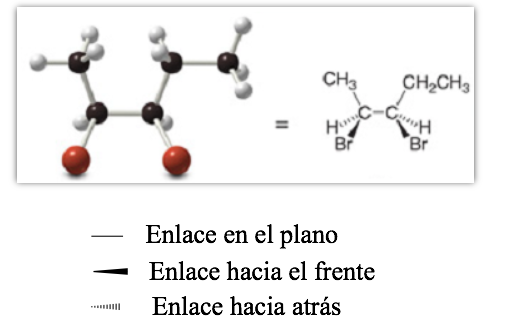
rappresentazione prospettica
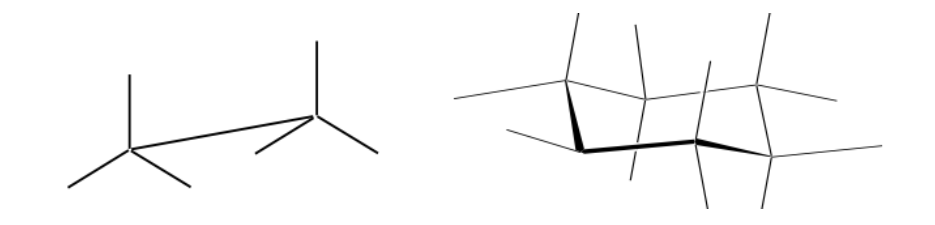
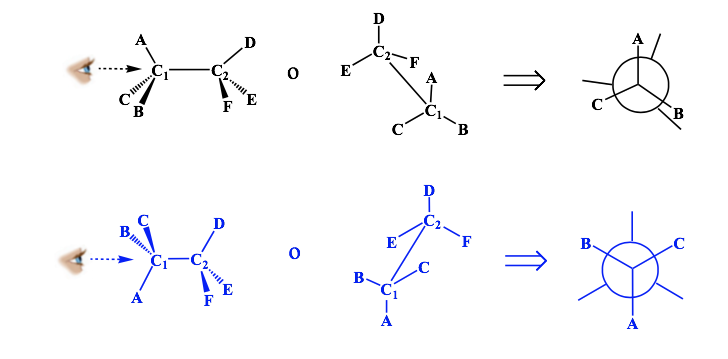
Rappresentazione di Newman
Una proiezione di Newman è una forma di rappresentazione bidimensionale utile per visualizzare le conformazioni in un singolo legame carbonio-carbonio in una molecola organica.
Rappresentazione del pescatore.
La proiezione di Fisher è un modo standard per disegnare atomi di carbonio tetraedrici e i loro sostituenti in due dimensioni.
In questa proiezione ogni carbonio tetraedrico è rappresentato come una croce in cui le linee orizzontali sono dirette fuori dalla carta e quelle verticali verso l'interno.
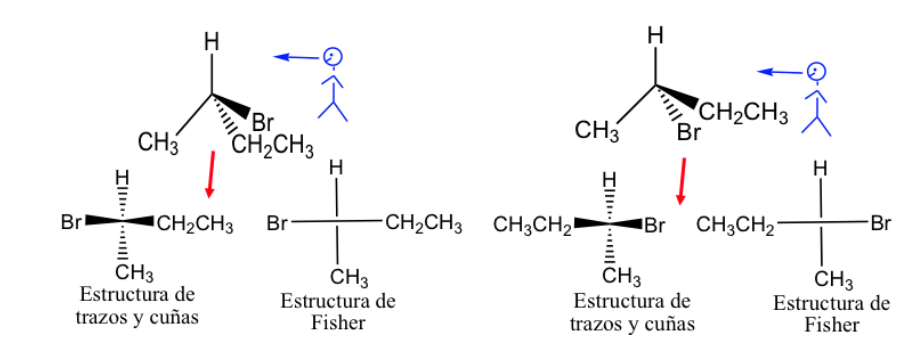
La rappresentazione di Fisher può essere fatta contrassegnando con una linea spessa i legami che si trovano davanti al piano e quelli che si trovano dietro con una linea tratteggiata, ma generalmente i diversi collegamenti sono presentati con linee normali, anche se resta inteso che i sostituenti rappresentati a la destra e la sinistra della linea verticale sono sopra il piano di rappresentazione e quelle rappresentate sopra e sotto sono sotto quel piano.
Per convenzione generale, la catena di carbonio è presentata verticalmente, mettendo in alto il carbonio più ossidato.
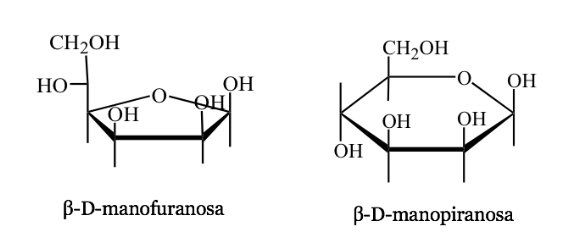
Rappresentanza Harwoth
- È una rappresentazione prospettica delle forme cicliche delle molecole di zucchero a 5 o 6 atomi (furanosi, piranosi).
- Per esempio:
chiralità
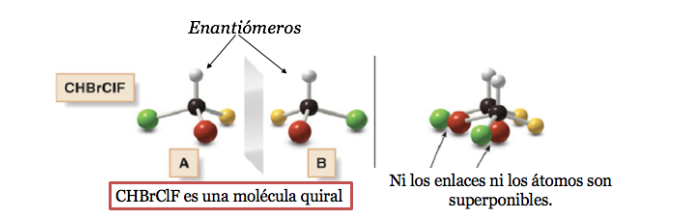
Qualsiasi figura geometrica, o qualsiasi gruppo di punti, la cui immagine in uno specchio piano, idealmente realizzato, non può essere fatta coincidere con se stessa, è detta chirale. Alcune molecole sono come le mani. La sinistra è l'immagine speculare della destra ma non sono sovrapponibili e quindi non identiche. Si chiamano chirali .
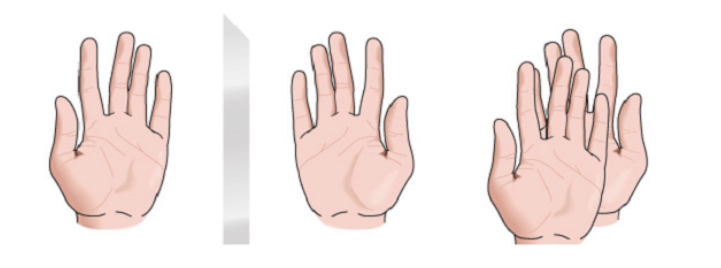
Ci sono altre molecole simili a un paio di calzini. Le calze sono immagini speculari l'una dell'altra e sono anche sovrapponibili.
Una molecola o un oggetto sovrapponibile alla sua immagine speculare si dice achirale .
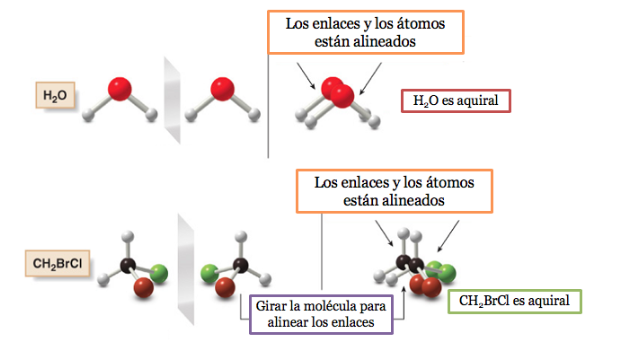
Se una molecola ha un piano di simmetria è un sistema achirale.
Una molecola chirale esiste in due forme stereoisomeriche chiamate enantiomeri . Questi sono oggetti non sovrapponibili con le loro immagini speculari.
Un atomo di carbonio attaccato a 4 diversi sostituenti è detto carbonio asimmetrico . Tuttavia, la sua esistenza non è una garanzia di chiralità (come si vedrà in seguito). Chiamato anche carbonio stereogenico o stereocentro.
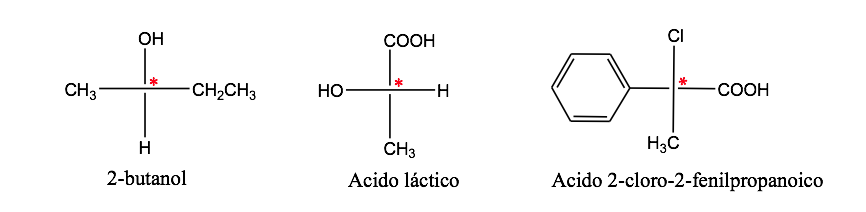
isomerismo ottico
Le proprietà fisiche di due enantiomeri sono identiche: hanno gli stessi punti di ebollizione e fusione, la stessa solubilità, la stessa densità, lo stesso indice di rifrazione, la stessa conducibilità... ecc.
L'attività ottica delle coppie di enantiomeri è la proprietà caratteristica per differenziarli.
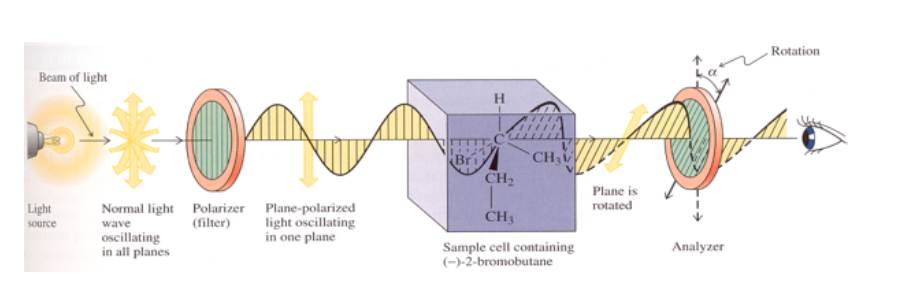
Se la sostanza non è otticamente attiva, non si osserva alcun cambiamento nel piano di vibrazione della luce polarizzata emessa.
Se la sostanza ha attività ottica, si osserva una rotazione di due gradi del piano di vibrazione della luce polarizzata emessa.
Se la rotazione del piano di luce è verso destra (nella stessa direzione oraria), la sostanza è destrogira e al valore α viene assegnato un segno positivo.
Se la rotazione è verso sinistra (antioraria) la sostanza è mancina e ad α viene assegnato un segno negativo.
La rotazione specifica di una molecola otticamente attiva è una costante fisica caratteristica di quella molecola.

Rotazione specifica di alcuni composti chirali
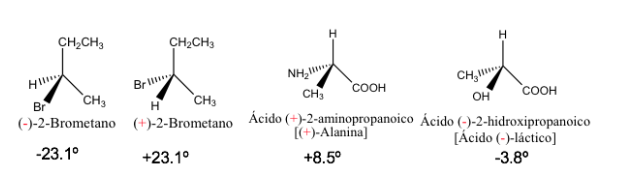
Gli enantiomeri puri hanno lo stesso valore di rotazione specifica ma di segno opposto.
Pertanto, la rotazione ottica risultante di una miscela 1:1 di enantiomeri è zero, cioè è otticamente inattiva. Questo tipo di miscela è chiamata miscela racemica o racemica .
La denominazione della configurazione assoluta di un centro stereogenico si basa sulle stesse regole di priorità sviluppate da Cahn, Ingold e Prelog .
Queste regole consentono di nominare e descrivere la disposizione nello spazio dei sostituenti su un centro stereogenico, indipendentemente dal segno della rotazione ottica della molecola.
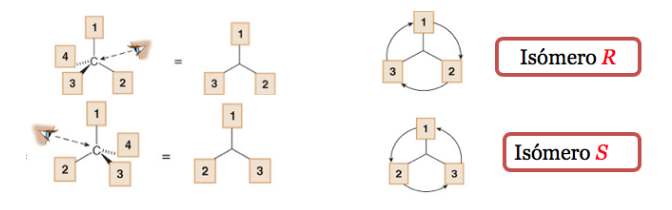
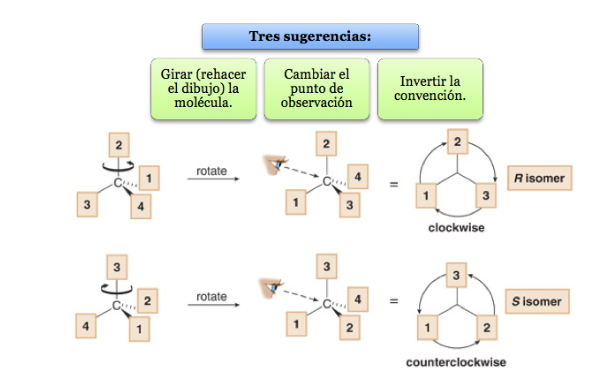
Il sostituente con priorità più bassa si trova il più lontano possibile dall'osservatore.
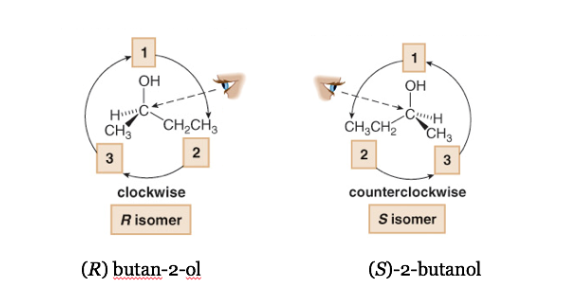
Se il passaggio da 1 a 2 a 3 viene eseguito in senso orario, il centro chirale è R (retto, latino, destra).
Se il passaggio da 1 a 2 a 3 viene eseguito in senso antiorario, la configurazione del centro chirale viene chiamata S (sinistro, latino, sinistro).
Nella nomenclatura sistematica, R o S sono aggiunti tra parentesi come prefisso al nome del composto chirale.
È importante ricordare che i simboli R e S non mostrano alcun tipo di correlazione con il segno di α .
Cosa fare quando una molecola non è orientata in modo che il gruppo di priorità più bassa sia lontano?
Un composto con n centri stereogenici ha un massimo di 2 n stereoisomeri.
Esempio:
Un composto con due centri stereogenici ha un massimo di 4 stereoisomeri.
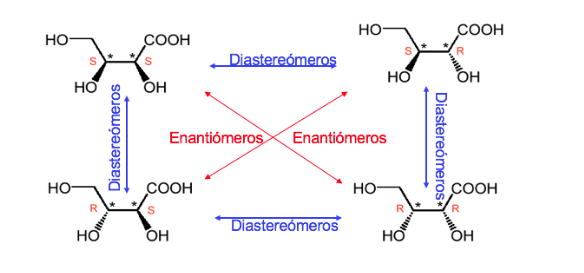
Qualsiasi stereoisomero la cui molecola non è chirale nonostante abbia centri stereogenici è chiamato forma meso o composto.
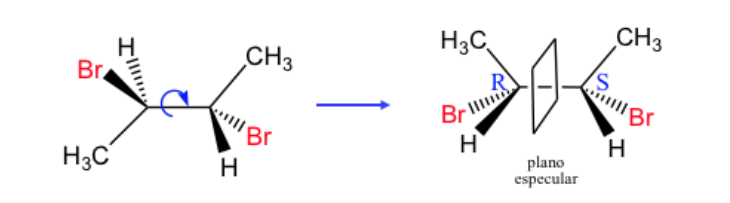
Una mescola con due carboni asimmetrici è dominata come quando i due carboni hanno la stessa configurazione assoluta e diversamente nel caso opposto.
eritro e tre composti
Quando due atomi di carbonio hanno almeno due sostituenti identici, si può usare la designazione treo ed eritro .
Una coppia di enantiomeri eritro è quella in cui gruppi identici possono essere collocati nella posizione eclissata.
Non esiste una relazione diretta tra la nomenclatura R e S e la nomenclatura Erythro/Treo.
Quando due atomi di carbonio hanno tre sostituenti identici, la forma eritro è meso poiché presenta un piano di simmetria.
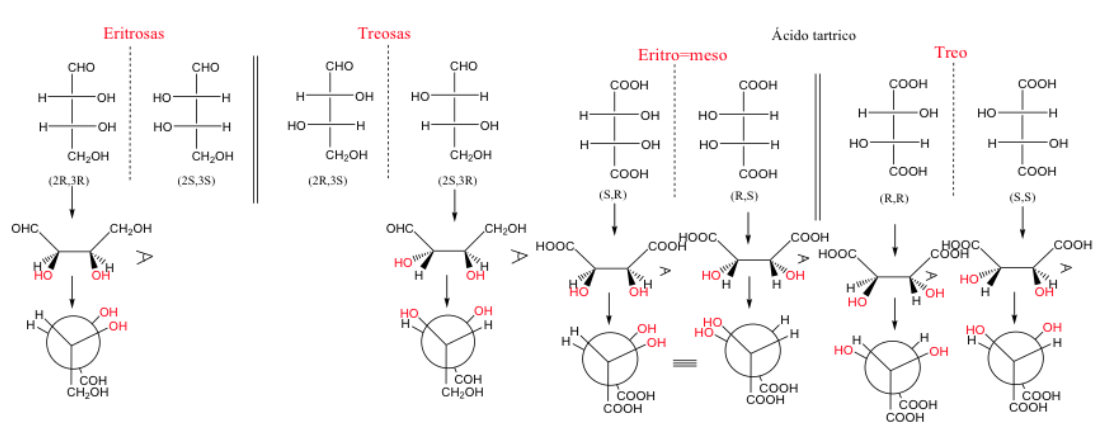
Una molecola è chiamata eritro quando, nella sua rappresentazione di Fischer, gruppi uguali o simili si trovano dalla stessa parte.
Una molecola è tre se questi gruppi sono su lati opposti.
(generalmente utilizzato per gli zuccheri (osas))
È una nomenclatura che precede la nomenclatura R e S.
Uno zucchero è chiamato D quando, nella proiezione di Fischer (con il carbonio più ossidato situato in alto), l'ossidrile associato al carbonio asimmetrico con il numero più alto è sulla destra.
Il suo enantiomero si chiamerà L e avrà a sinistra l'equivalente OH.
Glucosio e fruttosio nelle loro forme naturali esistono come D.
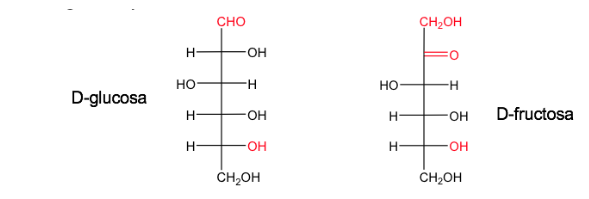
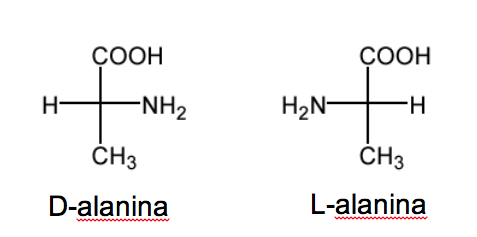
La nomenclatura D/L è utilizzata anche nella serie degli amminoacidi.
RCH( NH2 )COOH.
Negli zuccheri questa nomenclatura dipende dalla posizione dell'ossidrile. In questo caso è la posizione del gruppo amminico che definisce la nomenclatura. Quando nella proiezione di Fisher (con il carbonio più ossidato in alto) il gruppo NH 2 è sulla destra, l'etereoisomero è D e il suo enantiomero è L .
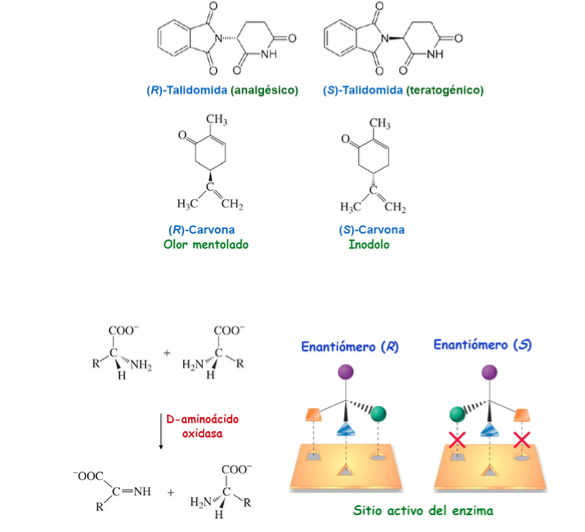
Importanza della chiralità
Fonti per espandere la ricerca della conoscenza:
1) Juaristi E. “Introduzione alla stereochimica e all'analisi conformazionale”. CINVESTAV, Messico, 1988 Juaristi E. . CINVESTAV, Messico, 1994.
2) Neil SI “Chimica Fisica Organica” Longman, Milano, 1995.
3) March J., “Advanced Organic Chemistry” John Wiley & Sons, New York, 1992 4) Jones RAY “Physical and Mechanistic Organic Chemistry”, 2nd. Ed Cambridge University Press, Cambridge, 1984.
5) Woodward RB e Hoffmann R. “La conservazione della simmetria orbitale”, Academic Press, New York, 1979.
6) Carpenter BK “Determinazione dei meccanismi di reazione organica”, John Wiley & Sons, New York, 1984 .