Estereoquímica e análise conformacional
A estereoquímica é o ramo da química que lida com os aspectos tridimensionais das moléculas e sua reatividade. A Química Orgânica não pode ser compreendida sem considerar a Estereoquímica. Os sistemas biológicos são altamente seletivos e frequentemente discriminam moléculas com diferenças estereoquímicas muito pequenas.
A análise conformacional faz parte do estudo espacial das moléculas, ou seja, da Estereoquímica.
CONSTITUIÇÃO, CONFIGURAÇÃO E CONFORMAÇÃO
Compostos com a mesma fórmula são chamados de isômeros.
estrutura empírica, mas diferente.
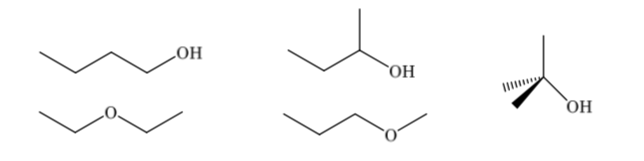
Os isômeros constitucionais diferem em sua sequência de ligação, apresentam diferentes conectividades. Um composto com a fórmula molecular C4H10O pode ter diferentes constituições:
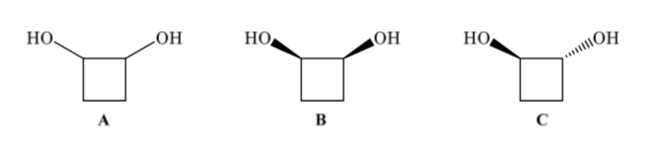
Os isômeros configuracionais têm a mesma conectividade, mas diferem no arranjo espacial dos átomos. 1,2-ciclobutanodiol (A) pode ter dois isômeros de configuração, dependendo se os dois grupos OH estão no mesmo lado (B) ou em lados opostos (C)
Os isômeros conformacionais têm a mesma constituição, a mesma configuração, mas diferem espacialmente porque passam de um isômero para outro pela simples rotação de uma ligação. As várias formas que as moléculas adquirem como resultado da rotação em torno de uma única ligação são chamadas de conformações, cada uma das quais é um confôrmero.
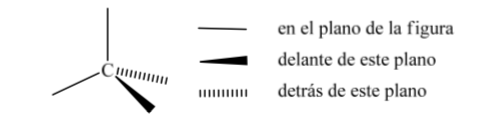
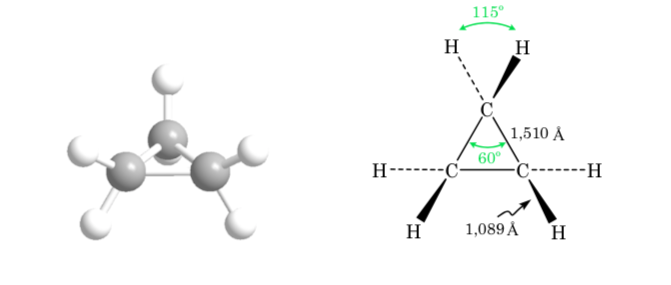
Uma das representações mais utilizadas do tetraedro de carbono é a chamada representação em perspectiva.
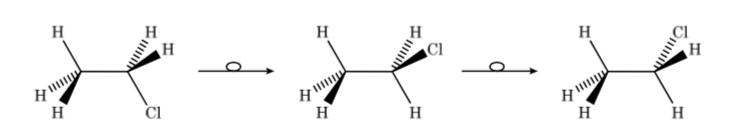
Assim, no caso do cloroetano podemos representar os diferentes confôrmeros em perspectiva da seguinte forma:
Isômeros configuracionais e conformacionais são estereoisômeros. Os estereoisômeros têm a mesma conectividade, mas diferem na orientação de alguns de seus átomos no espaço. Muitas vezes apresentam diferenças consideráveis em suas propriedades físicas, químicas e biológicas.
CONFORMAÇÃO EM MOLÉCULAS ORGÂNICAS ACÍCLICAS
Representação de moléculas orgânicas
Existem várias maneiras de representar moléculas no plano.
Representação em Perspectiva ou Cavalete
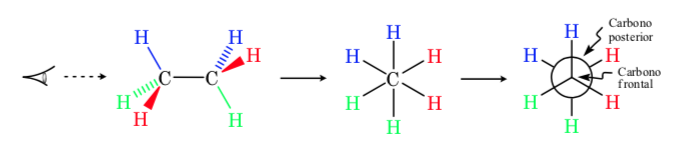
Projeção de Newman
Em uma projeção de Newman, dois átomos de carbono adjacentes em uma molécula são representados dentro de um círculo. Na frente está o átomo de carbono visto de frente e atrás do círculo está o átomo de carbono sobreposto. Os três substituintes de cada carbono saem do centro do círculo na frente e atrás.
Representação de Fisher
Na representação de Fischer, um átomo de carbono tetraédrico é representado pelo centro de uma cruz e os substituintes são colocados nas extremidades de tal forma que as linhas verticais indicam que as ligações são direcionadas para trás do plano do papel e o horizontais para a frente. . A corrente principal é disposta verticalmente.
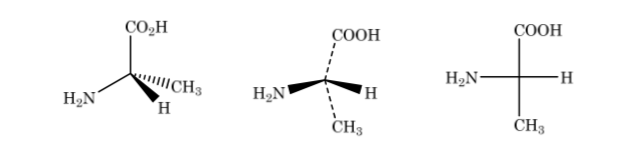
Como mostrado acima, a representação do ácido 2-aminopropanoico
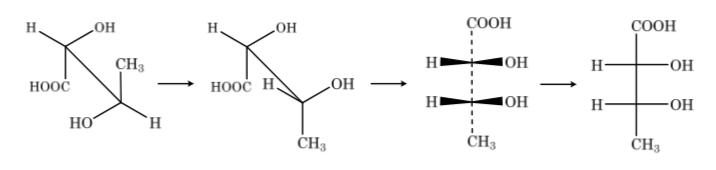
Se o composto tiver átomos de carbono diferentes, a cadeia carbônica é traçada verticalmente com os substituintes de cada carbono horizontalmente, sempre mantendo a regra de que as ligações verticais vão atrás do plano e as horizontais à frente.
conformações de etano
A ligação σ que une os átomos de carbono no etano é cilindricamente simétrica e permite rotação livre em torno dela. A rotação em torno da ligação C-C interconverte as diferentes conformações do etano. O estudo de seu comportamento termodinâmico e cinético é chamado de Análise Conformacional.
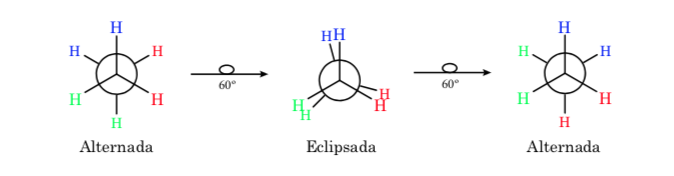
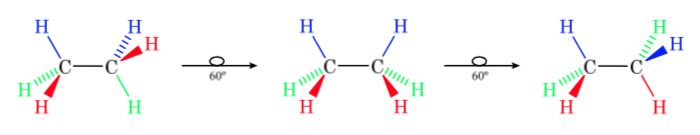
A primeira figura representa a molécula de etano onde os átomos de hidrogênio estão o mais distantes possível com o mínimo de interação entre eles. É chamada de conformação alternada.
A segunda vem de ter feito uma volta de 60o na ligação C-C e onde os átomos de hidrogênio são eclipsados.
Novamente, uma volta de 60o na ligação C-C leva a uma conformação alternativa.
A energia potencial da molécula é mínima para a conformação escalonada, aumenta com a rotação e atinge um máximo para a conformação eclipsada. A diferença energética ou barreira energética a ultrapassar para passar de uma conformação a outra é da ordem de 3 kcal (ver desenho).
A maioria das moléculas de etano existe naturalmente na conformação mais estável. Como a barreira de energia não é muito alta à temperatura ambiente, o número de colisões com energia suficiente é grande o suficiente para que a interconversão de conformer seja rápida. A energia necessária para girar a molécula em torno da ligação C-C é devida à tensão de torção.
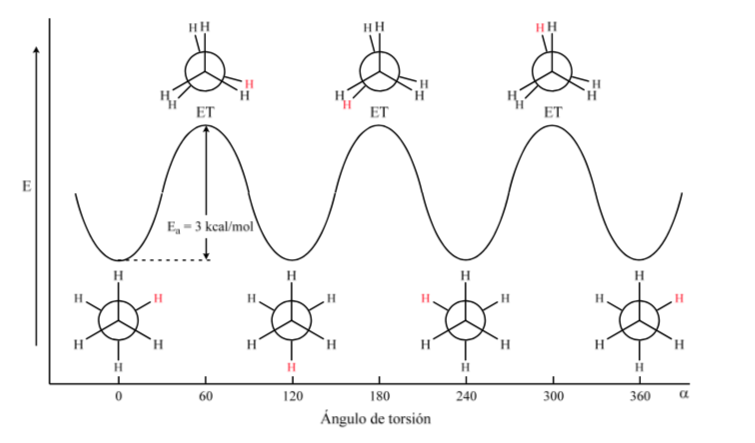
O diagrama acima representa as mudanças de energia ao passar de uma conformação para outra durante a rotação da ligação simples C-C.
Quando os hidrogênios do etano forem substituídos por outros átomos ou grupos, os níveis de energia das conformações mudarão e seu estudo deverá ser feito para cada caso.
conformações de propano
No caso da molécula do propano, se representarmos as projeções de Newman de acordo com uma das ligações C – C e rotacionarmos a ligação, nos encontraremos, como no caso do etano, com conformações eclipsadas e alternadas.
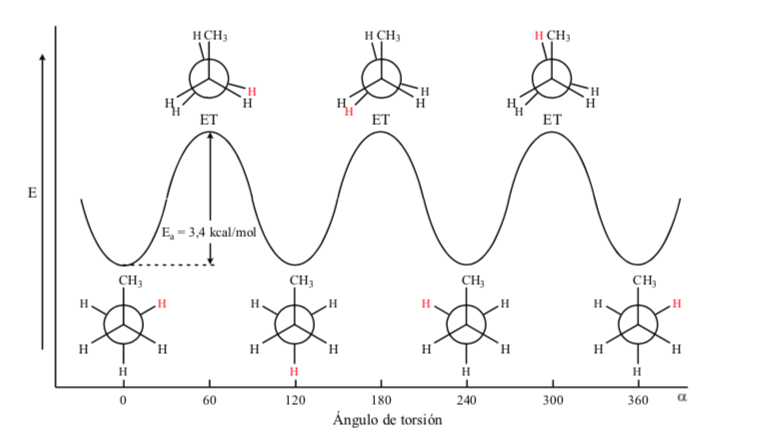
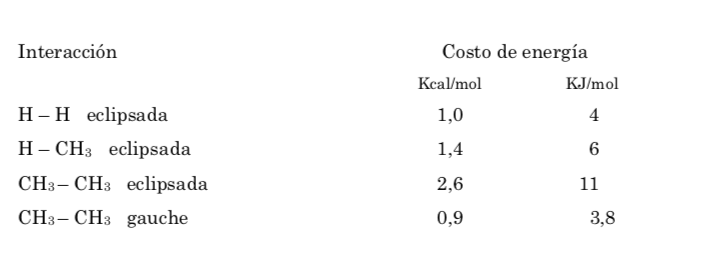
A barreira energética entre uma forma alternada e uma eclipsada é maior do que no caso do etano (3,4 kcal mol-1), pois o grupo metil é maior que o hidrogênio e as interações são maiores. As conformações escalonadas são mais estáveis do que as conformações eclipsadas.
Conformações do n-butano
Se olharmos para a ligação C-C central, podemos considerar o butano ao representá-lo em Newman como uma molécula semelhante ao etano, na qual dois átomos de hidrogênio foram substituídos por dois grupos metila.
Assim como no etano, as conformações alternadas têm menor energia e são mais estáveis que as eclipsadas: 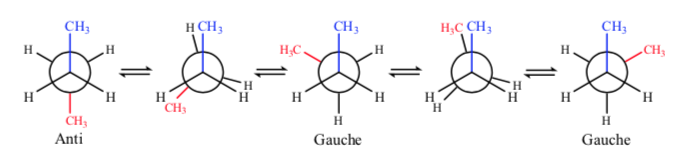
De todas as conformações alternativas, aquela com os dois grupos metil na posição mais oposta possível (ângulo diedro 180o) é chamada de anticonformação e é a mais estável. As outras duas conformações alternativas são de energia semelhante entre si e são chamadas de conformações gauche, onde os grupos metil se encontram em um ângulo diedro de 60º entre si. Duas dessas conformações existem dependendo da rotação em torno da ligação C-C.
Das três conformações eclipsadas, destacamos primeiro aquela em que os dois grupos metil estão eclipsados, o que gera maior interação e, portanto, menor estabilidade. As outras duas conformações eclipsadas têm menor conteúdo de energia e são um pouco mais estáveis. Veja o diagrama de energia.
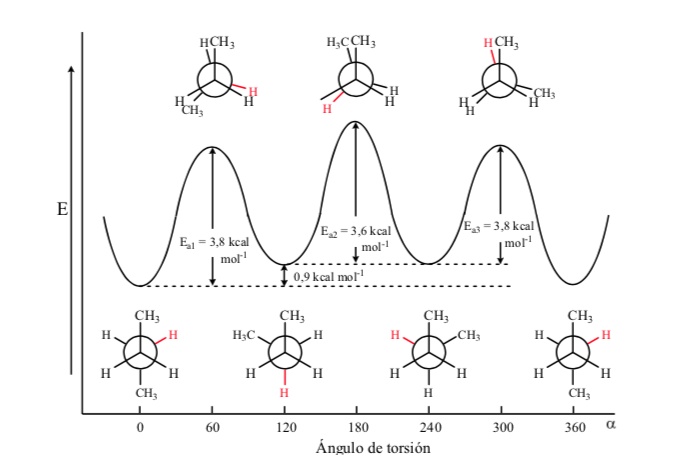
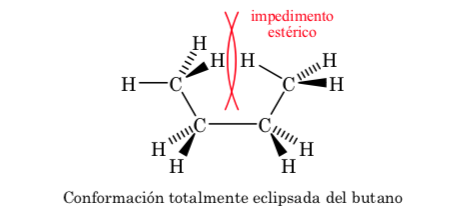
As colisões fornecem a energia necessária para superar a barreira da energia de ativação.
CONFORMAÇÃO EM MOLÉCULAS ORGÂNICAS CÍCLICAS
Os cicloalcanos estão sujeitos a uma tensão de anel chamada tensão de Bayer devido à sua estrutura cíclica. Essa tensão é resultado de três fatores:
- Tensão da ligação
- Eclipse de átomos e ligações - Deformação Estérica
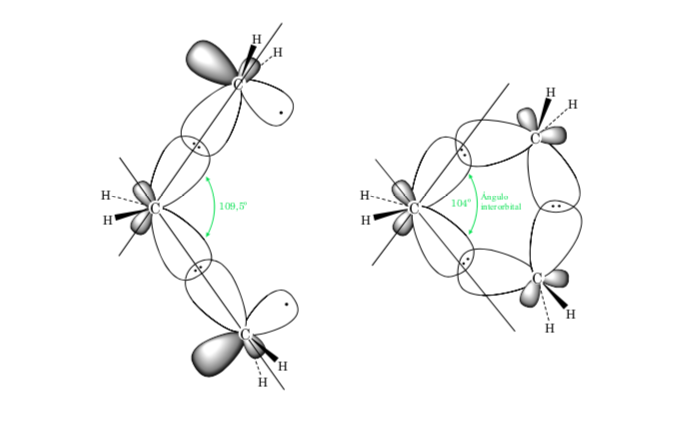
A. A tensão de ligação em cicloalcanos é devida à diferença na sobreposição orbital em relação a um alcano acíclico. Quanto mais próximo o valor do ângulo C–C–C estiver do tetraédrico (109,5o), maior será a sobreposição e menor será a tensão de ligação.
O efeito estérico é devido à interação dos átomos através do espaço. Para evitar que a interação entre os átomos seja alta, a molécula adquire uma conformação preferencial, esta é a mais estável. Para reduzir as tensões e, assim, obter estabilidade, a conformação preferida será aquela em que os grupos volumosos estejam o mais distantes possível.
CONFORMAÇÃO EM CICLOS DE TRÊS, QUATRO E CINCO ÁTOMOS DE CARBONO
ciclopropano
O desvio do ângulo de ligação do anel de três membros do ângulo correspondente à hibridação sp3 é grande, portanto o ciclopropano tem uma tensão angular muito alta.
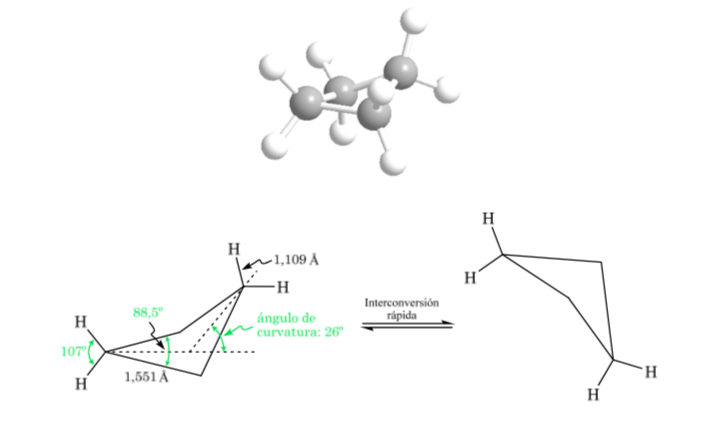
Ciclobutano: conformação borboleta
A molécula tem uma estrutura ligeiramente distorcida. As ligações C-C são menos curvas e sua reatividade é menor do que no caso do ciclopropano. A interconversão entre as diferentes conformações é rápida.
Ciclopentano: Conformação em
O ciclopentano, se fosse planar, teria uma alta tensão de eclipse, devido a dez interações H-H eclipsadas, resultando em um dobramento no anel. A dobra libera o estresse de torção. O ciclopentano não exibe a reatividade dos anéis de três e quatro membros.
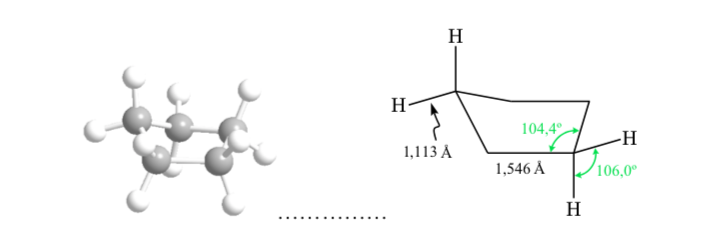
ANÁLISE CONFORMACIONAL DE CICLOEXANOS: Conformação em cadeira
Se o ciclohexano tivesse uma estrutura planar, ele teria um ângulo de ligação de 120o. Um carbono hibridizado sp3 livre de tensão tem um ângulo tetraédrico de 109,5o, o que faz com que o ciclohexano assuma uma conformação não planar e mais estável: conformação Chair.
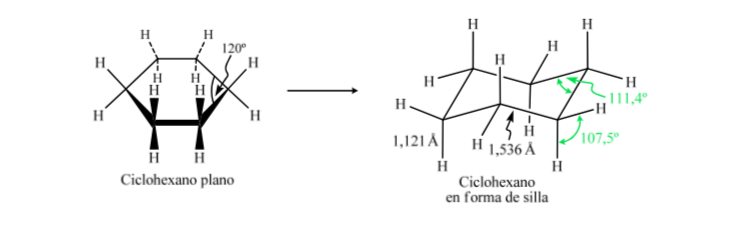
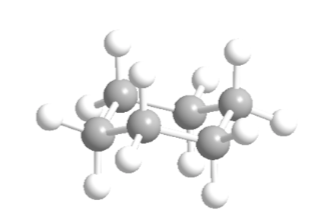
Ciclohexano em conformação de cadeira tem 6 átomos de hidrogênio axiais e 6 hidrogênios equatoriais. Os hidrogênios axiais são direcionados para cima e para baixo no anel, enquanto os hidrogênios equatoriais são direcionados para fora do anel.
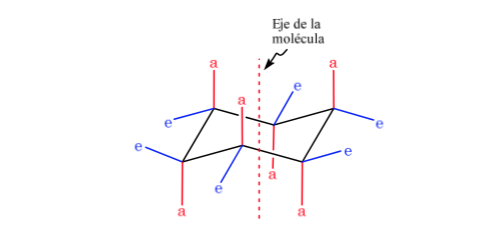
O ciclohexano na conformação de cadeira é suscetível de modificar sua conformação por outra cadeira de igual estabilidade. Esse fenômeno é chamado de interconversão de duas formas de cadeira.
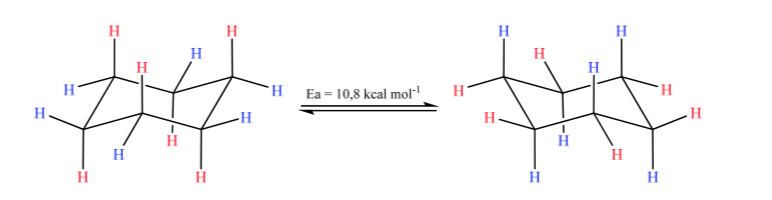
Observando atentamente a interconversão, observa-se que a ligação axial C-H torna-se equatorial e vice-versa, a equatorial torna-se axial.
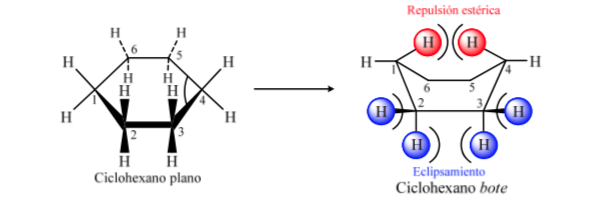
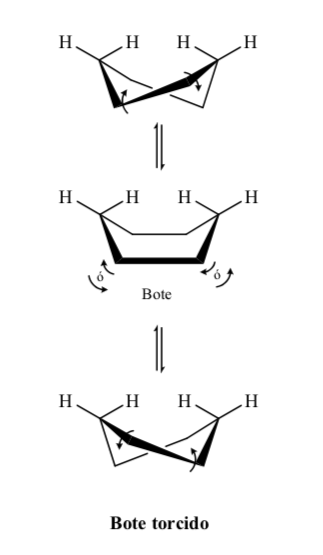
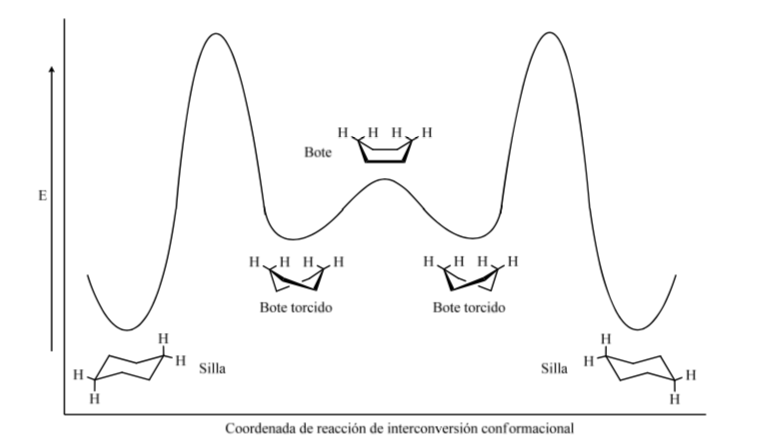
Níveis energéticos dos confôrmeros do ciclohexano:
Se observarmos uma conformação de cadeira do ciclohexano, de modo que o átomo C-2 se sobreponha ao átomo C-3 e o átomo C-6 se sobreponha ao C-5, podemos desenhar uma projeção de Newman do ciclohexano:
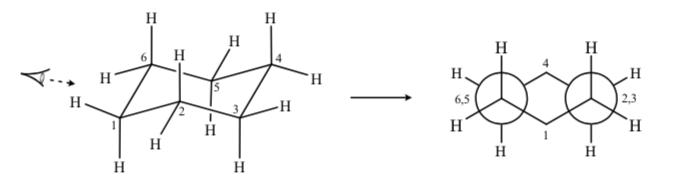
CICLOEXANOS SUBSTITUÍDOS
Se considerarmos o metilciclohexano, podemos propor duas estruturas que o representam, dependendo se o grupo metil está em posição axial ou equatorial.
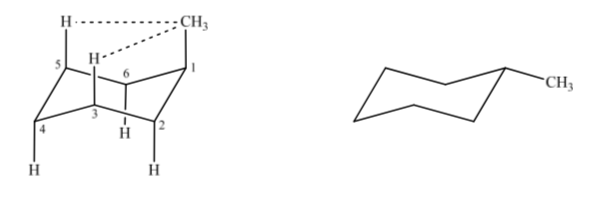
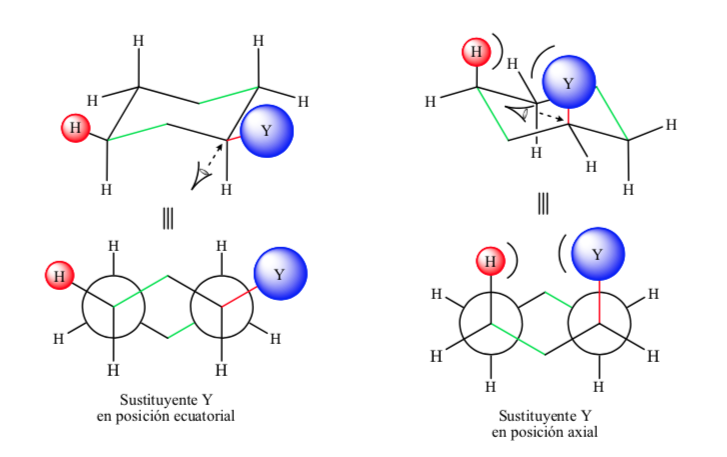
Se o substituinte não hidrogênio estiver em uma posição axial, as interações com os hidrogênios nas posições 3 e 5 do anel ocorrem devido à proximidade espacial. Se estiver na posição equatorial, o substituinte é direcionado para fora do anel e as interações são menores. Como esperado, a conformação com o substituinte equatorial é cerca de 1,8 kcal mais estável do que se o substituinte estiver na posição axial. Assim, diz-se que um substituinte em posição axial apresenta uma interação 1,3-diaxial que o torna menos estável do que em posição equatorial.
A figura a seguir representa as duas conformações de Newman de um ciclohexano substituído com ambos os substituintes nas posições equatorial e axial.
Ciclohexanos dissubstituídos
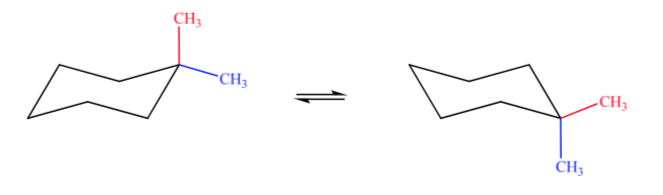
A. 1,1-dimetilciclohexano B. 1,2-dimetilciclohexano C. 1,3-dimetilciclohexano D. 1,4-dimetilciclohexano
No caso A, um grupo metil estará na posição axial e o outro na posição equatorial, então as duas possíveis conformações serão igualmente estáveis.
Em cada um dos casos restantes, podemos representar duas estruturas diferentes, dependendo se os dois metils estão em cis (direcionados para o mesmo lado do plano) ou em trans (direcionados para lados opostos).
Em B, o isômero cis deve ter ambos os metils do mesmo lado do plano central, então um metil será axial e o outro equatorial.
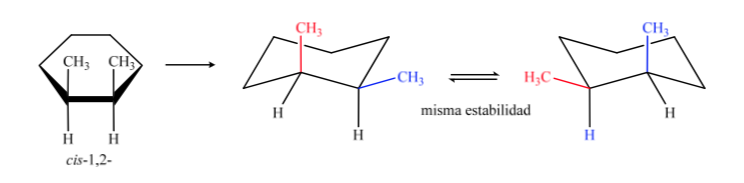
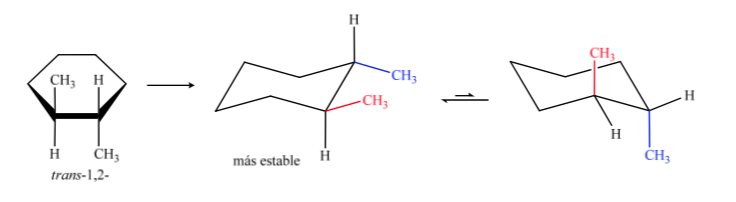
O isômero trans é aquele com os dois metils voltados para lados opostos, portanto apresentará ambos os metils em posição axial ou ambos em posição equatorial. A conformação que ambos apresentam em equatorial é mais estável que em axial, portanto podemos dizer que o isômero trans-1,2-dimetilciclohexano é mais estável que o isômero cis-1,2-dimetilciclohexano.
No caso do 1,3-dimetilciclohexano podemos representar:
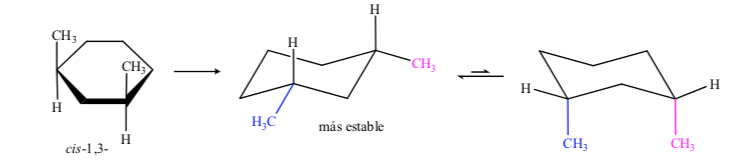
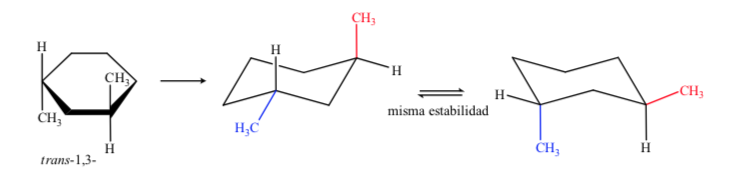
Conclui-se que o isômero cis, que apresenta os dois substituintes em equatorial, é mais estável que o trans, que sempre terá um metil no axial e outro no equatorial.
No caso D, 1,4-dimetilciclohexano teremos:
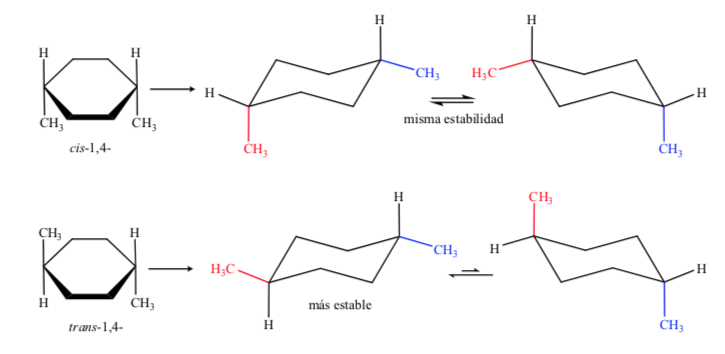
Nesse caso, o isômero trans é mais estável porque os dois metils estão arranjados no equador.
Ao se tratar de ciclohexanos dissubstituídos com grupos diferentes, o isômero mais estável será aquele com o maior grupo equatorial.
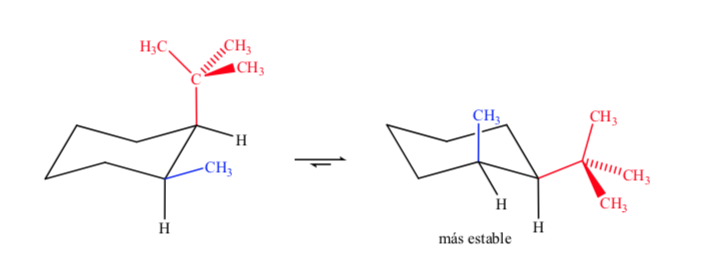
Finalmente, no caso de ciclohexanos polissubstituídos que possuam diferentes substituintes, a conformação preferida será aquela com maior número de grupos volumosos na posição equatorial.
CONFORMAÇÃO EM HETEROCICLOS DE SEIS MEMBROS:
EFEITO ANOMÉRICO
Em química orgânica, o efeito anomérico ou efeito Edward-Lemieux é um efeito estereoeletrônico que descreve a tendência de substituintes heteroatômicos adjacentes a um heteroátomo em um anel ciclohexano de preferir a orientação axial em vez da orientação equatorial menos coberta, o que seria esperado. considerações estéricas. Este efeito foi originalmente observado em anéis de piranose por JT Edward em 1955; naquela época, N.-J. Chii e Raymond U. Lemieux começaram a estudar o equilíbrio de anomerização de derivados totalmente acetilados de algumas aldohexopiranoses. O termo "efeito anomérico" foi introduzido em 1958.
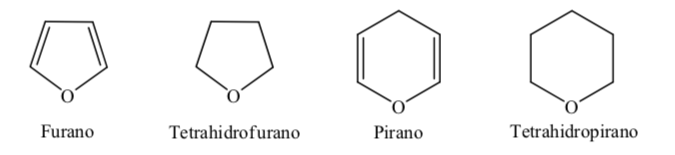
Alguns dos heterociclos de cinco e seis membros mais comuns em processos biológicos são:
A. Heterociclos oxigenados:
B. Heterociclos nitrogenados:
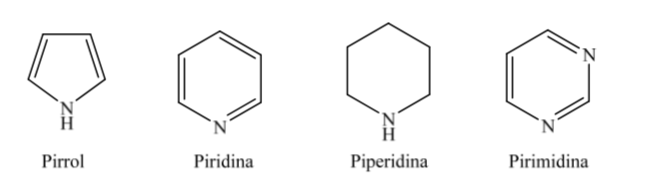
Quando se trata de heterociclos totalmente hidrogenados com cinco e seis membros, como o tetrahidrofurano e o tetrahidropirano, a conformação mais estável que eles apresentam é semelhante à do ciclopentano e ciclohexano respectivamente, ou seja, conformação em ou conformação em cadeira.
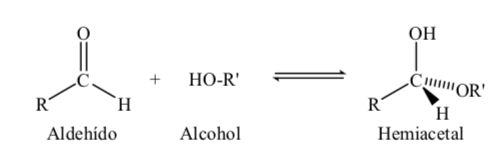
Açúcares com 5 e 6 átomos de carbono adquirem uma estrutura cíclica quando uma ligação hemiacetal é formada pela reação da carbonila (açúcar aldeído ou cetona) com um grupo hidroxila.
A reação de formação do hemiacetal pode ser esquematizada da seguinte forma:
Para seu estudo, os açúcares são representados por estruturas lineares seguindo as regras das projeções de Fischer.
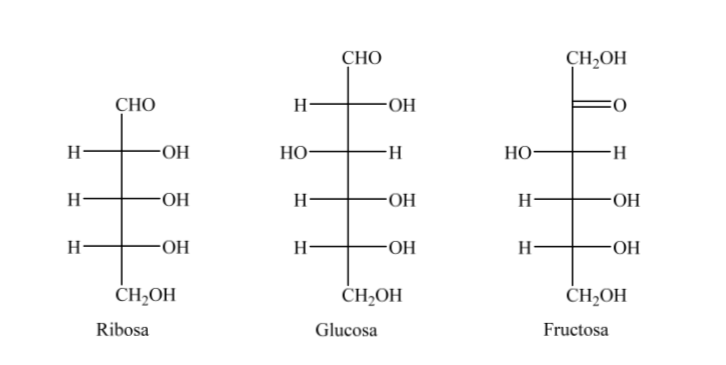
Assim, como exemplo, podemos representar ribose, glicose e frutose:
Quando o hemiacetal é formado, a molécula adquire um arranjo curvo em que a função aldeído da aldose do carbono 1 está localizada próxima à hidroxila do carbono 5, somando-se à dupla ligação da carbonila, gerando o hemiacetal cíclico de seis membros (anel piranósido ).
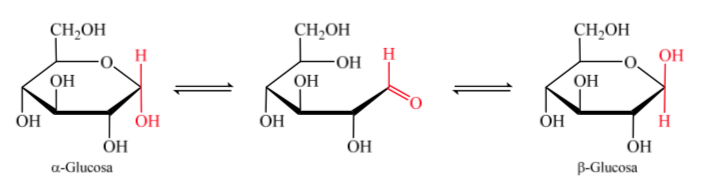
O mesmo ocorre com as cetoses, mas neste caso a ligação hemiacetal ocorre entre o carbono 2 e o carbono 5, formando um anel de cinco membros. (anel furanósido).
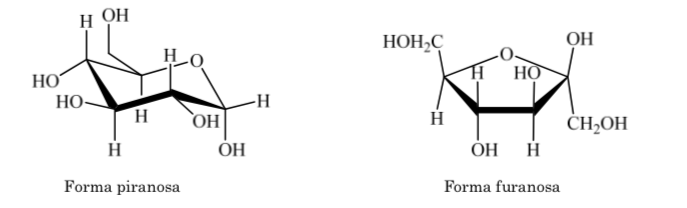
Diferentes formas de representar a estrutura da glicose na forma cíclica são usadas:
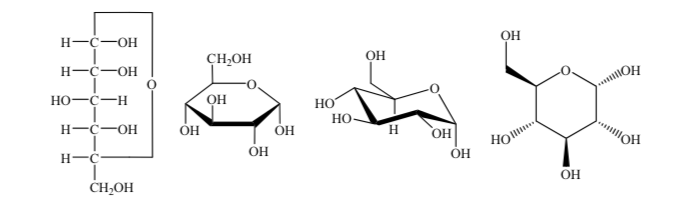
anômeros
Os isômeros de monossacarídeos com mais de 5 átomos de carbono que desenvolveram uma ligação hemiacetal são chamados de anômeros, o que lhes permitiu assumir uma estrutura cíclica e determinar 2 posições diferentes para o grupo hidroxila (α ou β) no novo centro criado. .
O anel de piranose deve ser semelhante ao do ciclohexano e existir na conformação de cadeira de preferência à conformação de barco torcido para minimizar as tensões de torção. A análise de raios X mostra que essas suposições estão corretas.
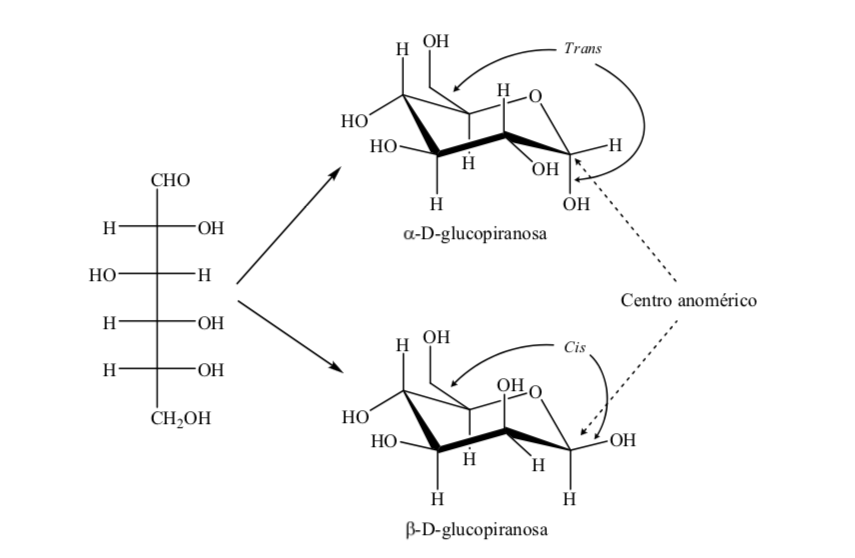
Os dois anômeros são designados anômeros alfa (α) ou beta (β), de acordo com a relação configuracional entre o centro anomérico e o átomo de referência anomérico. O centro anomérico está no carbono hemiacetal e é o carbono anomérico C-1, que está ligado através do oxigênio ao C-5, que está ligado ao oxigênio hemicetal.
Existem, no entanto, duas possíveis conformações em cadeira para o mesmo anômero D-(+)-glicopiranose.
Assim, para β-D-(+)-glucopiranose existem duas conformações possíveis. A que apresentar os grupos mais volumosos na linha equatorial (A) será mais estável.
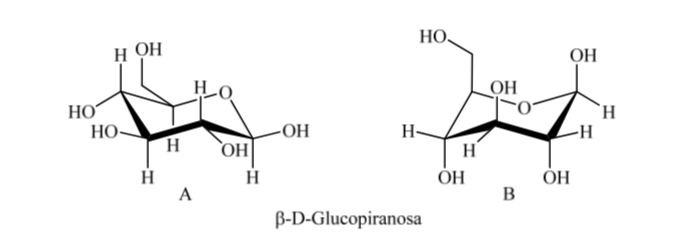
O que acontece com a α-D-(+)-glicose? Neste caso, a conformação mais estável é aquela em que o OH no carbono anomérico é axial e os grupos volumosos são equatoriais (A).
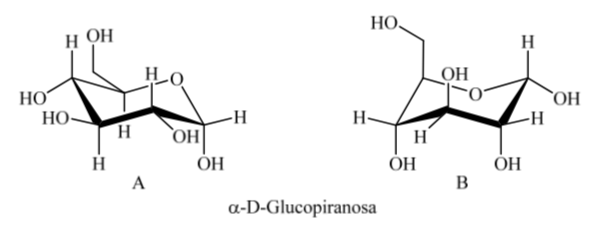
É interessante notar que de todas as D-aldohexoses, apenas a β-D-(+)-glicopiranose pode assumir uma conformação na qual cada um de seus grandes grupos pode ocupar uma posição equatorial. Isso é consistente com o fato de que a β-D-(+)-glucopiranose é o açúcar com maior ocorrência na natureza.
efeitos eletrônicos
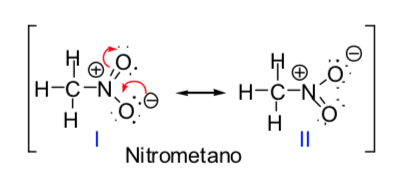
Algumas moléculas orgânicas podem ser representadas por duas ou mais estruturas de Lewis, que diferem entre si apenas no posicionamento dos elétrons e são chamadas de estruturas s-ressonantes. Nesses casos, a molécula terá características de ambas as estruturas e, na verdade, diz-se que a molécula é um híbrido de ressonância das estruturas ressonantes. O método da ressonância permite conhecer, de forma qualitativa, a estabilização que uma molécula pode atingir por deslocalização eletrônica. Quanto maior o número de estruturas ressonantes pelas quais uma espécie química pode ser descrita, maior sua estabilidade.
O conceito de estruturas ressonantes pode ser aplicado na descrição do nitrometano, que pode ser representado pelas duas estruturas de Lewis dadas abaixo:
Ligações conjugadas e sua energia
Análise conformacional de aromaticidade
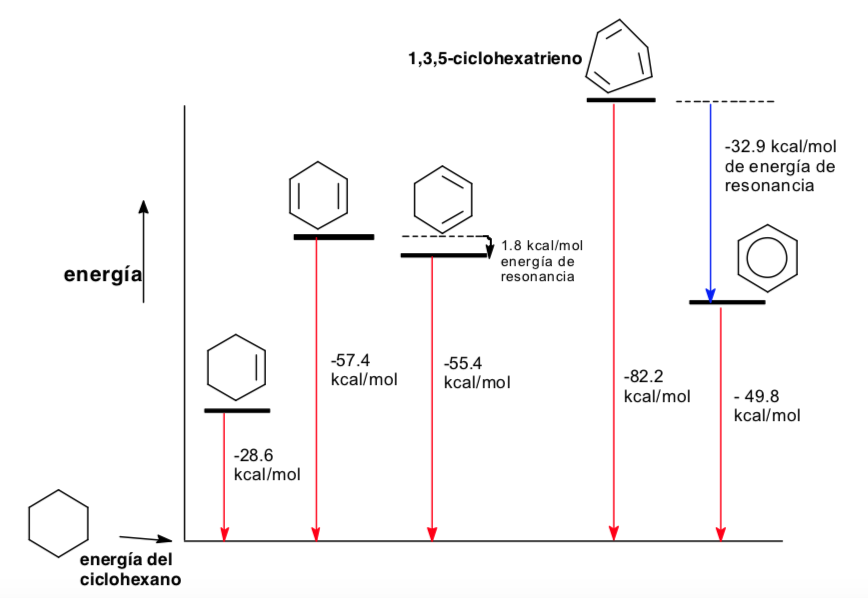 Termodinâmica e análise conformacional (efeitos estereoeletrônicos)
Termodinâmica e análise conformacional (efeitos estereoeletrônicos)
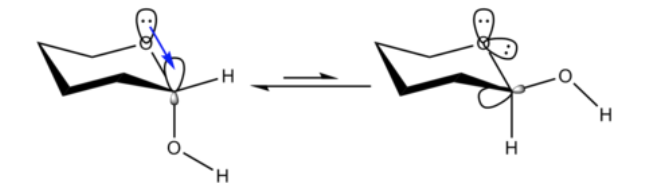
Não é inesperado que o substituinte metoxi em um anel ciclohexano prefira adotar a conformação equatorial.
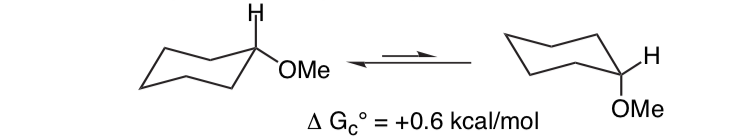
O que é inesperado é que o intimamente relacionado 2-metoxitetraidropirano ClHO prefere a conformação axial:
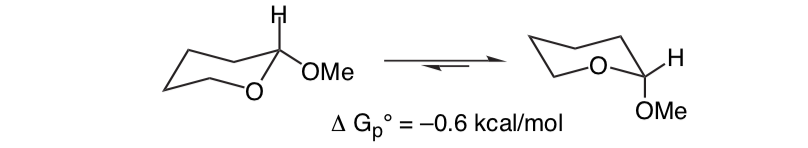
Este efeito que fornece estabilização do formador de O axial que anula o viés estérico inerente do substituinte é chamado de efeito anomérico.
A relação da energia livre com relação ao efeito anomérico seria a seguinte:
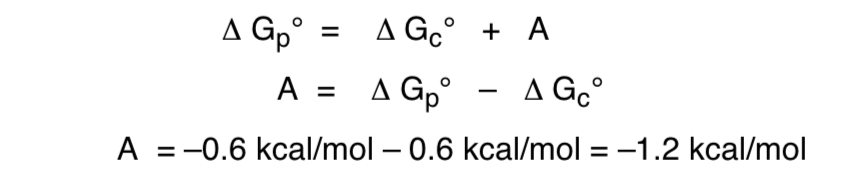
Fontes recomendadas para expandir a pesquisa:
1) Juaristi E. “Conceitos básicos da teoria orbital”. CINVESTAV, México, 1988 Juaristi E. "Organic Physicochemistry". CINVESTAV, México, 1994.
2) Neil SI “Physical Organic Chemistry” Longman, Milão, 1995.
3) March J., “Química Orgânica Avançada” John Wiley & Sons, Nova York, 1992 4) Jones RAY “Química Orgânica Física e Mecanística”, 2º. Ed Cambridge University Press, Cambridge, 1984.
5) Woodward RB e Hoffmann R. “A conservação da simetria orbital”, Academic Press, Nova York, 1979.
6) Carpenter BK “Determinação de Mecanismos de Reação Orgânica”, John Wiley & Sons, Nova York, 1984 .