Стереохимия и конформационный анализ
Стереохимия — это раздел химии, изучающий трехмерные аспекты молекул и их реакционную способность. Органическую химию нельзя понять без рассмотрения стереохимии. Биологические системы очень избирательны и часто различают молекулы с очень небольшими стереохимическими различиями.
Конформационный анализ является частью пространственного изучения молекул, то есть стереохимии.
КОНСТИТУЦИЯ, КОНФИГУРАЦИЯ И КОНФОРМАЦИЯ
Соединения с одинаковой формулой называются изомерами.
эмпирически, но с другой структурой.
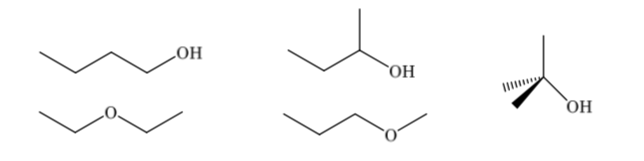
Конституционные изомеры различаются по своей последовательности связывания, они представляют различную связность. Соединение с молекулярной формулой C4H10O может иметь различное строение:
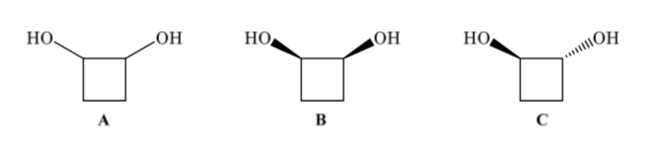
Конфигурационные изомеры имеют одинаковую связность, но различаются пространственным расположением атомов. 1,2-Циклобутандиол (А) может иметь два конфигурационных изомера в зависимости от того, находятся ли две ОН-группы на одной стороне (В) или на противоположных сторонах (С).
Конформационные изомеры имеют одинаковое строение, одинаковую конфигурацию, но они пространственно отличаются тем, что переходят от одного изомера к другому простым вращением связи. Различные формы, которые молекулы приобретают в результате вращения вокруг одинарной связи, называются конформациями, каждая из которых является конформером.
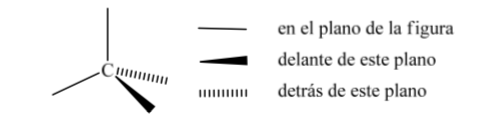
Одним из наиболее широко используемых представлений углеродного тетраэдра является так называемое перспективное представление.
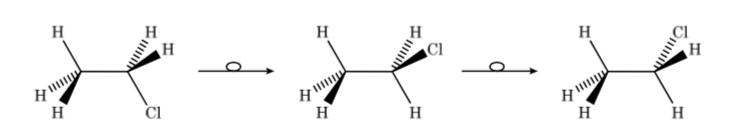
Таким образом, в случае хлорэтана мы можем представить различные конформеры в перспективе следующим образом:
Конфигурационные и конформационные изомеры являются стереоизомерами. Стереоизомеры имеют одинаковую связность, но различаются ориентацией некоторых атомов в пространстве. Они часто имеют значительные различия в своих физических, химических и биологических свойствах.
КОНФОРМАЦИЯ В АЦИКЛИЧЕСКИХ ОРГАНИЧЕСКИХ МОЛЕКУЛАХ
Представление органических молекул
Есть несколько способов представить молекулы на плоскости.
Представление в перспективе или мольберте
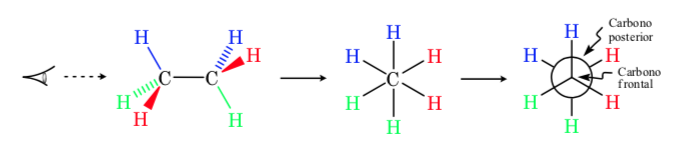
Проекция Ньюмана
В проекции Ньюмена два соседних атома углерода в молекуле изображены внутри круга. Впереди атом углерода, если смотреть спереди, а за кружком — перекрывающийся атом углерода. Три заместителя каждого атома углерода выходят из центра круга спереди и сзади.
Представительство Фишера
В представлении Фишера тетраэдрический атом углерода представлен центром креста, а заместители расположены на концах таким образом, что вертикальные линии указывают, что связи направлены к обратной стороне плоскости бумаги, а горизонтальные вперед. Основная цепь расположена вертикально.
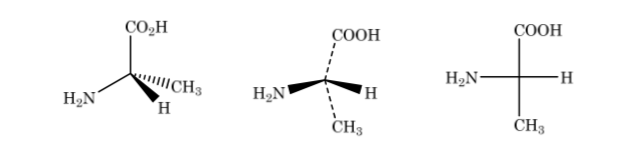
Как показано выше, представление 2-аминопропановой кислоты
Если соединение имеет разные атомы углерода, углеродную цепь рисуют вертикально, а заместители каждого атома углерода — горизонтально, всегда соблюдая правило, что вертикальные связи идут позади плоскости, а горизонтальные — вперед.
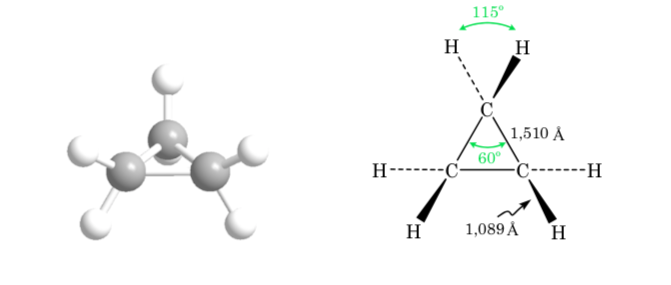
Конформации этана
Связь σ, соединяющая атомы углерода в этане, имеет цилиндрическую симметрию и допускает свободное вращение вокруг себя. Вращение вокруг связи C – C взаимопревращает различные конформации этана. Изучение его термодинамического и кинетического поведения называется конформационным анализом.
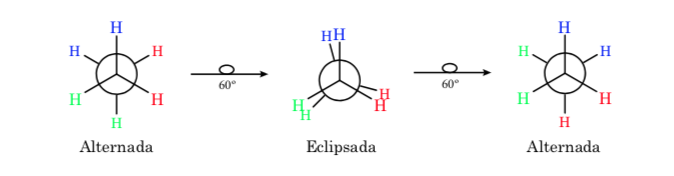
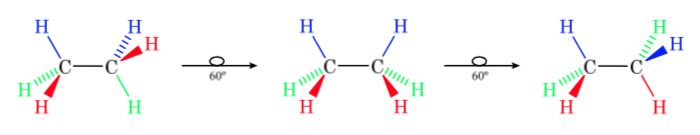
На первом рисунке представлена молекула этана, в которой атомы водорода максимально удалены друг от друга с минимальным взаимодействием между ними. Это называется альтернативной конформацией.
Второй возникает из-за поворота на 60° связи С—С, когда атомы водорода затмеваются.
Опять же, поворот на 60 градусов к связи С-С приводит к альтернативной конформации.
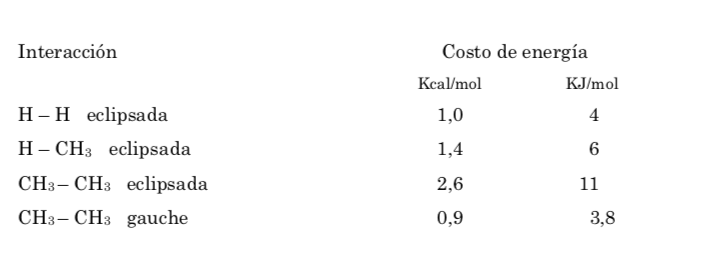
Потенциальная энергия молекулы минимальна для шахматной конформации, увеличивается с вращением и достигает максимума для заслоненной конформации. Разница в энергии или энергетический барьер, который необходимо преодолеть для перехода из одной конформации в другую, составляет порядка 3 ккал (см. рисунок).
Большинство молекул этана существуют в природе в наиболее стабильной конформации. Поскольку энергетический барьер не очень высок при комнатной температуре, количество столкновений с достаточной энергией достаточно велико, чтобы взаимное превращение конформеров происходило быстро. Энергия, необходимая для вращения молекулы вокруг связи С-С, обусловлена деформацией кручения.
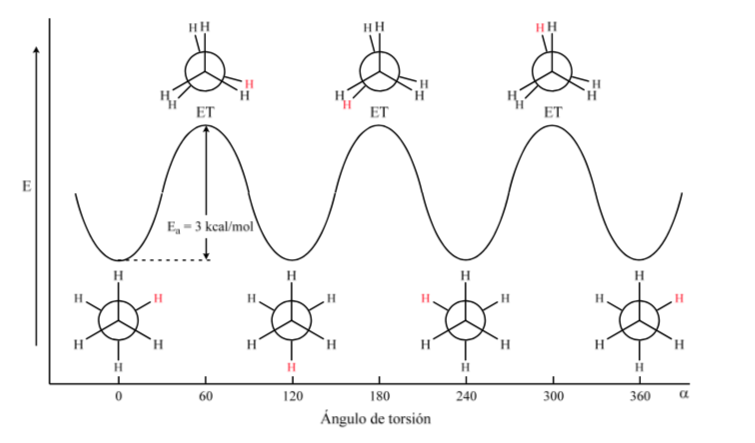
На приведенной выше диаграмме представлены изменения энергии при переходе от одной конформации к другой во время вращения одинарной связи C – C.
При замещении водородов этана другими атомами или группами энергетические уровни конформаций будут меняться и их изучение придется проводить для каждого случая.
конформации пропана
В случае молекулы пропана, если мы представим проекции Ньюмена по одной из связей С-С и повернем эту связь, то мы, как и в случае этана, окажемся с затмеваемой и альтернативной конформациями.
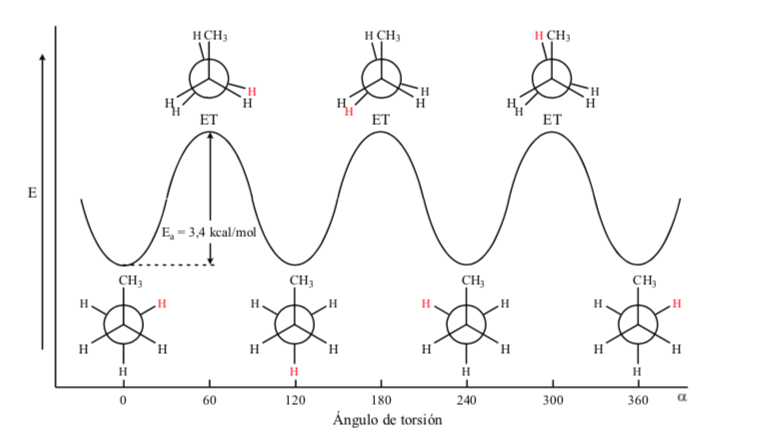
Энергетический барьер между альтернативной и затененной формой больше, чем в случае этана (3,4 ккал моль-1), поскольку метильная группа больше, чем водород, и взаимодействия больше. Смещенные конформации более стабильны, чем затмеваемые конформации.
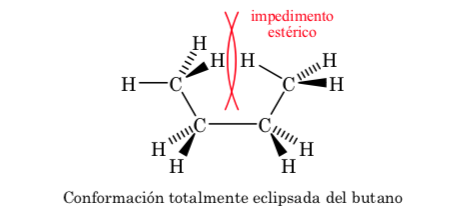
Конформации н-бутана
Если мы посмотрим на центральную связь С-С, мы можем рассматривать бутан, представляя его по Ньюмену как молекулу, подобную этану, в которой два атома водорода заменены двумя метильными группами.
Как и в этане, альтернативные конформации имеют меньшую энергию и более стабильны, чем заслоненные: 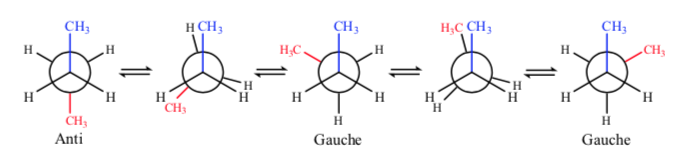
Из всех альтернативных конформаций та, в которой две метильные группы находятся в наиболее противоположном возможном положении (двугранный угол 180°), называется антиконформацией и является наиболее стабильной. Две другие альтернативные конформации имеют одинаковую энергию друг с другом и называются конформациями гош, в которых метильные группы встречаются под двугранным углом 60° друг к другу. Две такие конформации существуют в зависимости от вращения вокруг связи C-C.
Из трех затмеваемых конформаций мы сначала выделяем ту, в которой затеняются две метильные группы, что обеспечивает большее взаимодействие и, следовательно, меньшую стабильность. Две другие затмеваемые конформации имеют меньшую энергоемкость и несколько более стабильны. См. энергетическую диаграмму.
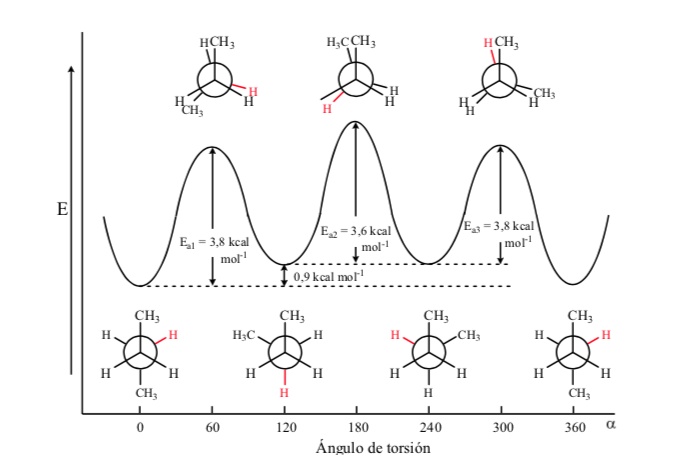
Столкновения обеспечивают энергию, необходимую для преодоления энергетического барьера активации.
КОНФОРМАЦИЯ В ЦИКЛИЧЕСКИХ ОРГАНИЧЕСКИХ МОЛЕКУЛАХ
Циклоалканы подвергаются деформации кольца, называемой деформацией Байера, из-за их циклической структуры. Это напряжение является результатом трех факторов:
- Напряжение связи
- Затмение атомов и связей - Стерическая деформация
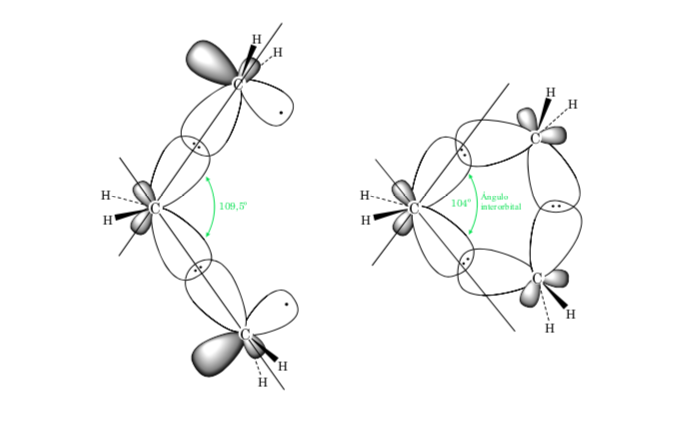
A. Напряжение связи в циклоалканах связано с различием в перекрытии орбиталей по отношению к ациклическому алкану. Чем ближе значение угла C–C–C к тетраэдру (109,5°), тем больше перекрытие и меньше натяжение связи.
Стерический эффект обусловлен взаимодействием атомов в пространстве. Чтобы взаимодействие между атомами не было высоким, молекула приобретает преимущественную конформацию, которая является наиболее стабильной. Для снижения напряжений и, таким образом, достижения стабильности предпочтительна конформация, в которой объемные группы расположены как можно дальше друг от друга.
КОНФОРМАЦИЯ В ЦИКЛАХ ТРЕХ, ЧЕТЫРЕХ И ПЯТИ АТОМОВ УГЛЕРОДА
циклопропан
Отклонение валентного угла трехчленного кольца от угла, соответствующего sp3-гибридизации, велико, поэтому циклопропан имеет очень большую угловую деформацию.
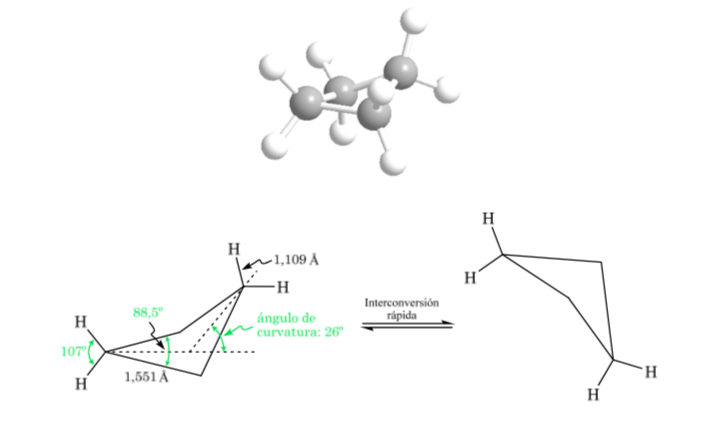
Циклобутан: конформация бабочки
Молекула имеет слегка искривленную структуру. Связи С—С менее искривлены и их реакционная способность меньше, чем в случае циклопропана. Взаимопревращение между различными конформациями происходит быстро.
Циклопентан: Конформация на
Циклопентан, если бы он был плоским, имел бы высокую деформацию затмения из-за десяти взаимодействий H-H с затмением, что привело бы к складыванию кольца. Складывание снимает напряжение кручения. Циклопентан не проявляет реакционной способности трех- и четырехчленных колец.
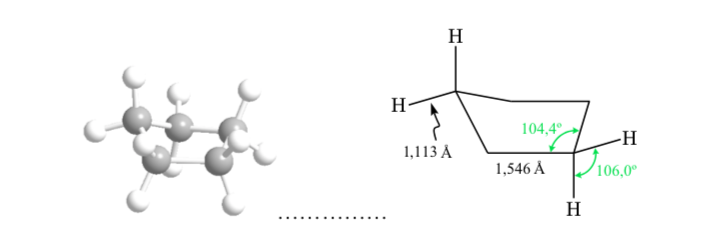
КОНФОРМАЦИОННЫЙ АНАЛИЗ ЦИКЛОГЕКСАНОВ: Конформация стула
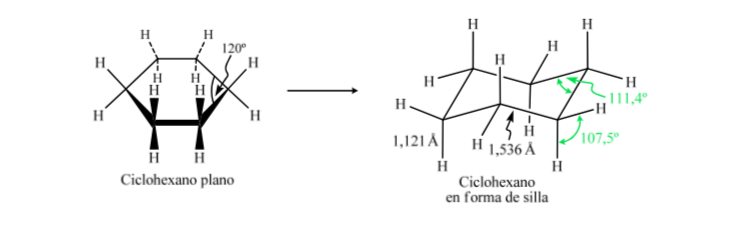
Если бы циклогексан имел плоскую структуру, он имел бы валентный угол 120°. Свободный от деформации sp3-гибридный углерод имеет тетраэдрический угол 109,5°, что заставляет циклогексан принимать неплоскую и более стабильную конформацию: конформацию кресла.
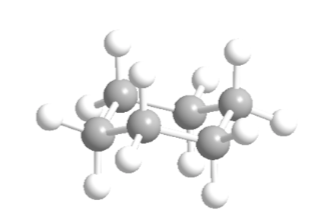
Циклогексан в конформации кресла имеет 6 аксиальных атомов водорода и 6 экваториальных атомов водорода. Аксиальные атомы водорода направлены вверх и вниз по кольцу, тогда как экваториальные атомы водорода направлены из кольца.
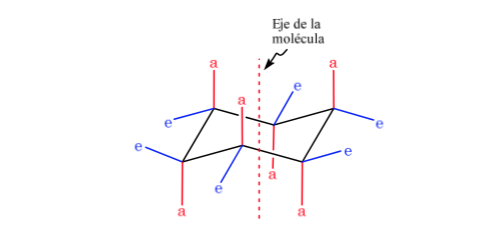
Циклогексан в конформации кресла может изменить свою конформацию другим креслом такой же стабильности. Это явление называется взаимопревращением двух форм стула.
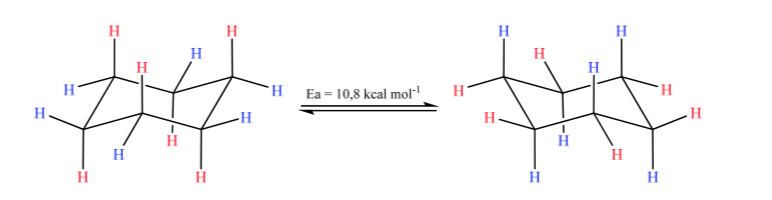
При внимательном рассмотрении взаимопревращения можно заметить, что аксиальная связь С–Н становится экваториальной и, наоборот, экваториальная становится аксиальной.
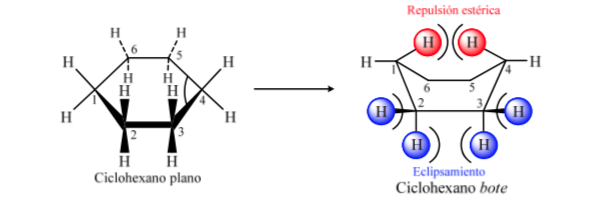
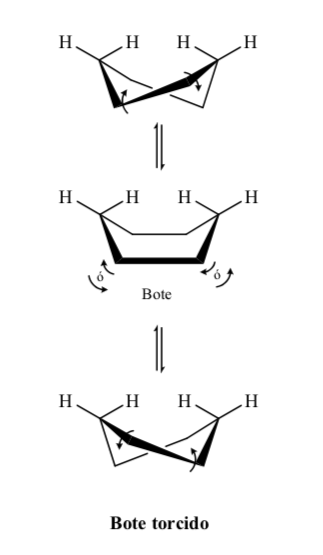
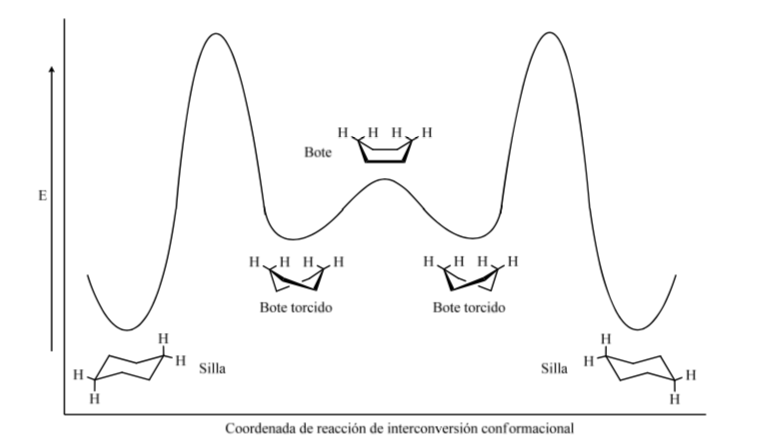
Энергетические уровни конформеров циклогексана:
Если мы наблюдаем конформацию кресла циклогексана, такую, что атом C-2 перекрывается с атомом C-3, а атом C-6 перекрывается с C-5, мы можем нарисовать проекцию Ньюмена циклогексана:
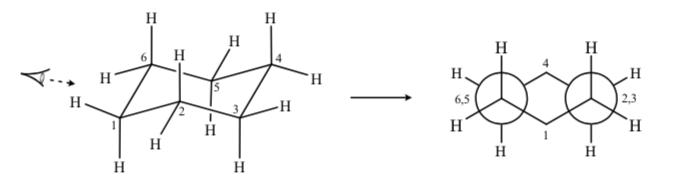
ЗАМЕЩЕННЫЕ ЦИКЛОГЕКСАНЫ
Если мы рассмотрим метилциклогексан, мы можем предложить две структуры, которые представляют его в зависимости от того, находится ли метильная группа в аксиальном или экваториальном положении.
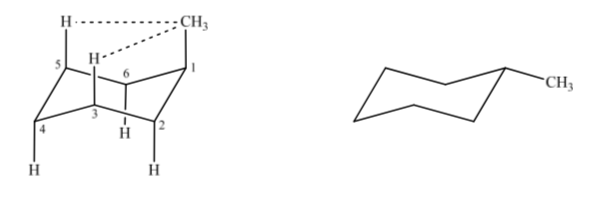
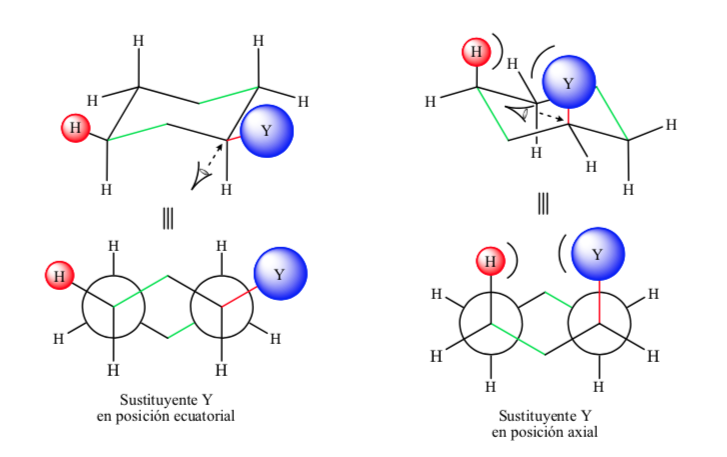
Если неводородный заместитель находится в аксиальном положении, взаимодействия с атомами водорода в положениях 3 и 5 кольца происходят из-за пространственной близости. Если он находится в экваториальном положении, заместитель направлен из кольца и взаимодействия меньше. Как и ожидалось, конформация с экваториальным заместителем оказывается примерно на 1,8 ккал более стабильной, чем если бы заместитель находился в аксиальном положении. Таким образом, говорят, что заместитель в аксиальном положении представляет собой 1,3-диаксиальное взаимодействие, что делает его менее стабильным, чем в экваториальном положении.
На следующем рисунке представлены две конформации Ньюмена замещенного циклогексана с заместителем как в экваториальном, так и в аксиальном положениях.
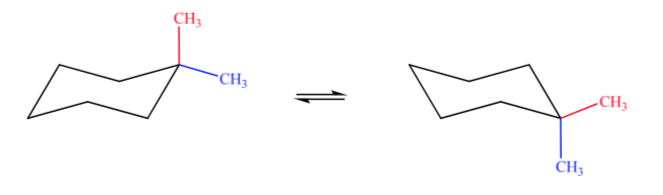
Двузамещенные циклогексаны
A. 1,1-диметилциклогексан B. 1,2-диметилциклогексан C. 1,3-диметилциклогексан D. 1,4-диметилциклогексан
В случае А одна метильная группа будет находиться в аксиальном положении, а другая — в экваториальном, поэтому обе возможные конформации будут одинаково стабильны.
В каждом из оставшихся случаев мы можем представить две разные структуры в зависимости от того, находятся ли две метильные группы в цис (направлены к одной и той же стороне плоскости) или в транс (направлены к противоположным сторонам).
В B цис-изомер должен иметь оба метила по одну сторону от центральной плоскости, поэтому один метил будет аксиальным, а другой экваториальным.
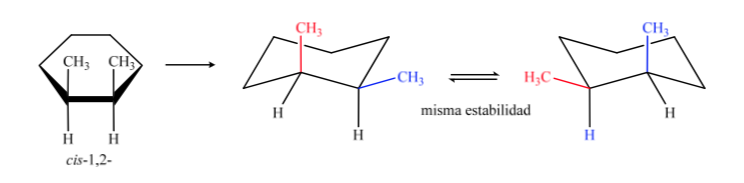
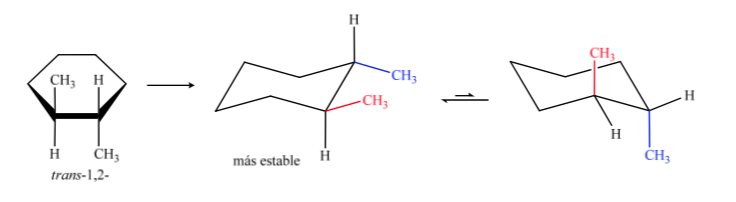
Транс-изомер - это изомер с двумя метилами, обращенными к противоположным сторонам, поэтому он будет представлять оба метила в аксиальном положении или оба в экваториальном положении. Конформация, присутствующая в экваториальной, более стабильна, чем в аксиальной, поэтому можно сказать, что изомер транс-1,2-диметилциклогексана более стабилен, чем изомер цис-1,2-диметилциклогексана.
В случае 1,3-диметилциклогексана мы можем представить:
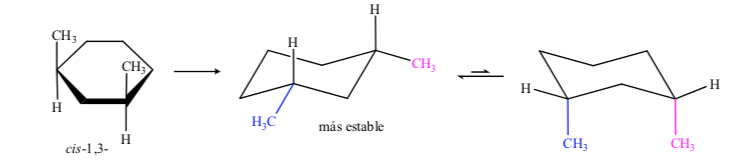
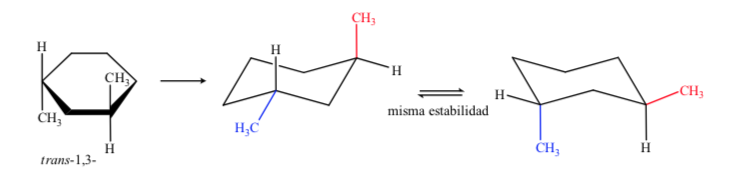
Сделан вывод, что цис-изомер, который представляет два заместителя в экваториальном положении, более стабилен, чем транс-изомер, который всегда будет иметь один метил в аксиальном, а другой - в экваториальном.
В случае D, 1,4-диметилциклогексана мы будем иметь:
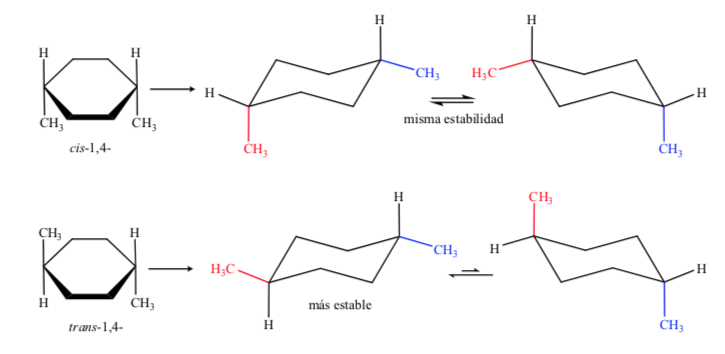
В этом случае транс-изомер более стабилен, потому что две метильные группы расположены экваториально.
При работе с дизамещенными циклогексанами с различными группами наиболее устойчивым изомером будет изомер с наибольшей экваториальной группой.
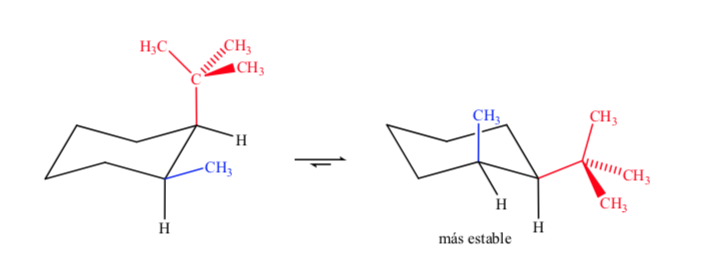
Наконец, в случае полизамещенных циклогексанов, имеющих разные заместители, предпочтительной будет конформация с наибольшим количеством объемных групп в экваториальном положении.
КОНФОРМАЦИЯ В ШЕСТИЧЛЕННЫХ ГЕТЕРОЦИКЛАХ:
АНОМЕРНЫЙ ЭФФЕКТ
В органической химии аномерный эффект или эффект Эдварда-Лемье представляет собой стереоэлектронный эффект, который описывает тенденцию гетероатомных заместителей, смежных с гетероатомом в циклогексановом кольце, предпочитать аксиальную ориентацию, а не менее покрытую экваториальную ориентацию, которую можно было бы ожидать от. стерические соображения. Этот эффект первоначально наблюдался в пиранозных кольцах Дж. Т. Эдвардом в 1955 г.; в то время Н.-Ж. Chii и Raymond U. Lemieux начали изучать равновесие аномеризации полностью ацетилированных производных некоторых альдогексопираноз. Термин «аномерный эффект» был введен в 1958 г.
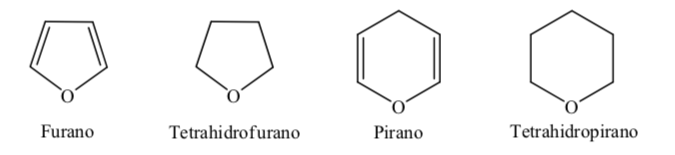
Некоторые из наиболее распространенных пяти- и шестичленных гетероциклов в биологических процессах:
А. Кислородсодержащие гетероциклы:
Б. Азотсодержащие гетероциклы:
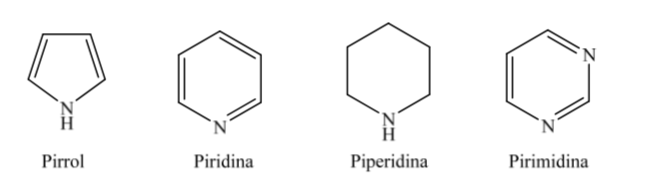
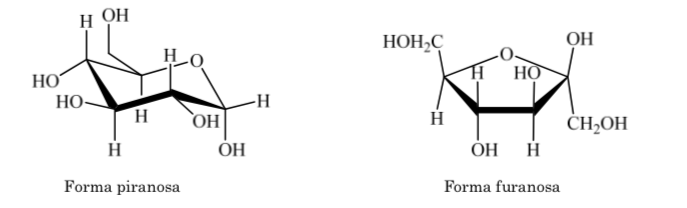
Когда дело доходит до полностью гидрированных гетероциклов с пятью и шестью членами, таких как тетрагидрофуран и тетрагидропиран, наиболее стабильная конформация, которую они представляют, аналогична конформации циклопентана и циклогексана соответственно, то есть конформация на или конформация кресло.
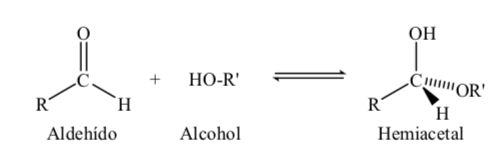
Сахара с 5 и 6 атомами углерода приобретают циклическую структуру при образовании полуацетальной связи в результате реакции карбонила (сахарного альдегида или кетона) с гидроксильной группой.
Реакцию образования полуацеталя можно схематически представить следующим образом:
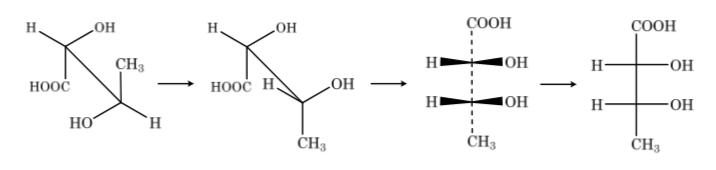
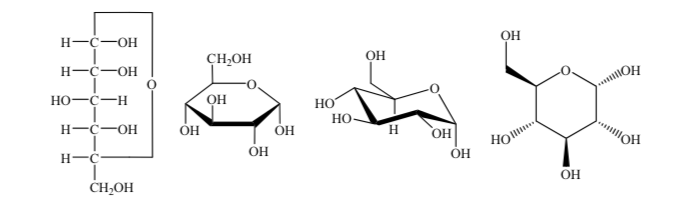
Для их изучения сахара представляются линейными структурами по правилам проекций Фишера.
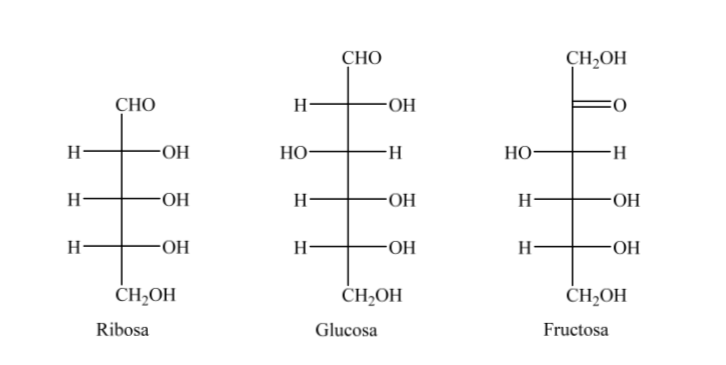
Таким образом, в качестве примера можно представить рибозу, глюкозу и фруктозу:
Когда образуется полуацеталь, молекула приобретает изогнутую форму, в которой альдегидная функция альдозы на углероде 1 расположена близко к гидроксилу на углероде 5, присоединяясь к карбонильной двойной связи, образуя шестичленный циклический полуацеталь (пиранозидное кольцо). ).
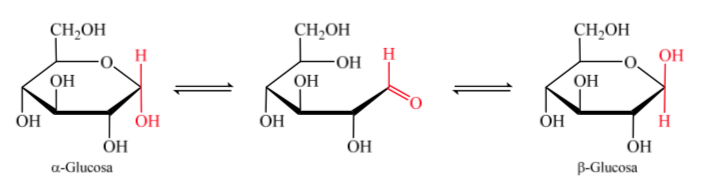
То же самое происходит и с кетозами, но в этом случае полуацетальная связь возникает между углеродом 2 и углеродом 5, образуя пятичленное кольцо. (фуранозидное кольцо).
Используются разные способы представления структуры глюкозы в циклической форме:
аномеры
Изомеры моносахаридов с более чем 5 атомами углерода, которые образовали полуацетальную связь, называются аномерами, что позволило им принять циклическую структуру и определить 2 различных положения для гидроксильной группы (α или β) в новом созданном центре. .
Пиранозное кольцо должно быть похоже на кольцо циклогексана и существовать в конформации кресла, а не в конформации закрученной лодочки, чтобы минимизировать напряжения кручения. Рентгеновский анализ показывает, что эти предположения верны.
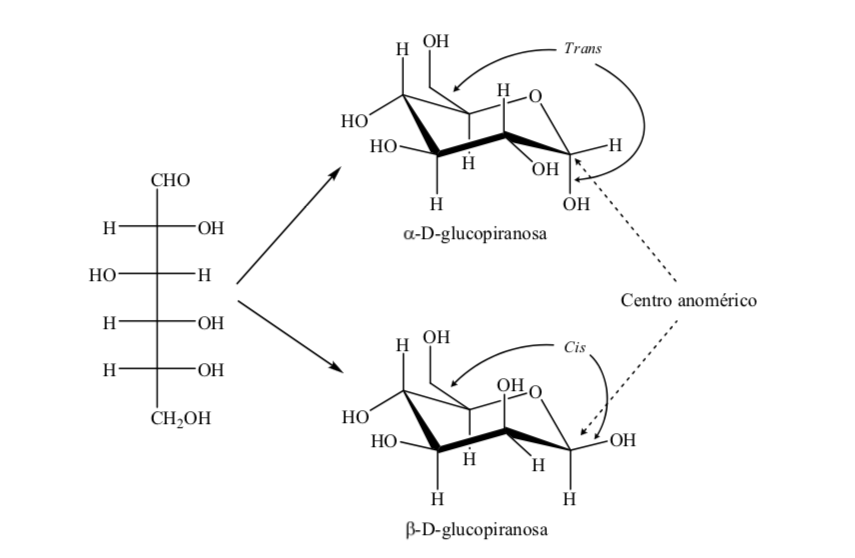
Два аномера обозначены как альфа (α) или бета (β) аномеры в соответствии с конфигурационным соотношением между аномерным центром и эталонным аномерным атомом. Аномерный центр находится на полуацетальном углероде и представляет собой аномерный углерод C-1, который связан через кислород с C-5, который связан с полукеталем кислорода.
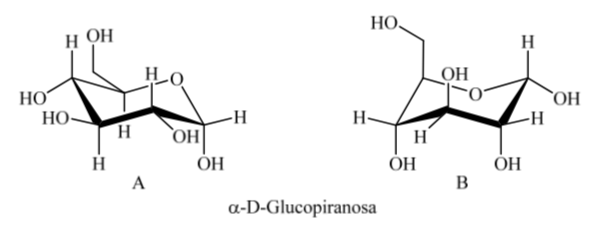
Однако существуют две возможные конформации кресла для одного и того же аномера D-(+)-глюкопиранозы.
Таким образом, для β-D-(+)-глюкопиранозы возможны две конформации. Та, которая представляет самые объемные группы в экваториальной (А), будет более стабильной.
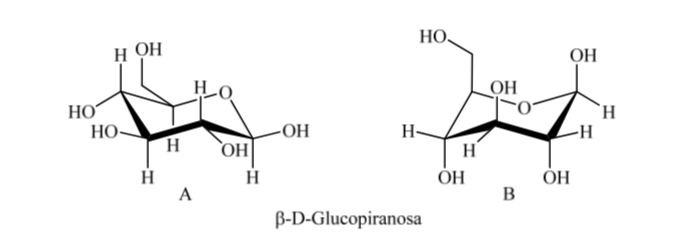
Что происходит с α-D-(+)-глюкозой? При этом наиболее устойчивой является та конформация, в которой ОН на аномерном углероде аксиальна, а объемные группы экваториальны (А).
Интересно отметить, что из всех D-альдогексоз только β-D-(+)-глюкопираноза может принимать конформацию, в которой каждая ее большая группа может занимать экваториальное положение. Это согласуется с тем фактом, что β-D-(+)-глюкопираноза является сахаром, наиболее часто встречающимся в природе.
электронные эффекты
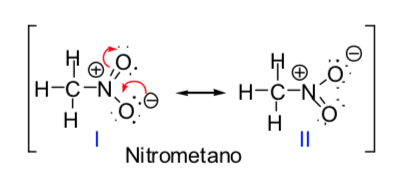
Некоторые органические молекулы могут быть представлены двумя или более структурами Льюиса, которые отличаются друг от друга только расположением электронов и называются s-резонансными структурами. В этих случаях молекула будет иметь характеристики обеих структур, и говорят, что молекула фактически является резонансным гибридом резонансных структур. Резонансный метод позволяет нам узнать качественным образом стабилизацию, которой молекула может достичь за счет электронной делокализации. Чем большим числом резонансных структур можно описать химический вид, тем выше его стабильность.
Концепция резонансных структур может быть применена при описании нитрометана, который может быть представлен двумя структурами Льюиса, приведенными ниже:
Сопряженные связи и их энергия
Конформационный анализ ароматичности
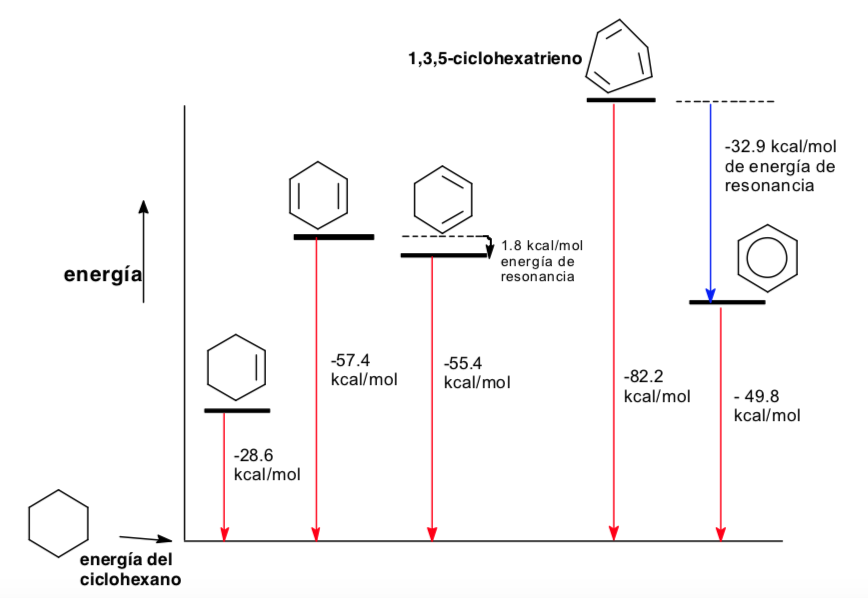 Термодинамика и конформационный анализ (стереоэлектронные эффекты)
Термодинамика и конформационный анализ (стереоэлектронные эффекты)
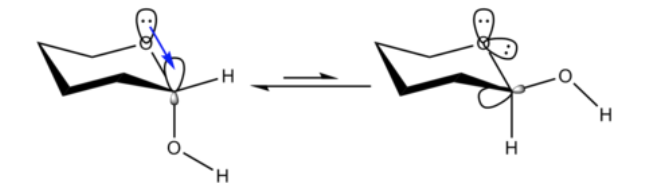
Неудивительно, что метокси-заместитель в циклогексановом кольце предпочитает принимать экваториальную конформацию.
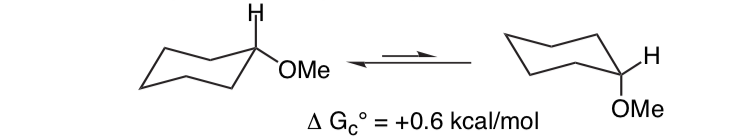
Неожиданно то, что близкородственный 2-метокситетрагидропиран ClHO предпочитает аксиальную конформацию:
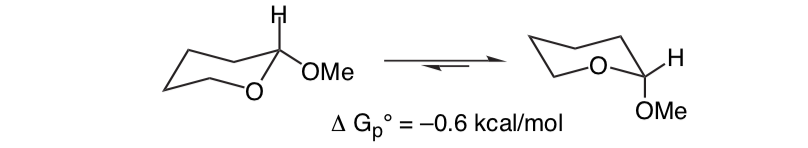
Этот эффект, который обеспечивает стабилизацию аксиальной формы O, устраняющую присущее заместителю стерическое смещение, называется аномерным эффектом.
Связь свободной энергии с аномерным эффектом будет следующей:
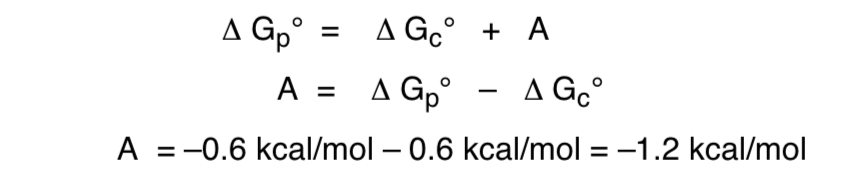
Рекомендуемые источники для расширения поиска:
1) Хуаристи Э. «Основные понятия орбитальной теории». CINVESTAV, Мексика, 1988 Хуаристи Э. "Органическая физикохимия". СИНВЕСТАВ, Мексика, 1994 г.
2) Нил С.И. «Физическая органическая химия» Лонгман, Милан, 1995.
3) Марч Дж., «Продвинутая органическая химия», John Wiley & Sons, Нью-Йорк, 1992 г. 4) Джонс РЭЙ, «Физическая и механическая органическая химия», 2-е место. Издательство Эда Кембриджского университета, Кембридж, 1984.
5) Вудворд Р.Б. и Хоффманн Р. «Сохранение орбитальной симметрии», Academic Press, Нью-Йорк, 1979.
6) Карпентер Б.К. «Определение механизмов органических реакций», John Wiley & Sons, Нью-Йорк, 1984.