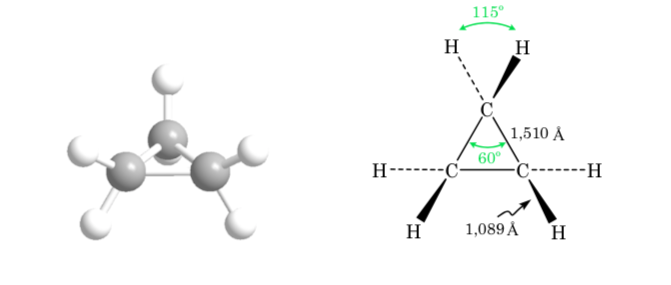
Stereochemie und Konformationsanalyse
Stereochemie ist der Zweig der Chemie, der sich mit den dreidimensionalen Aspekten von Molekülen und ihrer Reaktivität befasst. Organische Chemie kann nicht verstanden werden, ohne die Stereochemie zu berücksichtigen. Biologische Systeme sind hochselektiv und unterscheiden oft Moleküle mit sehr kleinen stereochemischen Unterschieden.
Die Konformationsanalyse ist Teil der räumlichen Untersuchung von Molekülen, dh der Stereochemie.
KONSTITUTION, KONFIGURATION UND KONFORMATION
Verbindungen mit der gleichen Formel nennt man Isomere.
empirisch, aber andere Struktur.
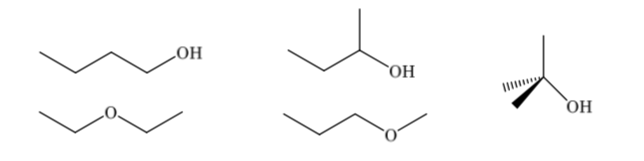
Die Konstitutionsisomere unterscheiden sich in ihrer Bindungssequenz, sie weisen unterschiedliche Konnektivität auf. Eine Verbindung mit der Summenformel C4H10O kann verschiedene Konstitutionen haben:
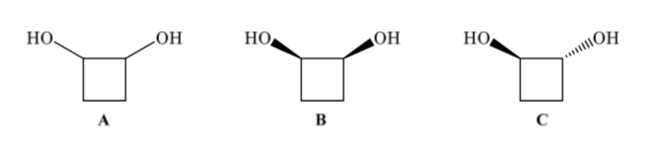
Konfigurationsisomere haben die gleiche Konnektivität, unterscheiden sich aber in der räumlichen Anordnung der Atome. 1,2-Cyclobutandiol (A) kann zwei Konfigurationsisomere aufweisen, je nachdem, ob sich die beiden OH-Gruppen auf der gleichen Seite (B) oder auf gegenüberliegenden Seiten (C) befinden.
Konformationsisomere haben die gleiche Konstitution, die gleiche Konfiguration, aber sie unterscheiden sich räumlich darin, dass sie durch einfache Rotation einer Bindung von einem Isomer zum anderen übergehen. Die verschiedenen Formen, die Moleküle als Ergebnis der Rotation um eine Einfachbindung annehmen, werden als Konformationen bezeichnet, von denen jede ein Konformer ist.
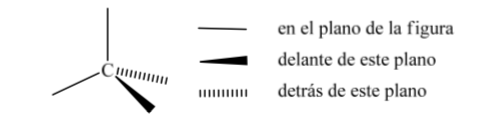
Eine der am weitesten verbreiteten Darstellungen von Kohlenstofftetraedern ist die sogenannte perspektivische Darstellung.
So können wir im Fall von Chlorethan die verschiedenen Konformere wie folgt perspektivisch darstellen:
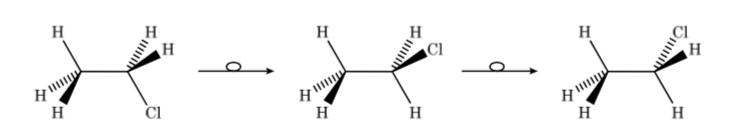
Konfigurations- und Konformationsisomere sind Stereoisomere. Stereoisomere haben die gleiche Konnektivität, unterscheiden sich jedoch in der Orientierung einiger ihrer Atome im Raum. Sie weisen oft erhebliche Unterschiede in ihren physikalischen, chemischen und biologischen Eigenschaften auf.
KONFORMATION IN ACYCLISCHEN ORGANISCHEN MOLEKÜLEN
Darstellung organischer Moleküle
Es gibt mehrere Möglichkeiten, Moleküle in der Ebene darzustellen.
Darstellung in Perspektive oder Staffelei
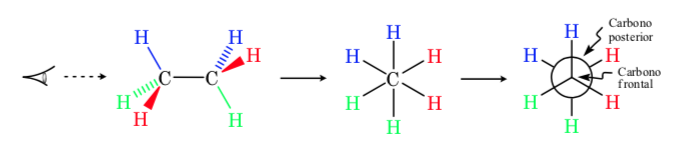
Newman-Projektion
In einer Newman-Projektion werden zwei benachbarte Kohlenstoffatome in einem Molekül innerhalb eines Kreises dargestellt. Vorne ist das von vorne gesehene Kohlenstoffatom und hinter dem Kreis das überlappende Kohlenstoffatom. Die drei Substituenten jedes Kohlenstoffs kommen aus der Mitte des Kreises vorne und hinten heraus.
Fischer Vertretung
In der Fischer-Darstellung wird ein tetraedrisches Kohlenstoffatom durch die Mitte eines Kreuzes dargestellt, und die Substituenten sind so an den Enden platziert, dass die vertikalen Linien anzeigen, dass die Bindungen zur Rückseite der Papierebene und dem ausgerichtet sind horizontale nach vorne. . Die Hauptkette ist vertikal angeordnet.
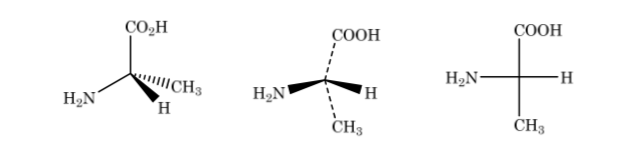
Wie oben gezeigt die Darstellung von 2-Aminopropansäure
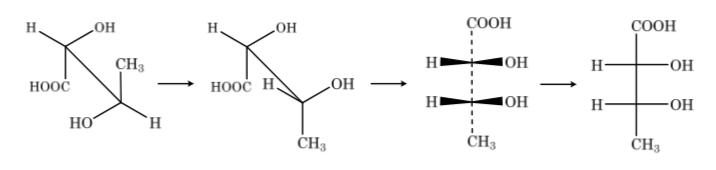
Wenn die Verbindung verschiedene Kohlenstoffatome hat, wird die Kohlenstoffkette vertikal mit den Substituenten jedes Kohlenstoffs horizontal gezeichnet, wobei immer die Regel beibehalten wird, dass die vertikalen Bindungen hinter der Ebene und die horizontalen nach vorne verlaufen.
Ethan-Konformationen
Die σ-Bindung, die die Kohlenstoffatome in Ethan verbindet, ist zylindersymmetrisch und erlaubt eine freie Rotation um sie herum. Die Rotation um die C-C-Bindung wandelt die verschiedenen Konformationen von Ethan ineinander um. Die Untersuchung seines thermodynamischen und kinetischen Verhaltens wird als Konformationsanalyse bezeichnet.
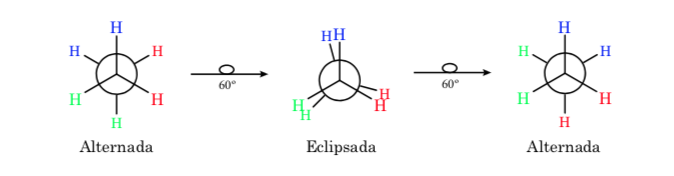
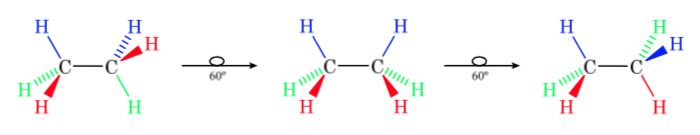
Die erste Abbildung stellt das Ethanmolekül dar, bei dem die Wasserstoffatome bei minimaler Wechselwirkung zwischen ihnen so weit wie möglich voneinander entfernt sind. Sie wird als alternative Konformation bezeichnet.
Der zweite kommt von einer 60°-Drehung zur C-C-Bindung und wo die Wasserstoffatome verfinstert sind.
Auch hier führt eine 60°-Drehung zur C-C-Bindung zu einer anderen Konformation.
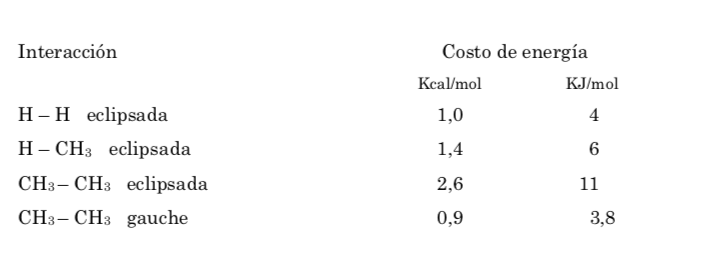
Die potentielle Energie des Moleküls ist minimal für die gestaffelte Konformation, nimmt mit der Rotation zu und erreicht ein Maximum für die verfinsterte Konformation. Die zu überwindende Energiedifferenz oder Energiebarriere, um von einer Konformation in eine andere überzugehen, liegt in der Größenordnung von 3 kcal (siehe Zeichnung).
Die meisten Ethanmoleküle existieren natürlicherweise in der stabilsten Konformation. Da die Energiebarriere bei Raumtemperatur nicht sehr hoch ist, ist die Anzahl der Stöße mit ausreichender Energie groß genug, dass die Umwandlung der Konformere schnell erfolgt. Die Energie, die erforderlich ist, um das Molekül um die C-C-Bindung zu drehen, ist auf Torsionsspannung zurückzuführen.
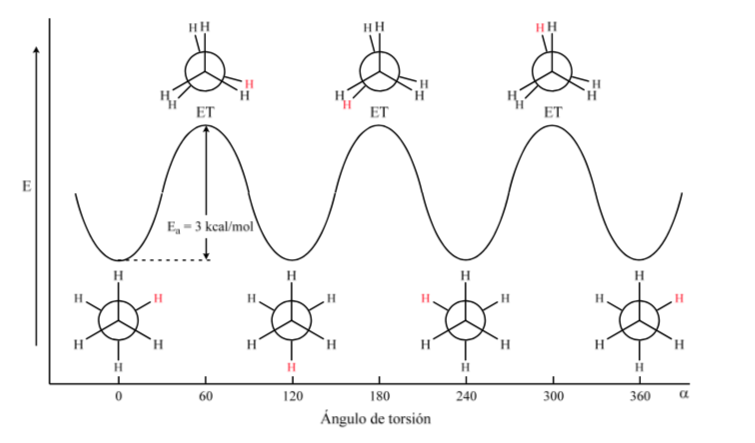
Das obige Diagramm zeigt die Energieänderungen beim Übergang von einer Konformation in eine andere während der Rotation der C-C-Einfachbindung.
Wenn die Ethan-Wasserstoffe durch andere Atome oder Gruppen ersetzt werden, ändern sich die Energieniveaus der Konformationen und ihre Untersuchung muss für jeden Fall durchgeführt werden.
Propan Konformationen
Wenn wir im Fall des Propanmoleküls die Newman-Projektionen gemäß einer der C – C-Bindungen darstellen und die Bindung drehen, finden wir uns wie im Fall des Ethans mit verdunkelten und alternierenden Konformationen wieder.
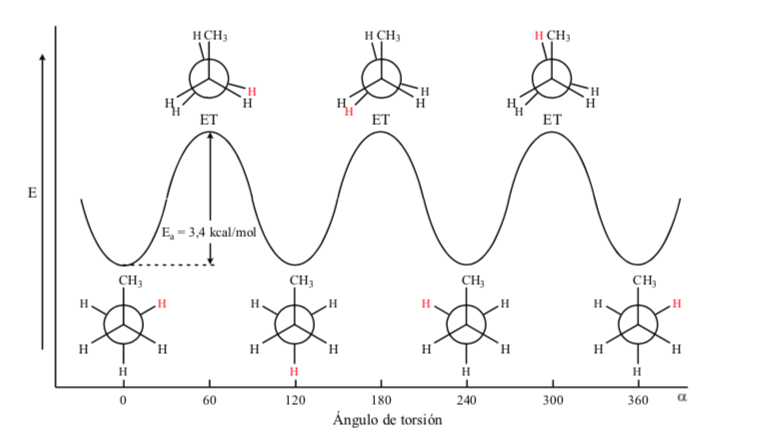
Die Energiebarriere zwischen einer alternierenden und einer verdunkelten Form ist größer als im Fall von Ethan (3,4 kcal mol-1), da die Methylgruppe größer als Wasserstoff ist und die Wechselwirkungen größer sind. Gestaffelte Konformationen sind stabiler als verfinsterte Konformationen.
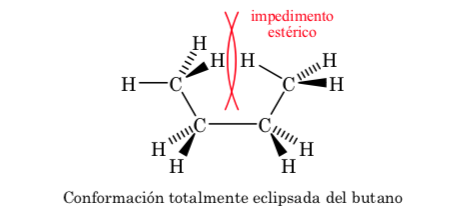
Konformationen von n-Butan
Betrachtet man die zentrale C-C-Bindung, so kann man sich Butan bei der Newman-Darstellung als ein dem Ethan ähnliches Molekül vorstellen, in dem zwei Wasserstoffatome durch zwei Methylgruppen ersetzt sind.
Wie bei Ethan haben die alternativen Konformationen eine niedrigere Energie und sind stabiler als die verfinsterten: 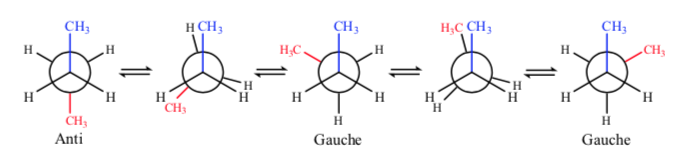
Von allen alternativen Konformationen wird die mit den beiden Methylgruppen in möglichst entgegengesetzter Position (Diederwinkel 180o) als Anti-Konformation bezeichnet und ist die stabilste. Die anderen beiden alternativen Konformationen haben ähnliche Energie und werden Gauche-Konformationen genannt, bei denen sich die Methylgruppen in einem Diederwinkel von 60 ° aufeinander treffen. Abhängig von der Rotation um die C-C-Bindung existieren zwei solcher Konformationen.
Von den drei verdunkelten Konformationen heben wir zuerst die hervor, bei der die beiden Methylgruppen verdunkelt sind, was eine stärkere Wechselwirkung und daher weniger Stabilität erzeugt. Die beiden anderen verfinsterten Konformationen haben einen geringeren Energiegehalt und sind etwas stabiler. Siehe Energiediagramm.
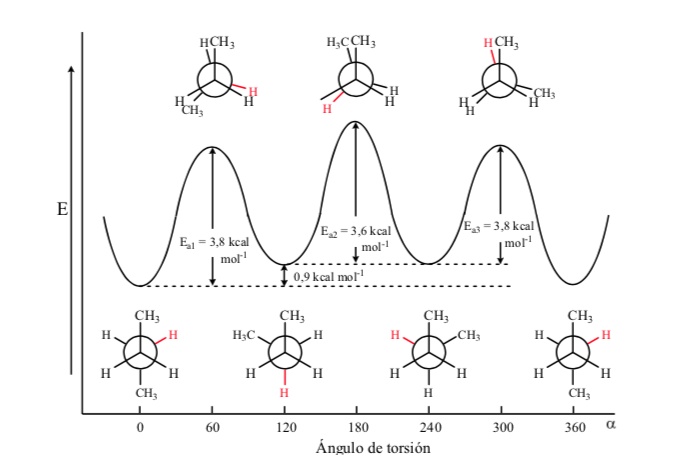
Kollisionen liefern die Energie, die benötigt wird, um die Aktivierungsenergiebarriere zu überwinden.
KONFORMATION IN ZYKLISCHEN ORGANISCHEN MOLEKÜLEN
Cycloalkane unterliegen aufgrund ihrer zyklischen Struktur einer Ringspannung namens Bayer-Stamm. Diese Spannung ist das Ergebnis von drei Faktoren:
- Verbindungsspannung
- Eclipse von Atomen und Bindungen - Sterische Belastung
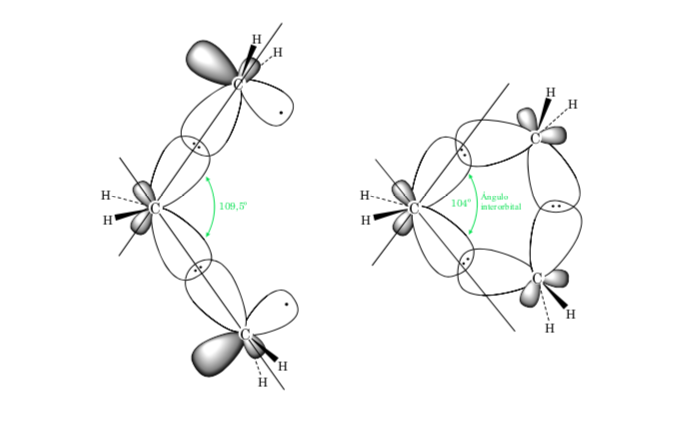
A. Die Bindungsspannung in Cycloalkanen ist auf den Unterschied in der Orbitalüberlappung in Bezug auf ein acyclisches Alkan zurückzuführen. Je näher der Wert des Winkels C–C–C am Tetraeder (109,5o) liegt, desto größer ist die Überlappung und desto geringer ist die Bindungsspannung.
Der sterische Effekt beruht auf der Wechselwirkung von Atomen durch den Raum. Um zu vermeiden, dass die Wechselwirkung zwischen den Atomen zu hoch wird, nimmt das Molekül eine bevorzugte Konformation an, dies ist die stabilste. Um Spannungen zu reduzieren und somit Stabilität zu erreichen, wird die bevorzugte Konformation eine sein, in der die voluminösen Gruppen so weit wie möglich voneinander entfernt sind.
KONFORMATION IN ZYKLEN VON DREI, VIER UND FÜNF KOHLENSTOFFATOMEN
Cyclopropan
Die Abweichung des Bindungswinkels des dreigliedrigen Rings von dem der sp3-Hybridisierung entsprechenden Winkel ist groß, sodass Cyclopropan eine sehr hohe Winkeldehnung aufweist.
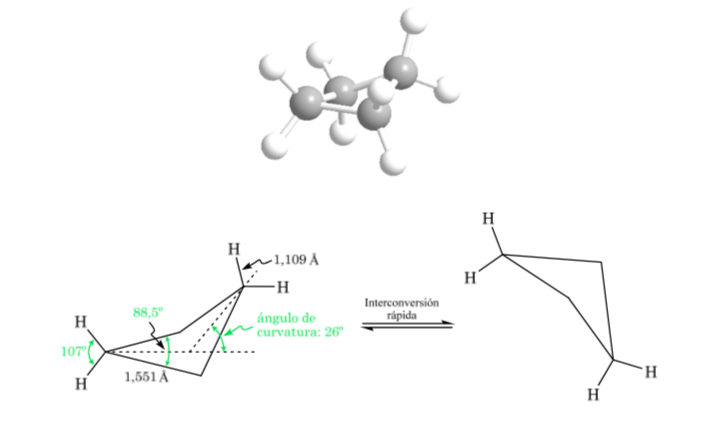
Cyclobutan: Schmetterlingskonformation
Das Molekül hat eine leicht verzerrte Struktur. Die CC-Bindungen sind weniger gekrümmt und ihre Reaktivität geringer als bei Cyclopropan. Die gegenseitige Umwandlung zwischen den verschiedenen Konformationen ist schnell.
Cyclopentan: Konformation an
Cyclopentan hätte, wenn es planar wäre, aufgrund von zehn verdunkelten H-H-Wechselwirkungen eine hohe Verdunkelungsspannung, was zu einer Faltung des Rings führen würde. Die Faltung setzt Torsionsspannungen frei. Cyclopentan zeigt nicht die Reaktivität der drei- und viergliedrigen Ringe.
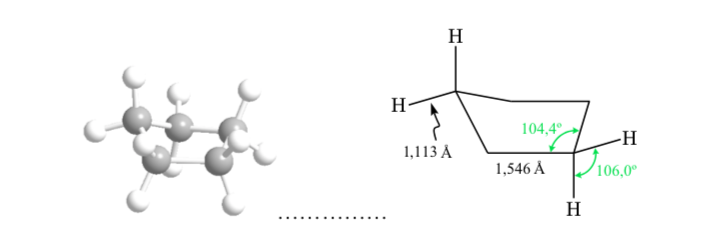
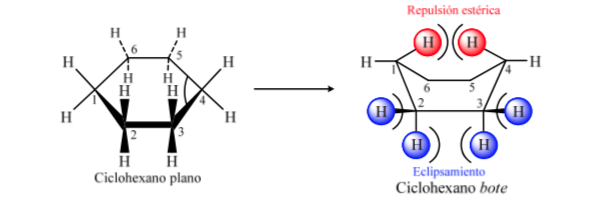
KONFORMATIONSANALYSE VON CYCLOHEXANEN: Stuhlkonformation
Wenn Cyclohexan eine planare Struktur hätte, hätte es einen Bindungswinkel von 120°. Ein spannungsfreier, sp3-hybridisierter Kohlenstoff hat einen Tetraederwinkel von 109,5°, wodurch Cyclohexan eine nichtplanare und stabilere Konformation annimmt: die Stuhlkonformation.
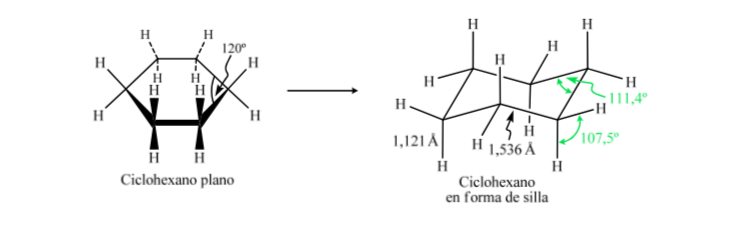
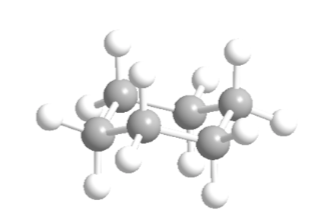
Cyclohexan in Sesselkonformation hat 6 axiale Wasserstoffatome und 6 äquatoriale Wasserstoffatome. Die axialen Wasserstoffe sind den Ring nach oben und unten gerichtet, während die äquatorialen Wasserstoffe aus dem Ring heraus gerichtet sind.
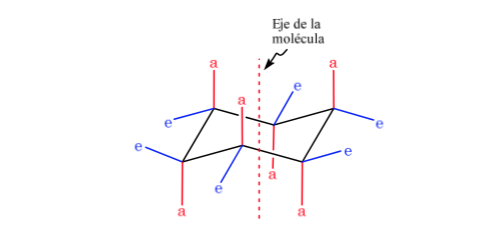
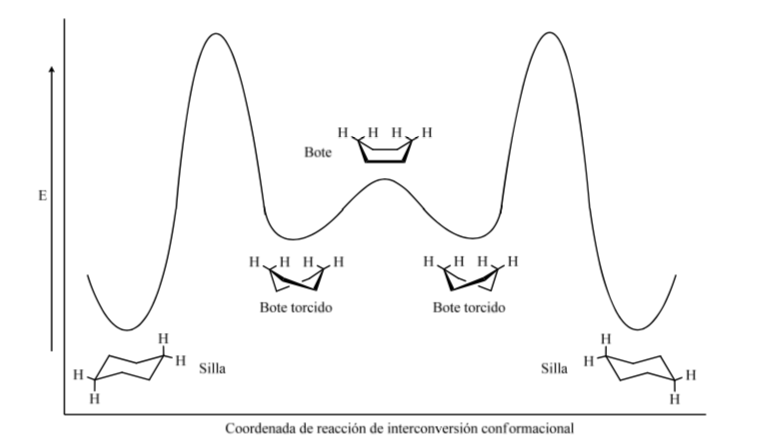
Cyclohexan in Sesselkonformation ist anfällig dafür, seine Konformation durch einen anderen Sessel gleicher Stabilität zu modifizieren. Dieses Phänomen wird als Umwandlung zweier Stuhlformen bezeichnet.
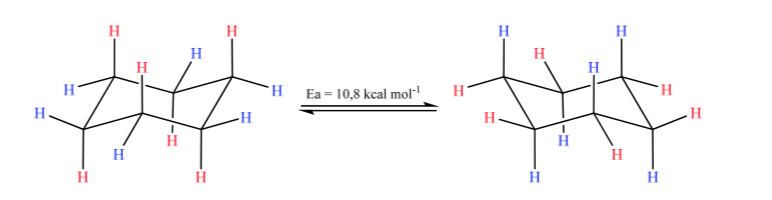
Bei genauer Betrachtung der Umwandlung wird beobachtet, dass die axiale CH-Bindung äquatorial wird und umgekehrt die äquatoriale axial wird.
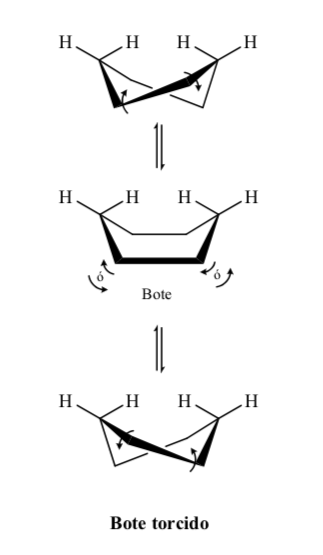
Energieniveaus der Cyclohexan-Konformere:
Wenn wir eine Sesselkonformation von Cyclohexan beobachten, so dass das C-2-Atom das C-3-Atom überlappt und das C-6-Atom das C-5 überlappt, können wir eine Newman-Projektion von Cyclohexan zeichnen:
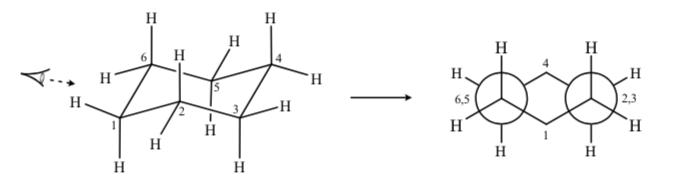
SUBSTITUIERTE CYCLOHEXANE
Wenn wir Methylcyclohexan betrachten, können wir zwei Strukturen vorschlagen, die es darstellen, je nachdem, ob sich die Methylgruppe in axialer oder äquatorialer Position befindet.
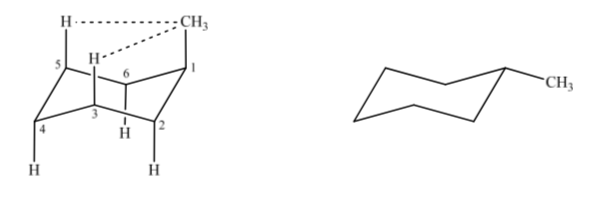
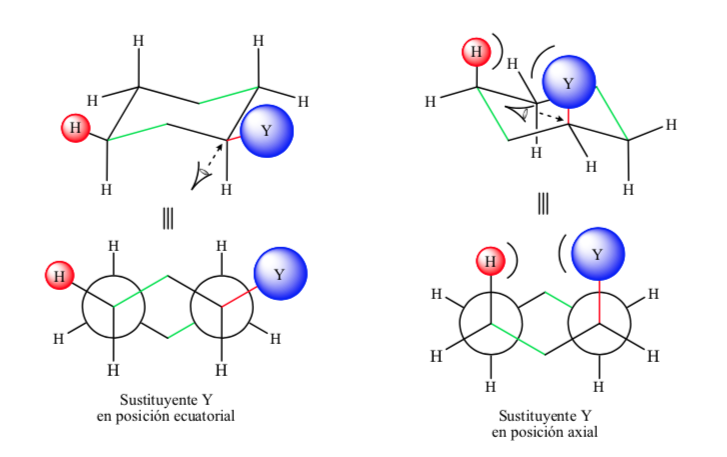
Befindet sich der Nicht-Wasserstoff-Substituent in axialer Position, kommt es aufgrund der räumlichen Nähe zu Wechselwirkungen mit den Wasserstoffen in Position 3 und 5 des Rings. Befindet er sich in äquatorialer Position, ist der Substituent aus dem Ring gerichtet und die Wechselwirkungen sind geringer. Wie erwartet ist die Konformation mit dem äquatorialen Substituenten etwa 1,8 kcal stabiler, als wenn sich der Substituent in axialer Position befindet. Daher wird gesagt, dass ein Substituent in einer axialen Position eine 1,3-diaxiale Wechselwirkung aufweist, die ihn weniger stabil macht als in einer äquatorialen Position.
Die folgende Abbildung stellt die Newman-Konformationen eines substituierten Cyclohexans dar, wobei sich sowohl der Substituent in äquatorialer als auch in axialer Position befindet.
Disubstituierte Cyclohexane
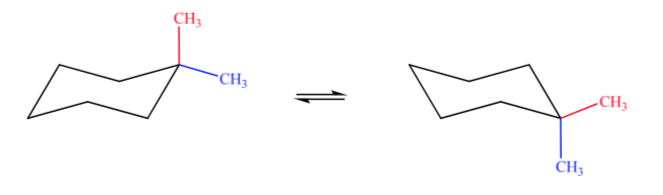
A. 1,1-Dimethylcyclohexan B. 1,2-Dimethylcyclohexan C. 1,3-Dimethylcyclohexan D. 1,4-Dimethylcyclohexan
Im Fall A befindet sich eine Methylgruppe in axialer Position und die andere in äquatorialer Position, sodass die beiden möglichen Konformationen gleich stabil sind.
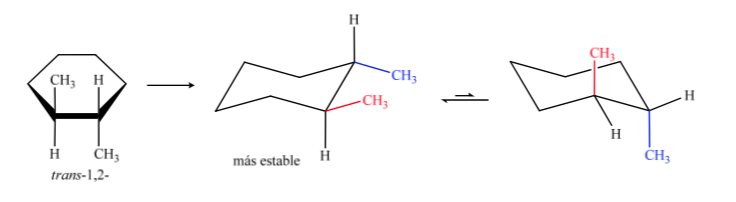
In jedem der verbleibenden Fälle können wir zwei unterschiedliche Strukturen darstellen, je nachdem, ob die beiden Methylgruppen in cis (zur selben Seite der Ebene gerichtet) oder in trans (zu entgegengesetzten Seiten gerichtet) stehen.
In B muss das cis-Isomer beide Methylgruppen auf derselben Seite der Mittelebene haben, sodass eine Methylgruppe axial und die andere äquatorial ist.
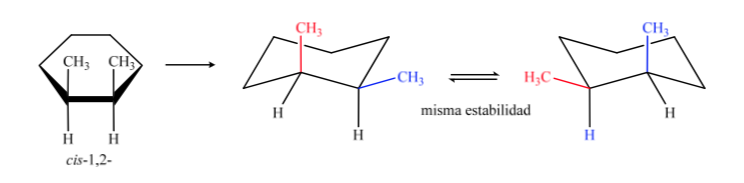
Das trans-Isomer ist dasjenige, bei dem die beiden Methylgruppen gegenüberliegenden Seiten zugewandt sind, sodass beide Methylgruppen in einer axialen Position oder beide in einer äquatorialen Position vorliegen. Die Konformation, die beide in äquatorialer Form vorliegen, ist stabiler als in axialer Richtung, daher können wir sagen, dass das trans-1,2-Dimethylcyclohexan-Isomer stabiler ist als das cis-1,2-Dimethylcyclohexan-Isomer.
Im Fall von 1,3-Dimethylcyclohexan können wir darstellen:
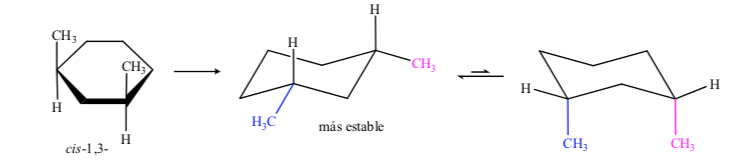
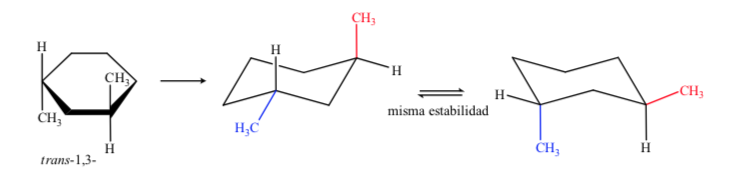
Daraus wird geschlossen, dass das cis-Isomer, das die zwei Substituenten in äquatorialer Stellung darstellt, stabiler ist als das trans, das immer ein Methyl in axialer und ein anderes in äquatorialer Stellung aufweist.
Im Fall D, 1,4-Dimethylcyclohexan, haben wir:
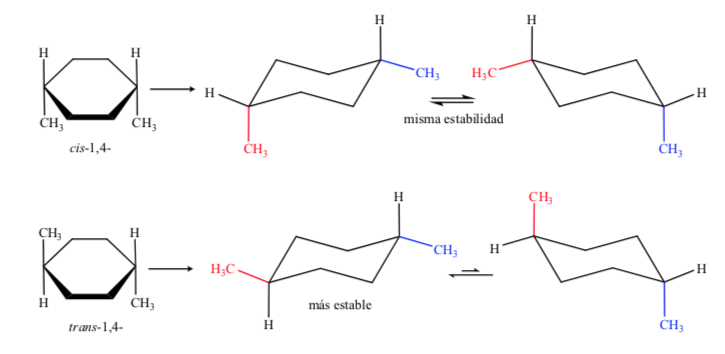
In diesem Fall ist das trans-Isomer stabiler, da die beiden Methylgruppen äquatorial angeordnet sind.
Bei disubstituierten Cyclohexanen mit unterschiedlichen Gruppen ist das stabilste Isomer dasjenige mit der größten äquatorialen Gruppe.
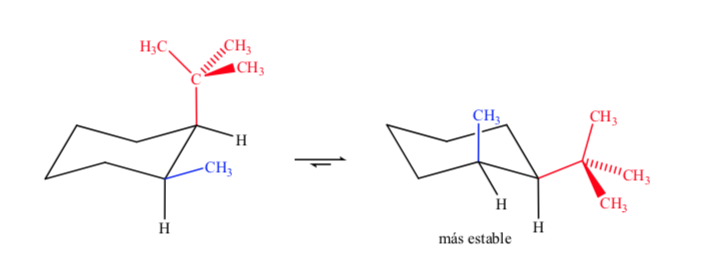
Schließlich wird im Fall von polysubstituierten Cyclohexanen, die unterschiedliche Substituenten haben, die bevorzugte Konformation diejenige mit der größten Anzahl an voluminösen Gruppen in der äquatorialen Position sein.
KONFORMATION IN SECHS-GLIEDIGEN HETEROCYKLEN:
ANOMERISCHER EFFEKT
In der organischen Chemie ist der anomere Effekt oder Edward-Lemieux-Effekt ein stereoelektronischer Effekt, der die Tendenz von heteroatomaren Substituenten neben einem Heteroatom in einem Cyclohexanring beschreibt, die axiale Orientierung gegenüber der weniger bedeckten äquatorialen Orientierung zu bevorzugen, die zu erwarten wäre sterische Überlegungen. Dieser Effekt wurde ursprünglich 1955 von JT Edward in Pyranoseringen beobachtet; damals N.-J. Chii und Raymond U. Lemieux begannen mit der Untersuchung des Anomerisierungsgleichgewichts von vollständig acetylierten Derivaten einiger Aldohexopyranosen. Der Begriff „anomerer Effekt“ wurde 1958 eingeführt.
Einige der häufigsten fünf- und sechsgliedrigen Heterocyclen in biologischen Prozessen sind:
A. Oxygenierte Heterocyclen:
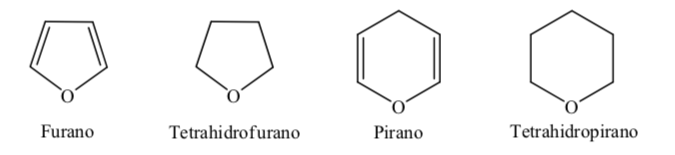
B. Stickstoffheterocyclen:
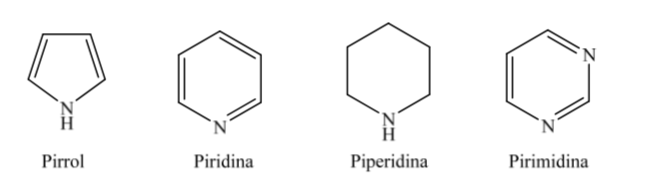
Wenn es um vollständig hydrierte Heterocyclen mit fünf und sechs Gliedern wie Tetrahydrofuran und Tetrahydropyran geht, ist die stabilste Konformation, die sie aufweisen, ähnlich der von Cyclopentan bzw. Cyclohexan, dh Konformation an oder Konformationssessel.
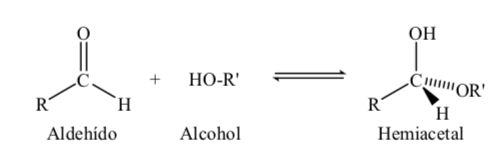
Zucker mit 5 und 6 Kohlenstoffatomen erhalten eine zyklische Struktur, wenn durch Reaktion des Carbonyls (Zuckeraldehyd oder -keton) mit einer Hydroxylgruppe eine Halbacetalbindung gebildet wird.
Die Bildungsreaktion des Halbacetals lässt sich wie folgt schematisieren:
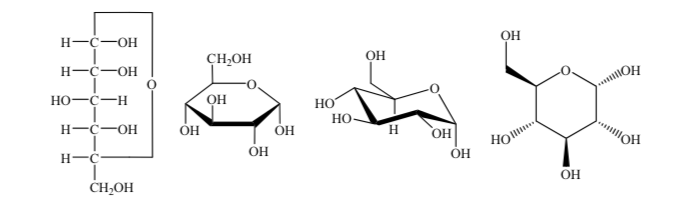
Für ihre Untersuchung werden Zucker durch lineare Strukturen nach den Regeln der Fischer-Projektionen dargestellt.
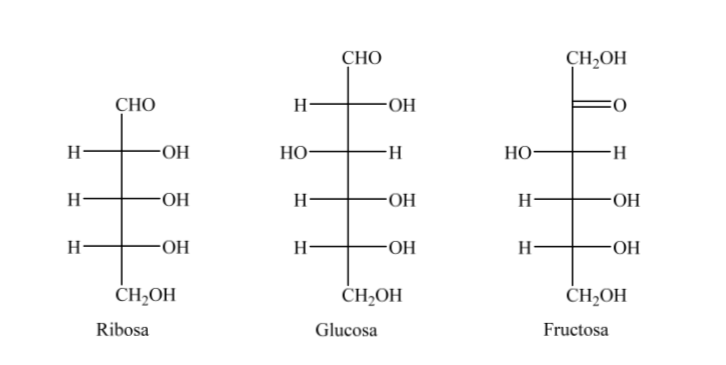
So können wir als Beispiel Ribose, Glucose und Fructose darstellen:
Wenn das Halbacetal gebildet wird, nimmt das Molekül eine gekrümmte Anordnung an, in der die Aldehydfunktion der Aldose an Kohlenstoff 1 in der Nähe des Hydroxyls an Kohlenstoff 5 angeordnet ist und an die Carbonyl-Doppelbindung anlagert, wodurch das sechsgliedrige zyklische Halbacetal (Pyranosidring) entsteht ).
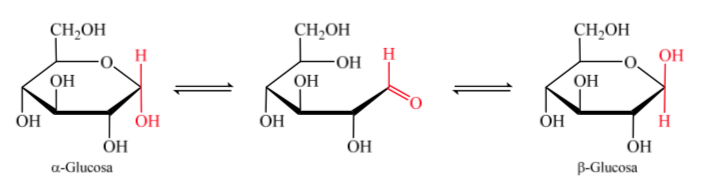
Das gleiche passiert mit Ketosen, aber in diesem Fall tritt die Halbacetalbindung zwischen Kohlenstoff 2 und Kohlenstoff 5 auf und bildet einen fünfgliedrigen Ring. (Furanosidring).
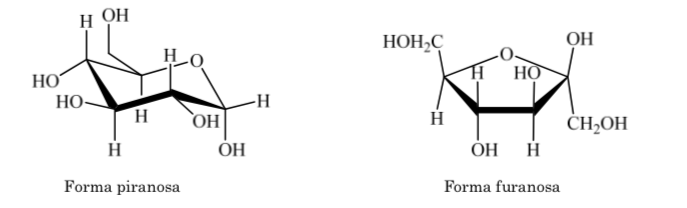
Es werden verschiedene Möglichkeiten zur Darstellung der Struktur von Glucose in zyklischer Form verwendet:
Anomere
Die Isomere von Monosacchariden mit mehr als 5 Kohlenstoffatomen, die eine Halbacetalbindung entwickelt haben, werden Anomere genannt, was es ihnen ermöglicht hat, eine zyklische Struktur anzunehmen und 2 verschiedene Positionen für die Hydroxylgruppe (α oder β) in dem neu geschaffenen Zentrum zu bestimmen. .
Der Pyranosering sollte dem von Cyclohexan ähnlich sein und in der Stuhlkonformation gegenüber der Twist-Boot-Konformation bevorzugt vorliegen, um Torsionsspannungen zu minimieren. Die Röntgenanalyse zeigt, dass diese Annahmen richtig sind.
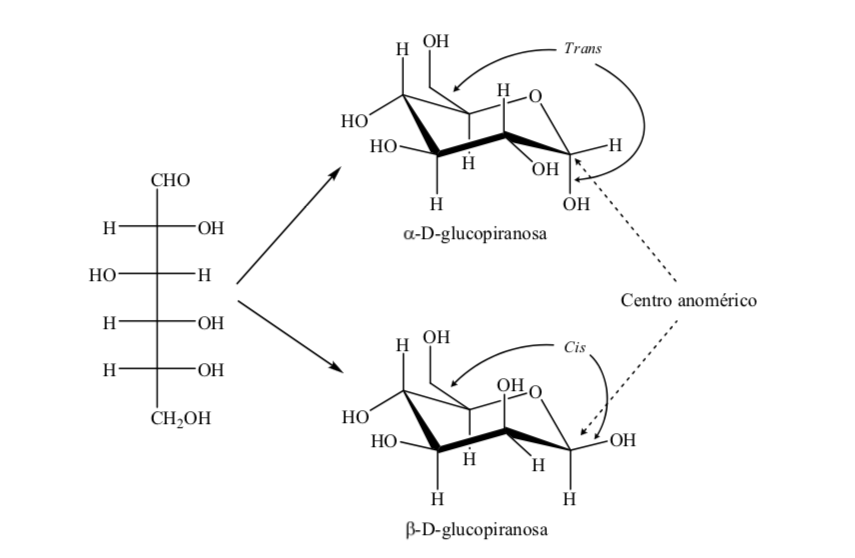
Die beiden Anomere werden entsprechend der Konfigurationsbeziehung zwischen dem anomeren Zentrum und dem anomeren Referenzatom als alpha (α)- oder beta (β)-Anomere bezeichnet. Das anomere Zentrum befindet sich auf dem Hemiacetal-Kohlenstoff und ist der anomere Kohlenstoff C-1, der durch Sauerstoff an C-5 gebunden ist, das an Hemiketal-Sauerstoff gebunden ist.
Es gibt jedoch zwei mögliche Sesselkonformationen für dasselbe D-(+)-Glucopyranose-Anomer.
Somit gibt es für β-D-(+)-Glucopyranose zwei mögliche Konformationen. Diejenige, die die voluminösesten Gruppen in Äquatorial (A) darstellt, wird stabiler sein.
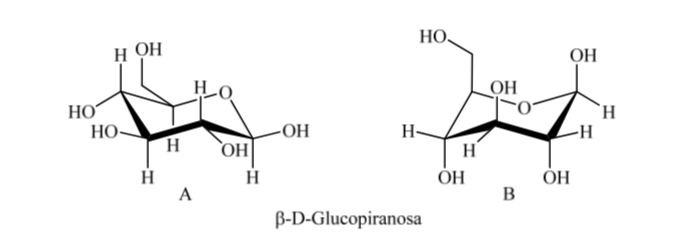
Was passiert mit α-D-(+)-Glucose? In diesem Fall ist die stabilste Konformation diejenige, bei der das OH am anomeren Kohlenstoff axial und die voluminösen Gruppen äquatorial sind (A).
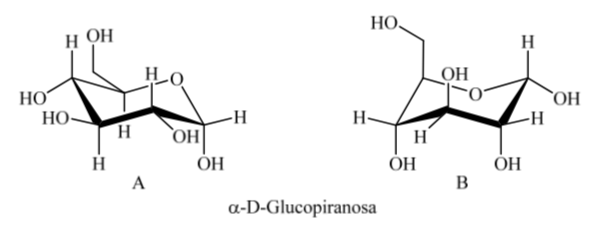
Interessanterweise kann von allen D-Aldohexosen nur β-D-(+)-Glucopyranose eine Konformation annehmen, in der jede ihrer großen Gruppen eine äquatoriale Position einnehmen kann. Dies steht im Einklang mit der Tatsache, dass β-D-(+)-Glucopyranose der Zucker mit dem höchsten Vorkommen in der Natur ist.
Elektronische Effekte
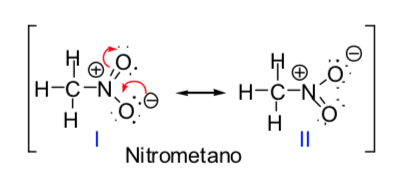
Einige organische Moleküle lassen sich durch zwei oder mehr Lewis-Strukturen darstellen, die sich nur in der Platzierung der Elektronen voneinander unterscheiden und als s-resonante Strukturen bezeichnet werden. In diesen Fällen weist das Molekül Eigenschaften beider Strukturen auf, und das Molekül wird tatsächlich als Resonanzhybrid der Resonanzstrukturen bezeichnet. Die Resonanzmethode ermöglicht es uns, auf qualitative Weise die Stabilisierung zu kennen, die ein Molekül durch elektronische Delokalisierung erreichen kann. Je größer die Zahl der Resonanzstrukturen ist, durch die eine chemische Spezies beschrieben werden kann, desto größer ist ihre Stabilität.
Das Konzept der Resonanzstrukturen kann bei der Beschreibung von Nitromethan angewendet werden, das durch die beiden unten angegebenen Lewis-Strukturen dargestellt werden kann:
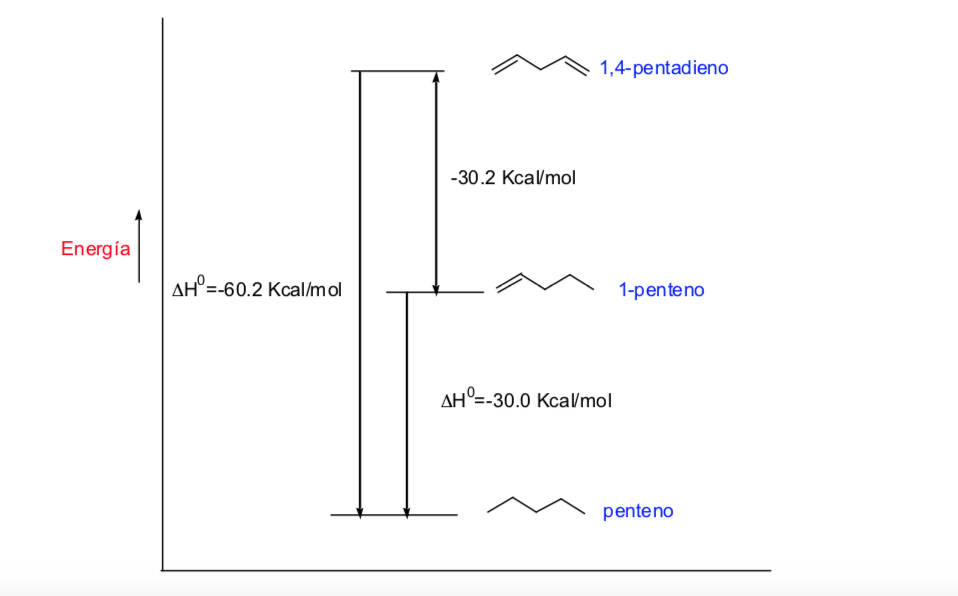
Konjugierte Bindungen und ihre Energie
Konformationsanalyse der Aromatizität
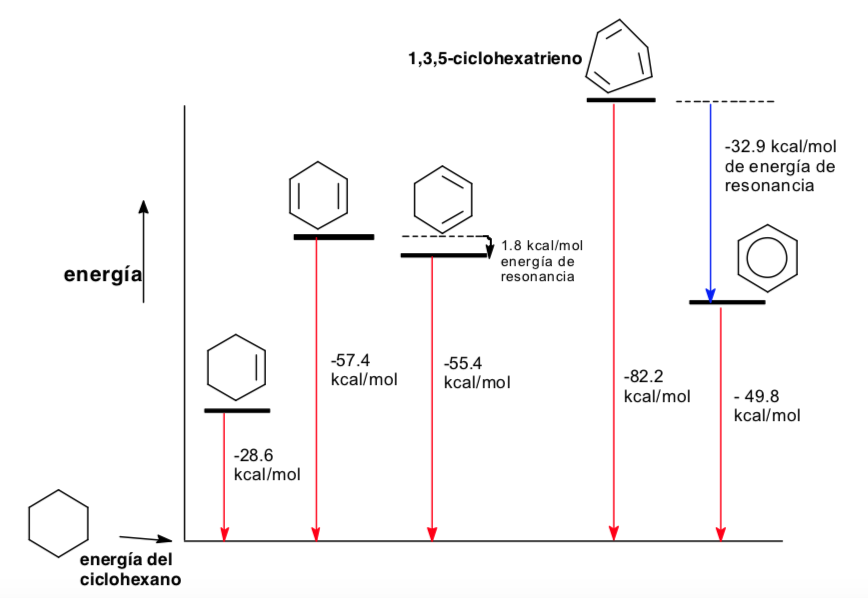 Thermodynamik und Konformationsanalyse (stereoelektronische Effekte)
Thermodynamik und Konformationsanalyse (stereoelektronische Effekte)
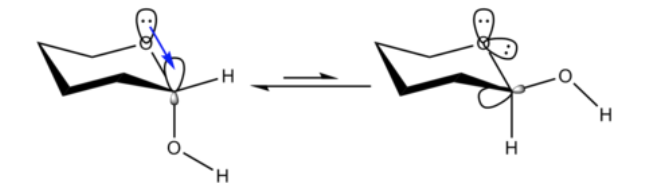
Es ist nicht unerwartet, dass der Methoxysubstituent an einem Cyclohexanring bevorzugt die äquatoriale Konformation annimmt.
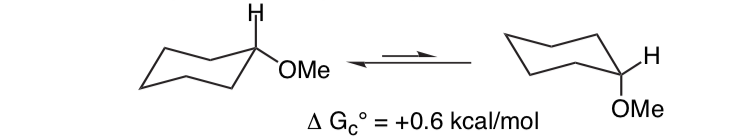
Unerwartet ist, dass das eng verwandte 2-Methoxytetrahydropyran ClHO die axiale Konformation bevorzugt:
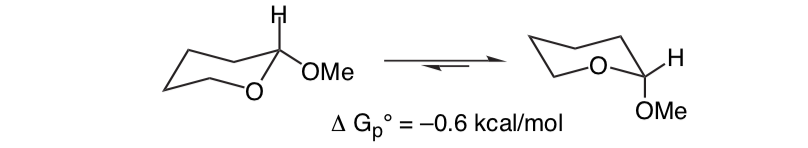
Dieser Effekt, der eine Stabilisierung des axialen O-Formers bereitstellt, der die inhärente sterische Vorspannung des Substituenten aufhebt, wird als anomerer Effekt bezeichnet.
Das Verhältnis der freien Energie zum anomeren Effekt wäre wie folgt:
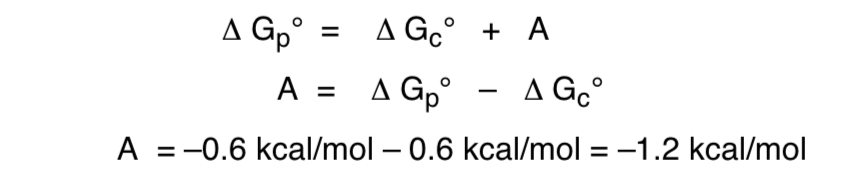
Empfohlene Quellen zur Erweiterung der Suche:
1) Juaristi E. „Grundlegende Konzepte der Orbitaltheorie“. CINVESTAV, Mexiko, 1988 Juaristi E. "Organische Physikochemie." CINVESTAV, Mexiko, 1994.
2) Neil SI „Physical Organic Chemistry“ Longman, Mailand, 1995.
3) March J., „Advanced Organic Chemistry“, John Wiley & Sons, New York, 1992 4) Jones RAY „Physical and Mechanistic Organic Chemistry“, 2nd. Ed Cambridge University Press, Cambridge, 1984.
5) Woodward RB und Hoffmann R. „Die Erhaltung der Orbitalsymmetrie“, Academic Press, New York, 1979.
6) Carpenter BK „Bestimmung organischer Reaktionsmechanismen“, John Wiley & Sons, New York, 1984.