Stéréochimie et analyse conformationnelle
La stéréochimie est la branche de la chimie qui traite des aspects tridimensionnels des molécules et de leur réactivité. La chimie organique ne peut être comprise sans tenir compte de la stéréochimie. Les systèmes biologiques sont hautement sélectifs et discriminent souvent les molécules avec de très petites différences stéréochimiques.
L'analyse conformationnelle fait partie de l'étude spatiale des molécules, c'est-à-dire de la stéréochimie.
CONSTITUTION, CONFIGURATION ET CONFORMATION
Les composés de même formule sont appelés isomères.
structure empirique mais différente.
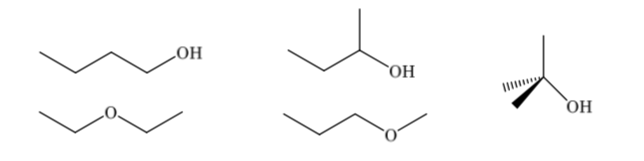
Les isomères constitutionnels diffèrent dans leur séquence de liaison, ils présentent une connectivité différente. Un composé de formule moléculaire C4H10O peut avoir différentes constitutions :
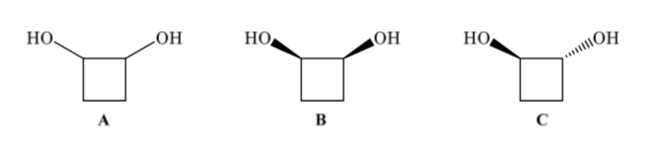
Les isomères de configuration ont la même connectivité mais diffèrent dans l'arrangement spatial des atomes. Le 1,2-cyclobutanediol (A) peut avoir deux isomères de configuration selon que les deux groupes OH sont du même côté (B) ou de côtés opposés (C)
Les isomères conformationnels ont la même constitution, la même configuration, mais ils diffèrent spatialement en ce qu'ils passent d'un isomère à l'autre par simple rotation d'une liaison. Les différentes formes que les molécules acquièrent à la suite de la rotation autour d'une seule liaison sont appelées conformations, dont chacune est un conformateur.
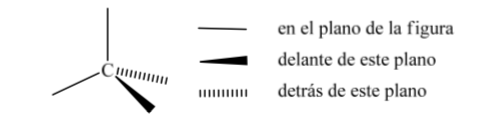
L'une des représentations les plus utilisées du tétraèdre de carbone est la représentation dite en perspective.
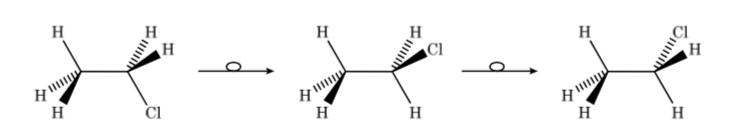
Ainsi, dans le cas du chloroéthane on peut représenter les différents conformères en perspective comme suit :
Les isomères de configuration et de conformation sont des stéréoisomères. Les stéréoisomères ont la même connectivité mais diffèrent par l'orientation de certains de leurs atomes dans l'espace. Ils présentent souvent des différences considérables dans leurs propriétés physiques, chimiques et biologiques.
CONFORMATION DANS LES MOLÉCULES ORGANIQUES ACYCLIQUES
Représentation des molécules organiques
Il existe plusieurs façons de représenter les molécules dans le plan.
Représentation en perspective ou chevalet
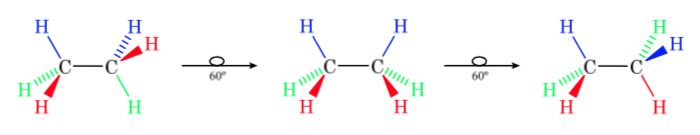
Projection de Newman
Dans une projection de Newman, deux atomes de carbone adjacents dans une molécule sont représentés à l'intérieur d'un cercle. À l'avant se trouve l'atome de carbone vu de face et derrière le cercle se trouve l'atome de carbone qui se chevauche. Les trois substituants de chaque carbone sortent du centre du cercle devant et derrière.
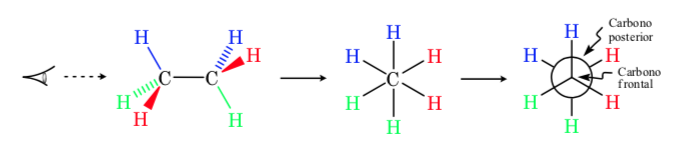
Représentation des pêcheurs
Dans la représentation de Fischer, un atome de carbone tétraédrique est représenté par le centre d'une croix et les substituants sont placés aux extrémités de telle sorte que les lignes verticales indiquent que les liaisons sont dirigées vers l'arrière du plan du papier et le horizontales vers l'avant. . La chaîne principale est disposée verticalement.
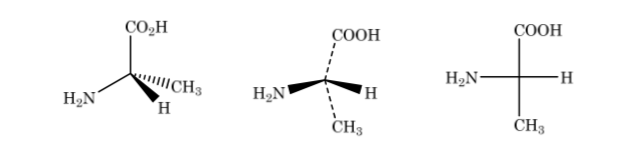
Comme indiqué ci-dessus, la représentation de l'acide 2-aminopropanoïque
Si le composé a des atomes de carbone différents, la chaîne carbonée est dessinée verticalement avec les substituants de chaque carbone horizontalement, en maintenant toujours la règle selon laquelle les liaisons verticales vont derrière le plan et les horizontales vers l'avant.
Conformations éthane
La liaison σ qui relie les atomes de carbone dans l'éthane est à symétrie cylindrique et permet une rotation libre autour d'elle. La rotation autour de la liaison C – C interconvertit les différentes conformations de l'éthane. L'étude de son comportement thermodynamique et cinétique est appelée analyse conformationnelle.
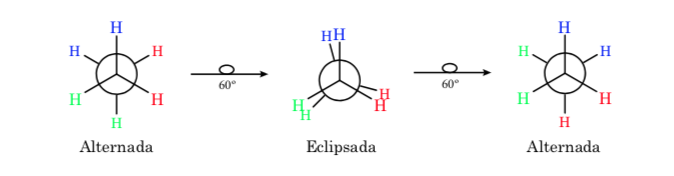
La première figure représente la molécule d'éthane où les atomes d'hydrogène sont aussi éloignés que possible avec une interaction minimale entre eux. C'est ce qu'on appelle la conformation alternée.
La seconde vient d'avoir fait un tour de 60o vers la liaison C–C et où les atomes d'hydrogène sont éclipsés.
Encore une fois, un virage de 60o vers la liaison C – C conduit à une conformation alternative.
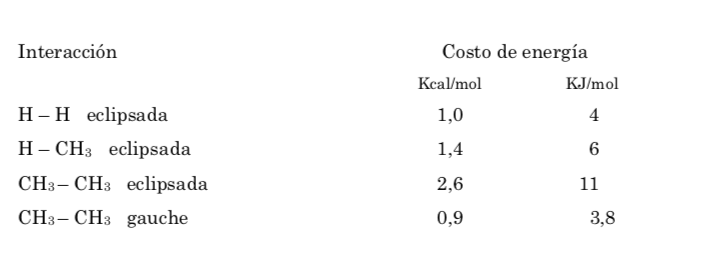
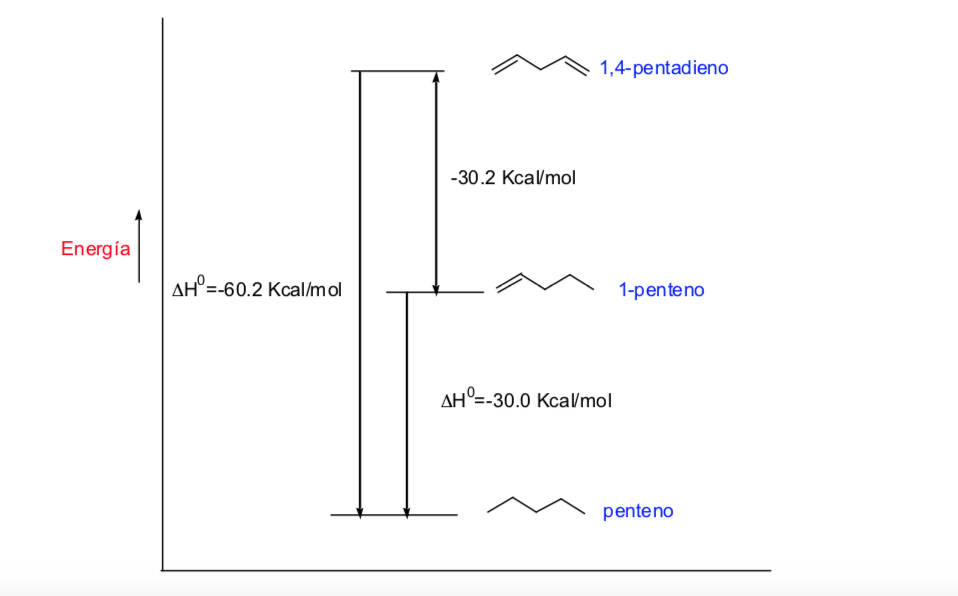
L'énergie potentielle de la molécule est minimale pour la conformation décalée, augmente avec la rotation et atteint un maximum pour la conformation éclipsée. La différence d'énergie ou barrière énergétique à franchir pour passer d'une conformation à une autre est de l'ordre de 3 kcal (voir dessin).
La plupart des molécules d'éthane existent naturellement dans la conformation la plus stable. Comme la barrière d'énergie n'est pas très élevée à température ambiante, le nombre de collisions avec une énergie suffisante est suffisamment grand pour que l'interconversion des conformateurs soit rapide. L'énergie nécessaire pour faire tourner la molécule autour de la liaison C – C est due à la contrainte de torsion.
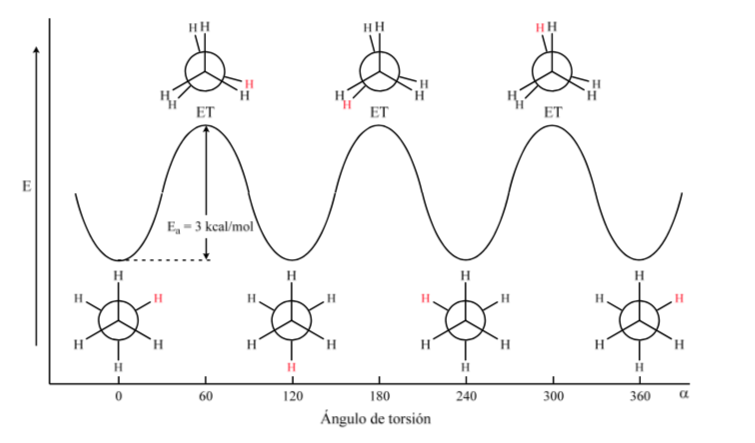
Le diagramme ci-dessus représente les changements d'énergie lors du passage d'une conformation à une autre lors de la rotation de la liaison simple C – C.
Lorsque les hydrogènes d'éthane seront remplacés par d'autres atomes ou groupements, les niveaux d'énergie des conformations vont changer et leur étude devra être menée au cas par cas.
conformations propane
Dans le cas de la molécule de propane, si on représente les projections de Newman selon l'une des liaisons C – C et qu'on fait tourner la liaison, on se retrouve, comme dans le cas de l'éthane, avec des conformations éclipsées et alternées.
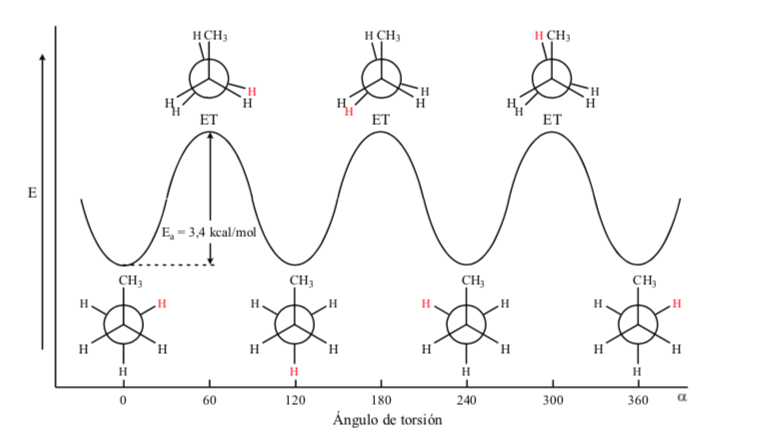
La barrière énergétique entre une forme alternée et une forme éclipsée est plus importante que dans le cas de l'éthane (3,4 kcal mol-1) car le groupement méthyle est plus grand que l'hydrogène et les interactions sont plus importantes. Les conformations décalées sont plus stables que les conformations éclipsées.
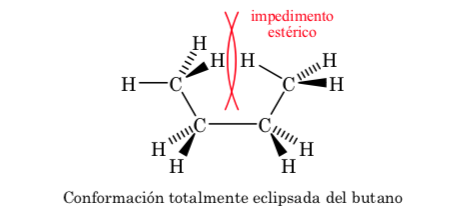
Conformations du n-butane
Si nous regardons la liaison centrale C – C, nous pouvons considérer le butane en le représentant dans Newman comme une molécule similaire à l'éthane dans laquelle deux atomes d'hydrogène ont été remplacés par deux groupes méthyle.
Comme dans l'éthane, les conformations alternées ont une énergie plus faible et sont plus stables que les conformations éclipsées : 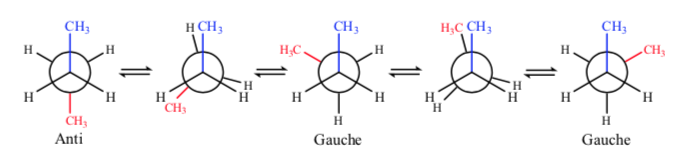
De toutes les conformations alternatives, celle avec les deux groupes méthyle dans la position la plus opposée possible (angle dièdre 180o) est appelée anti conformation et est la plus stable. Les deux autres conformations alternatives ont une énergie similaire l'une à l'autre et sont appelées conformations gauches où les groupes méthyle se rencontrent à un angle dièdre de 60o l'un par rapport à l'autre. Deux de ces conformations existent en fonction de la rotation autour de la liaison C – C.
Parmi les trois conformations éclipsées, nous mettons d'abord en évidence celle où les deux groupes méthyle sont éclipsés, ce qui génère une plus grande interaction et donc moins de stabilité. Les deux autres conformations éclipsées ont un contenu énergétique inférieur et sont un peu plus stables. Voir le diagramme énergétique.
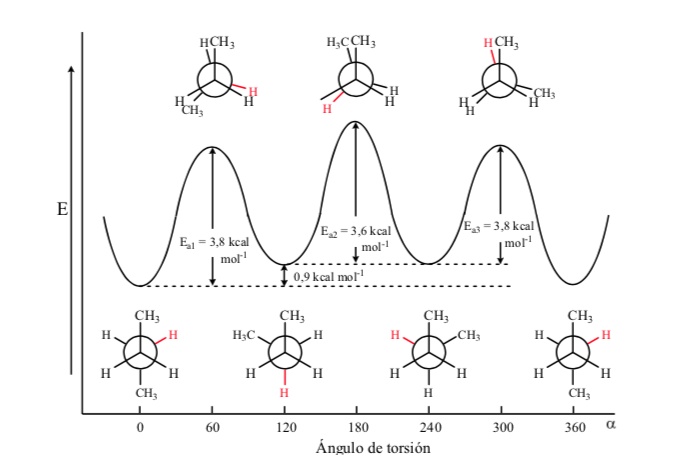
Les collisions fournissent l'énergie nécessaire pour surmonter la barrière énergétique d'activation.
CONFORMATION DANS LES MOLÉCULES ORGANIQUES CYCLIQUES
Les cycloalcanes sont soumis à une déformation cyclique appelée déformation Bayer en raison de leur structure cyclique. Cette tension est le résultat de trois facteurs :
- Tension de liaison
- Éclipse d'atomes et de liaisons - Déformation stérique
A. Bond Strain dans les cycloalcanes est dû à la différence de chevauchement orbital par rapport à un alcane acyclique. Plus la valeur de l'angle C–C–C est proche du tétraèdre (109,5o), plus le chevauchement est important et plus la tension de liaison est faible.
L'effet stérique est dû à l'interaction des atomes dans l'espace. Pour éviter que l'interaction entre les atomes soit élevée, la molécule acquiert une conformation préférentielle, c'est la plus stable. Pour réduire les contraintes et ainsi atteindre la stabilité, la conformation préférée sera celle dans laquelle les groupes volumineux sont aussi éloignés que possible.
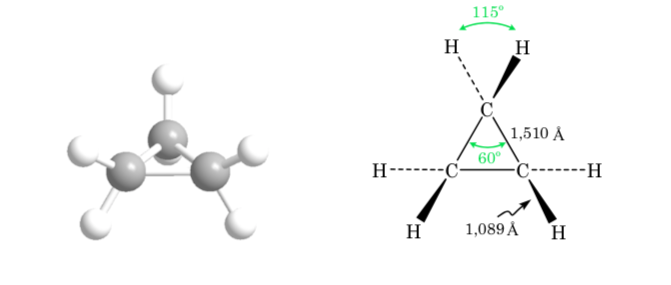
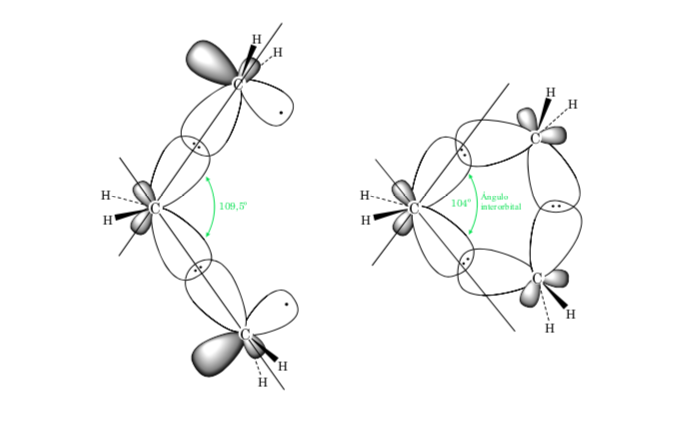
CONFORMATION EN CYCLES DE TROIS, QUATRE ET CINQ ATOMES DE CARBONE
cyclopropane
L'écart de l'angle de liaison du cycle à trois chaînons par rapport à l'angle correspondant à l'hybridation sp3 est important, de sorte que le cyclopropane a une déformation angulaire très élevée.
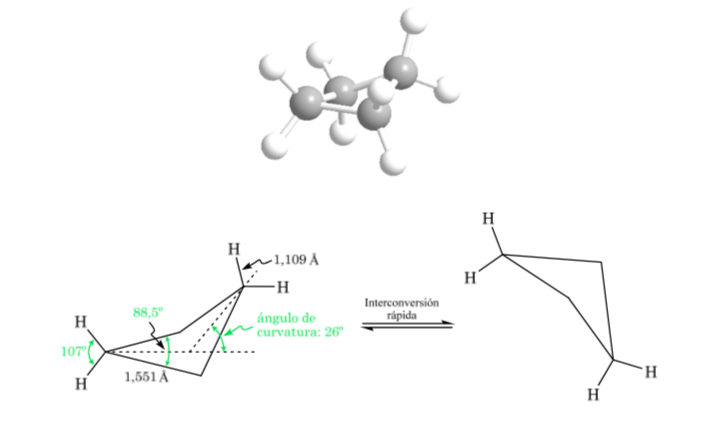
Cyclobutane : conformation papillon
La molécule a une structure légèrement déformée. Les liaisons C–C sont moins courbées et leur réactivité est moindre que dans le cas du cyclopropane. L'interconversion entre les différentes conformations est rapide.
Cyclopentane : Conformation sur
Le cyclopentane, s'il était plan, aurait une contrainte d'éclipse élevée, due à dix interactions H – H éclipsées, entraînant un repliement de l'anneau. Le pliage libère les contraintes de torsion. Le cyclopentane ne présente pas la réactivité des cycles à trois et quatre chaînons.
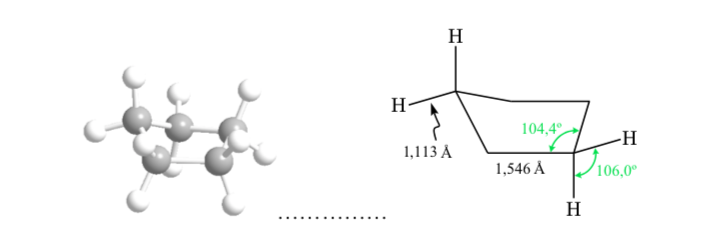
ANALYSE CONFORMATIONNELLE DES CYCLOHEXANES : Conformation de la chaise
Si le cyclohexane avait une structure plane, il aurait un angle de liaison de 120o. Un carbone hybride sp3 sans contrainte a un angle tétraédrique de 109,5o, ce qui amène le cyclohexane à adopter une conformation non plane et plus stable : la conformation de la chaise.
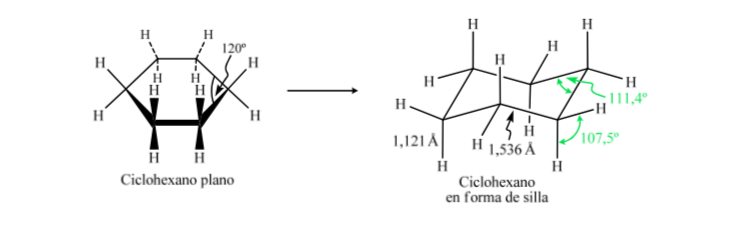
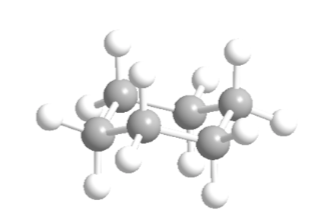
Le cyclohexane en conformation chaise a 6 atomes d'hydrogène axiaux et 6 hydrogènes équatoriaux. Les hydrogènes axiaux sont dirigés vers le haut et vers le bas de l'anneau, tandis que les hydrogènes équatoriaux sont dirigés hors de l'anneau.
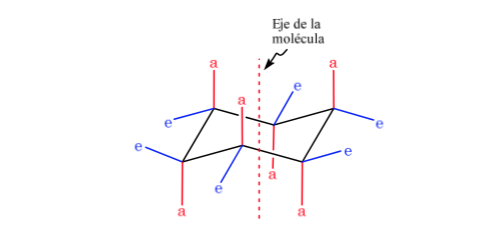
Le cyclohexane en conformation chaise est susceptible de modifier sa conformation par une autre chaise de stabilité égale. Ce phénomène est appelé interconversion de deux formes de chaise.
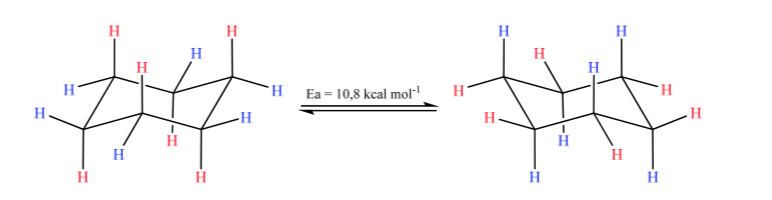
En regardant de près l'interconversion, on observe que la liaison axiale C – H devient équatoriale et vice versa, l'équatoriale devient axiale.
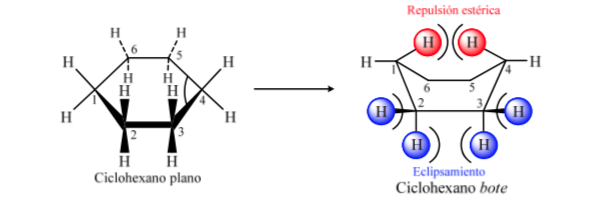
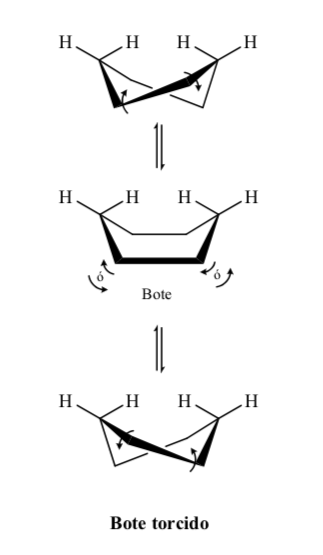
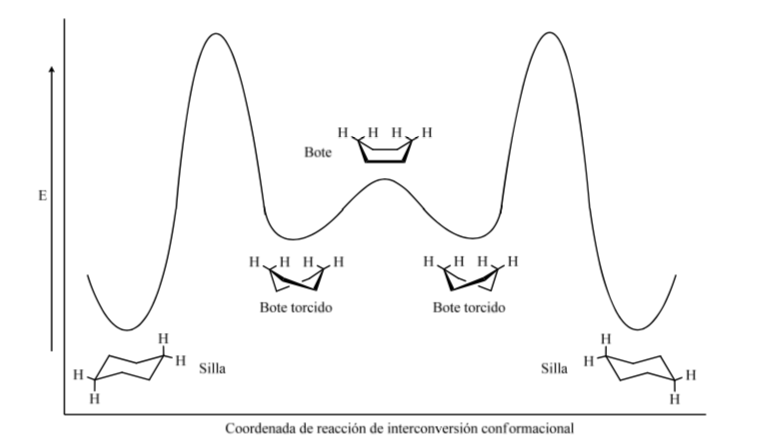
Niveaux énergétiques des conformères du cyclohexane :
Si nous observons une conformation de chaise du cyclohexane telle que l'atome C-2 chevauche l'atome C-3 et l'atome C-6 chevauche le C-5, nous pouvons dessiner une projection de Newman du cyclohexane :
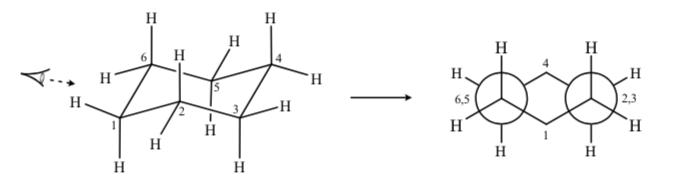
CYCLOHEXANES SUBSTITUÉS
Si l'on considère le méthylcyclohexane, on peut proposer deux structures qui le représentent selon que le groupement méthyle est en position axiale ou équatoriale.
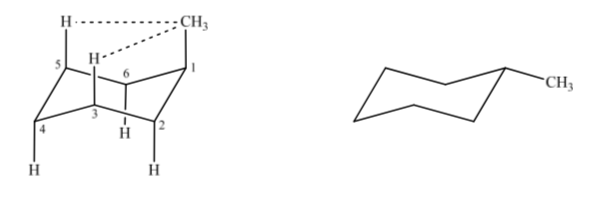
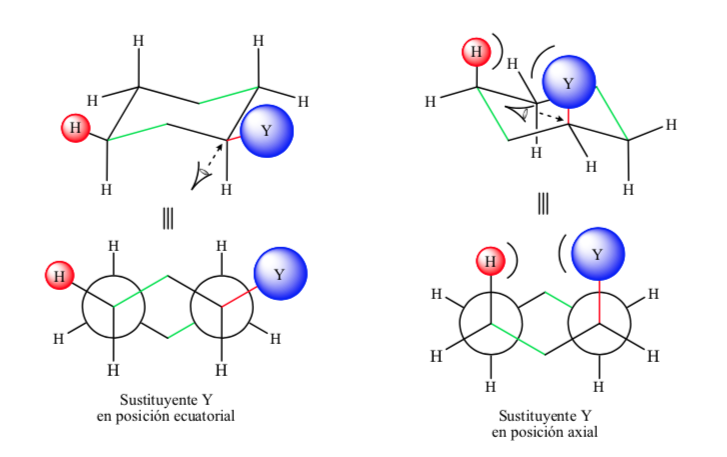
Si le substituant non hydrogène est en position axiale, des interactions avec les hydrogènes en position 3 et 5 du cycle se produisent en raison de la proximité spatiale. S'il est en position équatoriale, le substituant est dirigé hors du cycle et les interactions sont plus petites. Comme prévu, la conformation avec le substituant équatorial s'avère être environ 1,8 kcal plus stable que si le substituant est en position axiale. Ainsi on dit qu'un substituant en position axiale présente une interaction 1,3-diaxiale qui le rend moins stable qu'en position équatoriale.
La figure suivante représente le Newman les deux conformations d'un cyclohexane substitué avec à la fois le substituant dans les positions équatoriale et axiale.
Cyclohexanes disubstitués
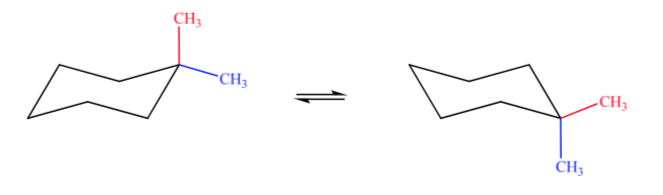
A. 1,1-diméthylcyclohexane B. 1,2-diméthylcyclohexane C. 1,3-diméthylcyclohexane D. 1,4-diméthylcyclohexane
Dans le cas A, un groupe méthyle sera en position axiale et l'autre en position équatoriale, donc les deux conformations possibles seront également stables.
Dans chacun des cas restants on peut représenter deux structures différentes selon que les deux méthyles sont en cis (dirigés vers le même côté du plan) ou en trans (dirigés vers des côtés opposés).
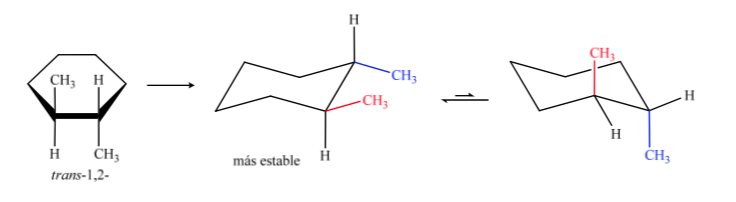
En B, l'isomère cis doit avoir les deux méthyles du même côté du plan central, donc un méthyle sera axial et l'autre équatorial.
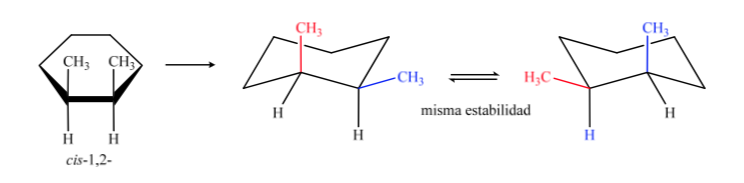
L'isomère trans est celui avec les deux méthyles faisant face à des côtés opposés, il présentera donc les deux méthyles en position axiale ou les deux en position équatoriale. La conformation que les deux présentent en équatorial est plus stable qu'en axial, on peut donc dire que l'isomère trans-1,2-diméthylcyclohexane est plus stable que l'isomère cis-1,2-diméthylcyclohexane.
Dans le cas du 1,3-diméthylcyclohexane on peut représenter :
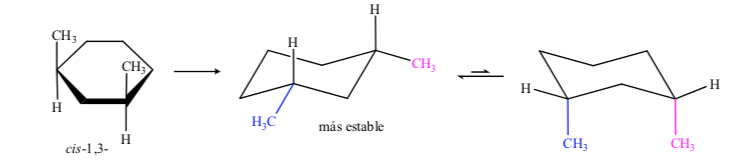
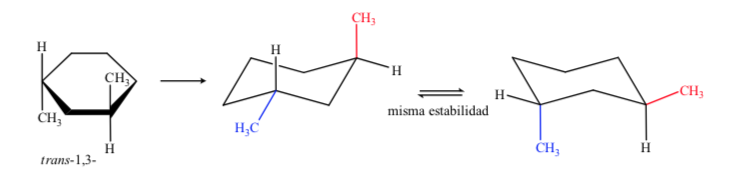
On en conclut que l'isomère cis, qui présente les deux substituants en équatorial, est plus stable que le trans, qui aura toujours un méthyle en axial et un autre en équatorial.
Dans le cas D, 1,4-diméthylcyclohexane on aura :
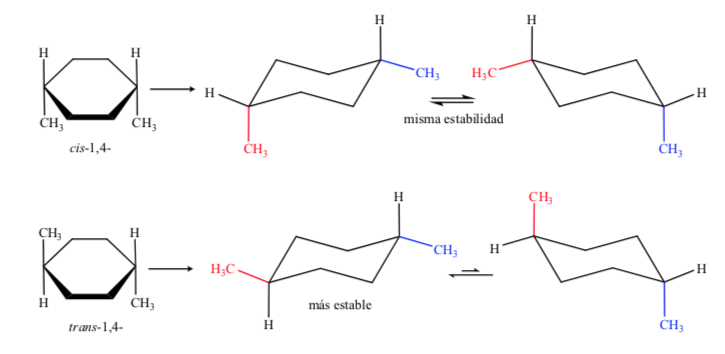
Dans ce cas, l'isomère trans est plus stable car les deux méthyles sont disposés en équatorial.
Lorsqu'il s'agit de cyclohexanes disubstitués avec différents groupes, l'isomère le plus stable sera celui avec le plus grand groupe équatorial.
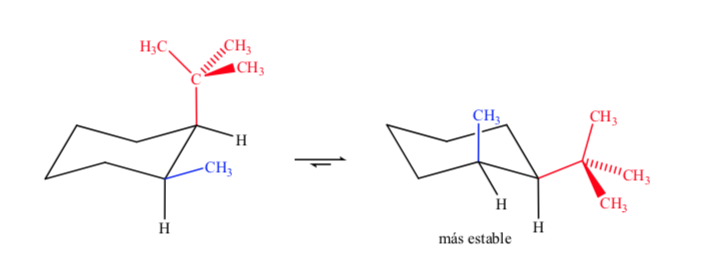
Enfin, dans le cas de cyclohexanes polysubstitués ayant des substituants différents, la conformation préférée sera celle comportant le plus grand nombre de groupements volumineux en position équatoriale.
CONFORMATION EN HÉTÉROCYCLES À SIX MEMBRES :
EFFET ANOMÈRE
En chimie organique , l' effet anomérique ou effet Edward-Lemieux est un effet stéréoélectronique qui décrit la tendance des substituants hétéroatomiques adjacents à un hétéroatome dans un cycle cyclohexane à préférer l'orientation axiale plutôt que l'orientation équatoriale moins couverte, ce qui serait attendu. considérations stériques. Cet effet a été observé à l'origine dans les anneaux de pyranose par JT Edward en 1955; à cette époque, N.-J. Chii et Raymond U. Lemieux ont commencé à étudier l'équilibre d'anomérisation de dérivés entièrement acétylés de certaines aldohexopyranoses. Le terme "effet anomérique" a été introduit en 1958.
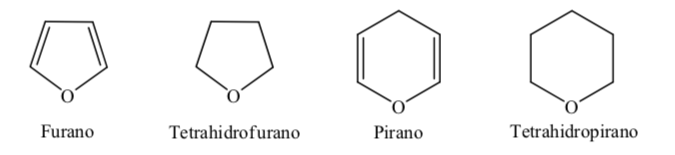
Certains des hétérocycles à cinq et six chaînons les plus courants dans les processus biologiques sont:
A. Hétérocycles oxygénés :
B. Hétérocycles azotés :
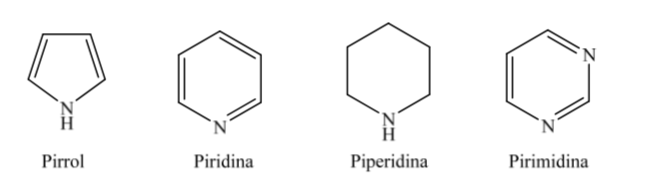
En ce qui concerne les hétérocycles entièrement hydrogénés à cinq et six membres tels que le tétrahydrofurane et le tétrahydropyrane, la conformation la plus stable qu'ils présentent est similaire à celle du cyclopentane et du cyclohexane respectivement, c'est-à-dire la conformation sur ou la conformation chaise.
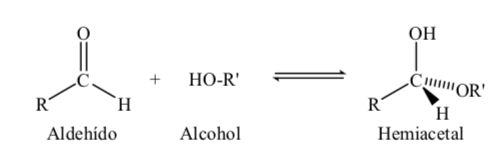
Les sucres à 5 et 6 atomes de carbone acquièrent une structure cyclique lorsqu'une liaison hémiacétal est formée par réaction du carbonyle (sucre aldéhyde ou cétone) avec un groupe hydroxyle.
La réaction de formation de l'hémiacétal peut être schématisée comme suit :
Pour leur étude, les sucres sont représentés par des structures linéaires suivant les règles des projections de Fischer.
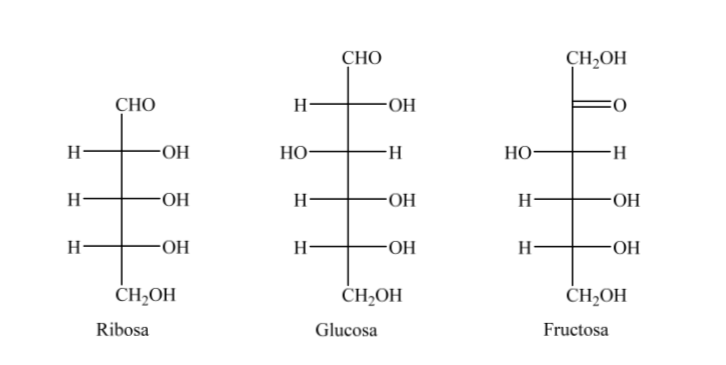
Ainsi, à titre d'exemple, on peut représenter le ribose, le glucose et le fructose :
Lorsque l'hémiacétal est formé, la molécule acquiert une disposition courbe dans laquelle la fonction aldéhyde de l'aldose sur le carbone 1 est située à proximité de l'hydroxyle sur le carbone 5, s'ajoutant à la double liaison carbonyle, générant l'hémiacétal cyclique à six chaînons (cycle pyranoside ).
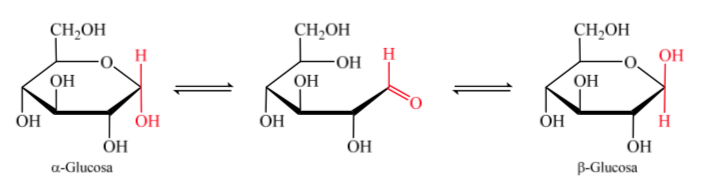
La même chose se produit avec les cétoses, mais dans ce cas, la liaison hémiacétal se produit entre le carbone 2 et le carbone 5, formant un cycle à cinq chaînons. (anneau furanoside).
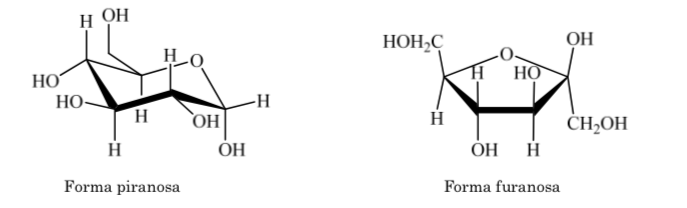
Différentes manières de représenter la structure du glucose sous forme cyclique sont utilisées :
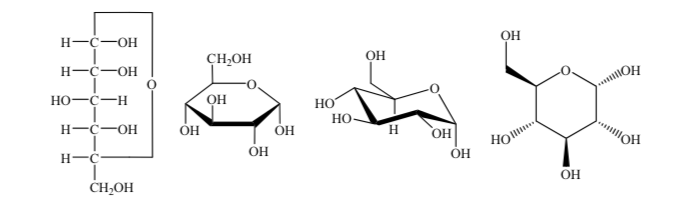
anomères
Les isomères des monosaccharides de plus de 5 atomes de carbone qui ont développé une liaison hémiacétal sont appelés anomères, ce qui leur a permis de prendre une structure cyclique et de déterminer 2 positions différentes pour le groupe hydroxyle (α ou β) dans le nouveau centre créé. .
L'anneau de pyranose doit être similaire à celui du cyclohexane et exister dans la conformation chaise de préférence à la conformation bateau torsadé pour minimiser les contraintes de torsion. L'analyse aux rayons X montre que ces hypothèses sont correctes.
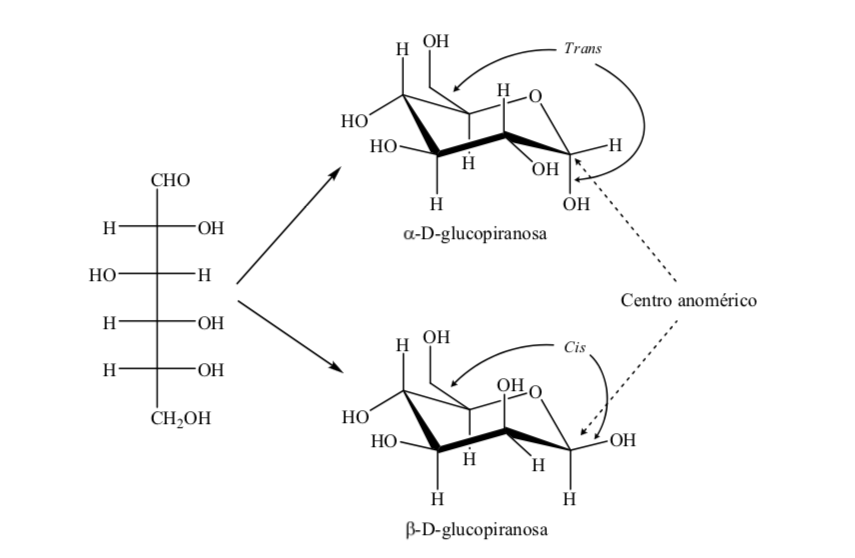
Les deux anomères sont désignés anomères alpha (α) ou bêta (β), selon la relation de configuration entre le centre anomérique et l'atome de référence anomérique. Le centre anomérique se trouve sur le carbone hémiacétal et est le carbone anomérique C-1, qui est lié par l'oxygène à C-5, qui est lié à l'oxygène hémicétal.
Il existe cependant deux conformations de chaise possibles pour le même anomère D-(+)-glucopyranose.
Ainsi, pour le β-D-(+)-glucopyranose il existe deux conformations possibles. Celui qui présente les groupes les plus volumineux en équatorial (A) sera le plus stable.
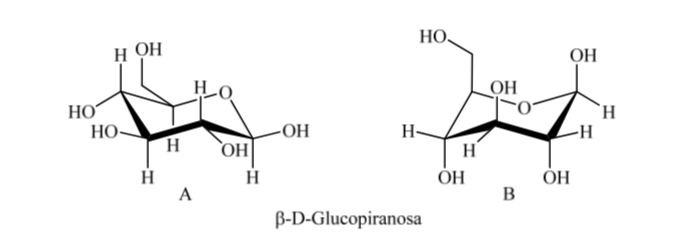
Que se passe-t-il pour l'α-D-(+)-glucose ? Dans ce cas, la conformation la plus stable est celle dans laquelle l'OH sur le carbone anomérique est axial et les groupes volumineux sont équatoriaux (A).
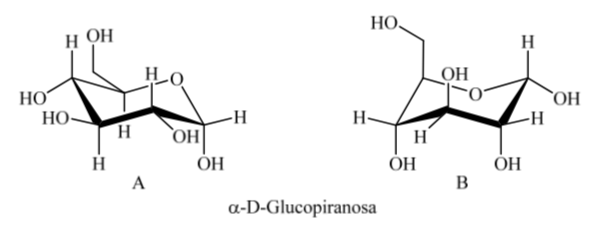
Il est intéressant de noter que de tous les D-aldohexoses, seul le β-D-(+)-glucopyranose peut prendre une conformation dans laquelle chacun de ses grands groupes peut occuper une position équatoriale. Ceci est cohérent avec le fait que le β-D-(+)-glucopyranose est le sucre le plus présent dans la nature.
effets électroniques
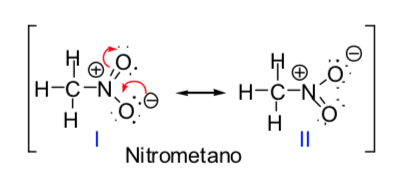
Certaines molécules organiques peuvent être représentées par deux ou plusieurs structures de Lewis, qui ne diffèrent les unes des autres que par le placement des électrons et sont appelées structures résonnantes s. Dans ces cas, la molécule aura des caractéristiques des deux structures, et on dit en fait que la molécule est un hybride de résonance des structures résonnantes. La méthode de résonance permet de connaître, de manière qualitative, la stabilisation que peut atteindre une molécule par délocalisation électronique. Plus le nombre de structures résonnantes par lesquelles une espèce chimique peut être décrite est grand, plus sa stabilité est grande.
Le concept de structures résonnantes peut être appliqué dans la description du nitrométhane, qui peut être représenté par les deux structures de Lewis données ci-dessous :
Les liens conjugués et leur énergie
Analyse conformationnelle de l'aromaticité
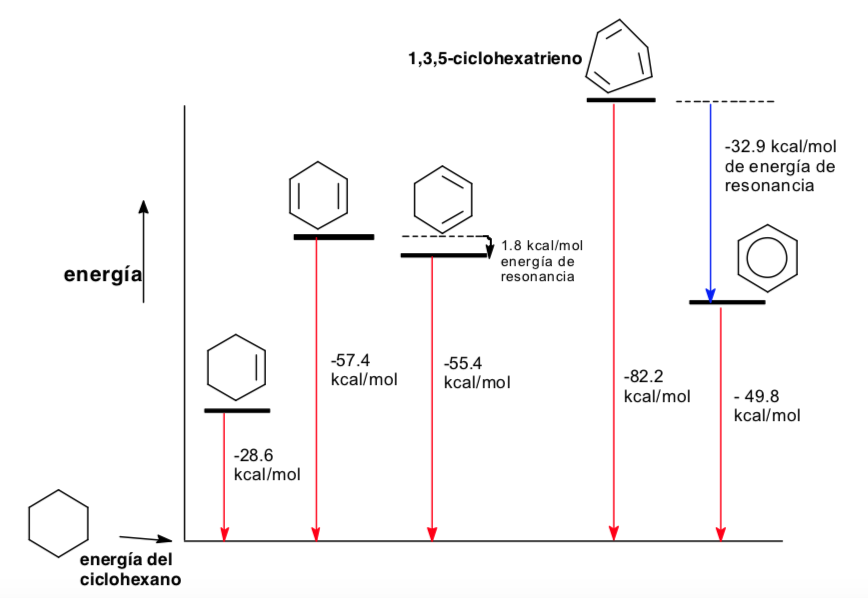 Thermodynamique et analyse conformationnelle (effets stéréoélectroniques)
Thermodynamique et analyse conformationnelle (effets stéréoélectroniques)
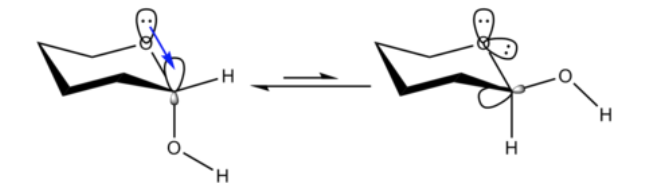
Il n'est pas surprenant que le substituant méthoxy sur un cycle cyclohexane préfère adopter la conformation équatoriale.
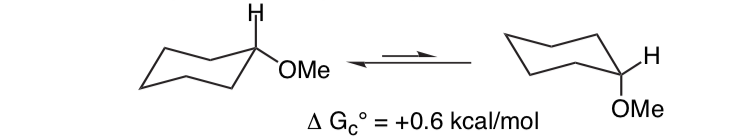
Ce qui est inattendu, c'est que le 2-méthoxytétrahydropyrane ClHO, étroitement apparenté, préfère la conformation axiale :
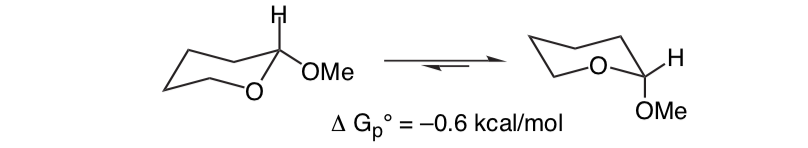
Cet effet qui assure la stabilisation de la forme en O axiale qui abroge la polarisation stérique inhérente du substituant est appelé l'effet anomérique.
La relation de l'énergie libre par rapport à l'effet anomérique serait la suivante :
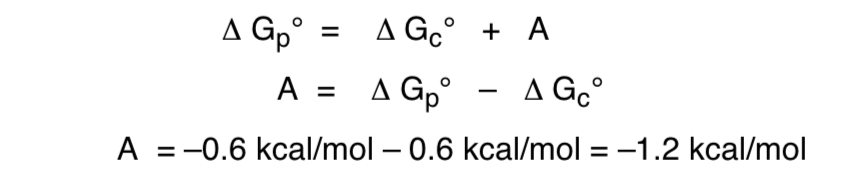
Sources recommandées pour élargir la recherche :
1) Juaristi E. "Concepts de base de la théorie orbitale". CINVESTAV, Mexique, 1988 Juaristi E. "Physicochimie organique." CINVESTAV, Mexique, 1994.
2) Neil SI "Chimie organique physique" Longman, Milan, 1995.
3) March J., "Advanced Organic Chemistry" John Wiley & Sons, New York, 1992 4) Jones RAY "Physical and Mechanistic Organic Chemistry", 2nd. Ed Cambridge University Press, Cambridge, 1984.
5) Woodward RB et Hoffmann R. "La conservation de la symétrie orbitale", Academic Press, New York, 1979.
6) Carpenter BK "Détermination des mécanismes de réaction organique", John Wiley & Sons, New York, 1984 .