La réaction des cétones [1] avec les peracides [2] produit des esters [3] . L'oxygène du peracide est inséré entre le carbone carbonyle et le carbone alpha de la cétone. Cette réaction a été décrite par Adolf von Baeyer et Victor Villiger en 1899. 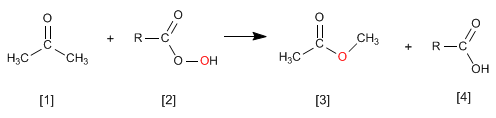
Les esters cycliques (lactones) sont obtenus à partir de cétones cycliques. 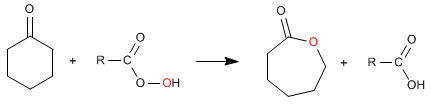
Le mécanisme de Baeyer Villiger commence par l'attaque nucléophile du peracide sur le carbonyle, suivie de la migration du substituant du groupe carbonyle vers l'oxygène du peracide.
Étape 1. Ajout du peracide au carbonyle 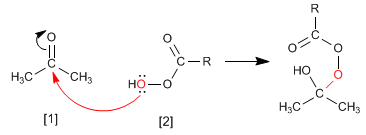
Étape 2. Migration du substituant du carbone carbonyle vers l'oxygène (rouge) 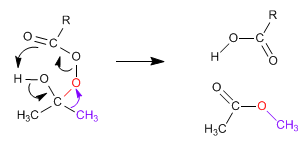
Lorsque la cétone a deux substituants différents, le plus substitué migre mieux. Il existe un ordre de migration qui nous aide à décider quel substituant rejoindra l'oxygène du peracide.
Ordre de migration : H> carbone tertiaire> cyclohexyle> carbone secondaire » phényle> carbone primaire> méthyle 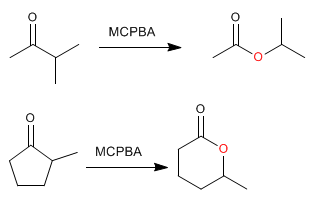
Comme on peut le voir dans l'ordre de migration, le groupe qui migre le mieux, en raison de sa petite taille, est l'hydrogène; par conséquent, lors du traitement des aldéhydes avec des peracides, une migration d'hydrogène se produit, formant des acides carboxyliques. 
Le MCPBA (acide méta-chloroperoxybenzoïque) est un peracide largement utilisé dans l'époxydation des alcènes et également dans Baeyer-Villger. La formule MCPBA est présentée ci-dessous. 