 ¿Te cuesta entender la Química Orgánica?
¿Te cuesta entender la Química Orgánica?
Cursos de Química Orgánica para los Grados en Química, Ingeniería Química, Biotecnología y Farmacia de las Universidades españolas.
Material específico para cada Universidad con teoría, ejercicios y exámenes resueltos en vídeo, creado por Germán Fernández. Soporte para dudas por WhatsApp. .
Más información en www.foroquimico.com
Si prefieres un curso de química orgánica tanto básica como avanzada te invito a acceder al canal: https://www.youtube.com/channel/UC_RiUaA2326jO9XozAA4q2g , en el que encontrarás más de 750 vídeos de teoría y ejercicios.
ESTEREOQUÍMICA II
- Detalles
- Germán Fernández
- ESTEREOQUÍMICA II
- Visto: 8803
La determinación de la estructura de una molécula orgánica comienza con el análisis de los elementos que contiene y la proporción de los mismos, lo cual suele realizarse mediante combustión. La determinación de la masa molecular, que antes se realizaba mediante el descenso crioscópico, ahora utiliza la técnica de espectrometría de masas de alta resolución.
- Detalles
- Germán Fernández
- ESTEREOQUÍMICA II
- Visto: 12230
Se llaman conformaciones a las diferentes disposiciones espaciales que puede adoptar una molécula y que se interconvierten a temperatura ambiente por rotación
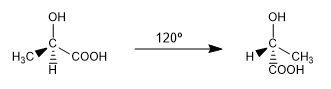
Son dos de las infinitas conformaciones que se pueden dibujar del ác. 2-hidroxipropanoico. A temperatura ambiente la molécula está girando continuamente pasando por todas las posibles conformaciones.
Ahora veamos las dos conformaciones más características del etano, la conformación alternada y la eclipsada.
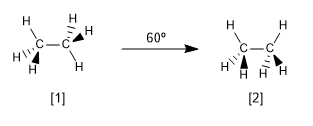
[1 ] Conformación alternada del etano
[2 ] Conformación eclipsada del etano
- Detalles
- Germán Fernández
- ESTEREOQUÍMICA II
- Visto: 8466
Una molécula quiral es aquella que no es superponible con su imagen especular. La simetría provoca que las moléculas pierdan su quiralidad. Así, la presencia de planos de simetría, centros de inversión o ejes alternantes dan lugar a moléculas aquirales.
a) Eje de simetría (Cn)
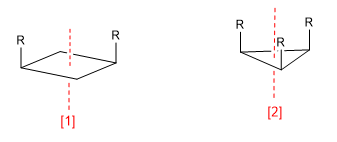
[1 ] Eje de simetría (C2)
[2 ] Eje de simetría (C3)
Un eje de simetría de orden m deja a la molécula en una configuración indistinguible de la inicial al girar 360/m grados.
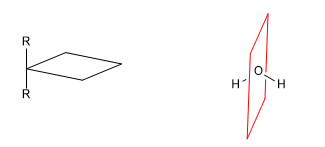
b) Plano de reflexión (s): Divide a la molécula en dos partes iguales. Todo átomo de la molécula que se encuentre a un lado del plano debe tener su simétrico al otro lado.
Leer más: Elementos de simetría que conducen a moléculas aquirales
- Detalles
- Germán Fernández
- ESTEREOQUÍMICA II
- Visto: 8583
La quiralidad es sinónimo de asimetría, los objetos quirales se caracterizan por la ausencia de simetría, obsérvese las manos.
Leer más: Elementos de asimetría que conducen a moléculas quirales
- Detalles
- Germán Fernández
- ESTEREOQUÍMICA II
- Visto: 7153
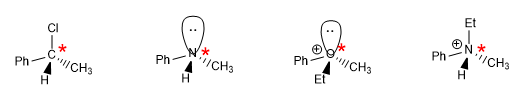
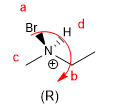
Las reglas para dar configuración absoluta a un centro estereogénico son las siguientes:
- Detalles
- Germán Fernández
- ESTEREOQUÍMICA II
- Visto: 8018
En moléculas cuyo elemento de quiralidad es un eje daremos la notación Ra / Sa, (el subíndice "a" hace referencia a axial), mediante el método de proyección de Fischer. También puede utilizarse el método del tetraedro.
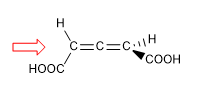
1. Para que la molécula tenga eje de quiralidad es necesario que los dos grupos de cada lado sean diferentes entre sí. En este ejemplo los grupos son diferentes (-H y -COOH) y la molécula presenta eje de quiralidad.
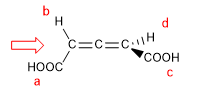
- Detalles
- Germán Fernández
- ESTEREOQUÍMICA II
- Visto: 7706
Se trata de moléculas que presentan una zona plana (fenilo), con un puente que une sus extremos bien por la cara de arriba o la de abajo.
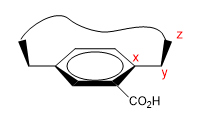
1. Asignamos nombres a ciertos átomos como se muestra en la imagen. "z" es el primer átomo que está fuera del plano. De x parten dos cadenas, a las que debemos dar prioridad por número atómico.
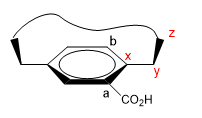
2. Proyectamos el enlace x-y, situándonos en la posición de la flecha.
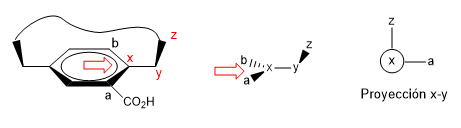
- Detalles
- Germán Fernández
- ESTEREOQUÍMICA II
- Visto: 9781
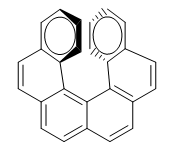
La repulsión entre los anillos impide que la molécula pueda disponerse en el plano. De manera que uno de los anillos se dobla hacia nosotros y el otro al fondo. En un enantiómero el anillo de la derecha se dobla hacia nosotros y en el otro al fondo.
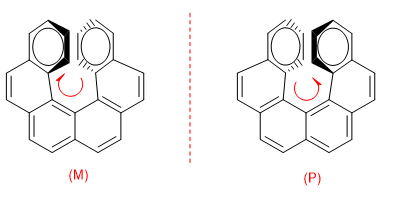
Para distinguir ambos enantiómeros se hace un giro desde el anillo que va al fondo hasta el que viene hacia nosotros, si este giro es en el sentido de las agujas el enantiómero es M, si el giro es en sentido opuesto el enantiómero es P.