STÉRÉOCHIMIE II
- Détails
- Germán Fernández
- STÉRÉOCHIMIE II
- Affichages : 2067
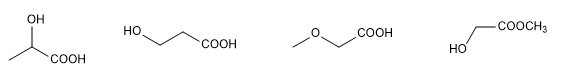
La détermination de la structure d'une molécule organique commence par l'analyse des éléments qu'elle contient et de leur proportion, qui se fait généralement par combustion. La détermination de la masse moléculaire, réalisée auparavant par descente cryoscopique, utilise désormais la technique de spectrométrie de masse à haute résolution.
- Détails
- Germán Fernández
- STÉRÉOCHIMIE II
- Affichages : 2587
Les différentes dispositions spatiales que peut adopter une molécule et qui s'interconvertissent à température ambiante par rotation sont appelées conformations.
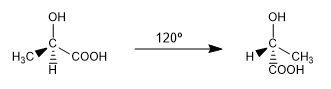
Ce sont deux des conformations infinies qui peuvent être tirées de l'ac. 2-hydroxypropanoïque. A température ambiante, la molécule est en rotation continue à travers toutes les conformations possibles.
Examinons maintenant les deux conformations les plus caractéristiques de l'éthane, les conformations alternées et éclipsées.
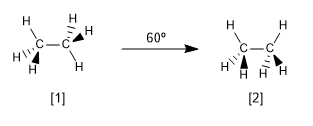
[1 ] Conformation alternative de l'éthane
[2] Conformation éclipsée de l'éthane
- Détails
- Germán Fernández
- STÉRÉOCHIMIE II
- Affichages : 3800
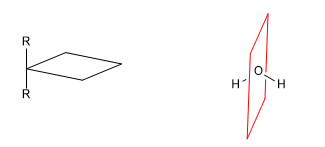
Une molécule chirale est une molécule non superposable à son image miroir. La symétrie fait perdre aux molécules leur chiralité. Ainsi, la présence de plans de symétrie, de centres d'inversion ou d'axes alternés donne naissance à des molécules achirales.
a) Axe de symétrie (C n )
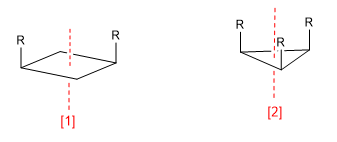
[1 ] Axe de symétrie (C 2 )
[2 ] Axe de symétrie (C 3 )
Un axe de symétrie d'ordre m laisse la molécule dans une configuration indiscernable de la configuration initiale lors d'une rotation de 360/m degrés.
b) Plan de réflexion ( s ) : Divise la molécule en deux parties égales. Chaque atome de la molécule qui se trouve d'un côté du plan doit avoir son miroir de l'autre côté.
Lire la suite : Éléments de symétrie conduisant à des molécules achirales
- Détails
- Germán Fernández
- STÉRÉOCHIMIE II
- Affichages : 3129
La chiralité est synonyme d'asymétrie, les objets chiraux se caractérisent par l'absence de symétrie, regardez les mains.
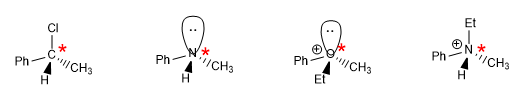
Lire la suite : Éléments d'asymétrie conduisant à des molécules chirales
- Détails
- Germán Fernández
- STÉRÉOCHIMIE II
- Affichages : 2986
Les règles pour donner une configuration absolue à un centre stéréogène sont les suivantes :
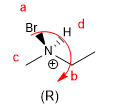
Lire la suite : Notation R/S dans les centres stéréogéniques
- Détails
- Germán Fernández
- STÉRÉOCHIMIE II
- Affichages : 2395
Dans les molécules dont l'élément de chiralité est un axe, nous donnerons la notation R a / S a , (l'indice "a" désigne axial), au moyen de la méthode de projection de Fischer. La méthode du tétraèdre peut également être utilisée.
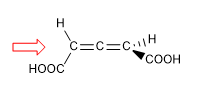
1. Pour que la molécule ait un axe de chiralité, il faut que les deux groupes de chaque côté soient différents l'un de l'autre. Dans cet exemple les groupements sont différents (-H et -COOH) et la molécule a un axe de chiralité.
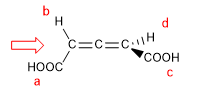
- Détails
- Germán Fernández
- STÉRÉOCHIMIE II
- Affichages : 2089
Ce sont des molécules qui ont une zone plate (phényle), avec un pont qui relie leurs extrémités soit sur la face supérieure soit sur la face inférieure.
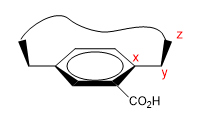
1. Nous attribuons des noms à certains atomes comme indiqué dans l'image. "z" est le premier atome qui est hors du plan. Deux chaînes partent de x, auxquelles il faut donner la priorité par numéro atomique.
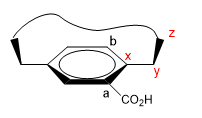
2. Nous projetons le lien xy en nous plaçant dans la position de la flèche.
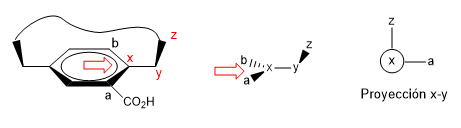
Lire la suite : Notation Rp et Sp dans les plans de chiralité
- Détails
- Germán Fernández
- STÉRÉOCHIMIE II
- Affichages : 2178
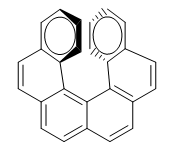
La répulsion entre les anneaux empêche la molécule de se disposer dans le plan. Ainsi l'un des anneaux se penche vers nous et l'autre vers le bas. Dans un énantiomère, l'anneau de droite est courbé vers nous et dans l'autre vers le bas.
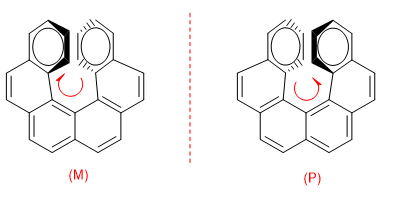
Pour distinguer les deux énantiomères, on fait un tour de l'anneau qui va vers le bas vers celui qui vient vers nous, si ce tour est dans le sens des aiguilles d'une montre, l'énantiomère est M, si le tour est dans le sens opposé, l'énantiomère est P.