ESTEREOQUÍMICA II
- Detalhes
- Germán Fernández
- ESTEREOQUÍMICA II
- Acessos: 3177
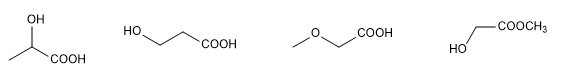
A determinação da estrutura de uma molécula orgânica começa com a análise dos elementos que ela contém e sua proporção, o que geralmente é feito por combustão. A determinação de massa molecular, antes realizada por descida crioscópica, agora utiliza a técnica de espectrometria de massa de alta resolução.
- Detalhes
- Germán Fernández
- ESTEREOQUÍMICA II
- Acessos: 3227
Os diferentes arranjos espaciais que uma molécula pode adotar e que são interconvertidos à temperatura ambiente por rotação são chamados de conformações.
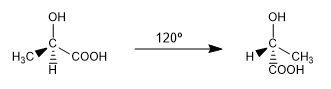
São duas das infinitas conformações que podem ser extraídas do ac. 2-hidroxipropanóico. À temperatura ambiente, a molécula está continuamente girando em todas as conformações possíveis.
Agora vamos ver as duas conformações mais características do etano, as conformações alternada e eclipsada.
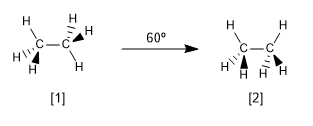
[1] Conformação alternativa do etano
[2] Conformação eclipsada do etano
- Detalhes
- Germán Fernández
- ESTEREOQUÍMICA II
- Acessos: 2992
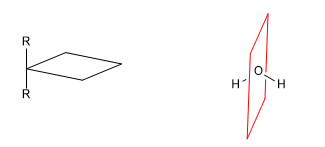
Uma molécula quiral é aquela que não é sobreponível com sua imagem especular. A simetria faz com que as moléculas percam sua quiralidade. Assim, a presença de planos de simetria, centros de inversão ou eixos alternados dão origem a moléculas aquirais.
a) Eixo de simetria (C n )
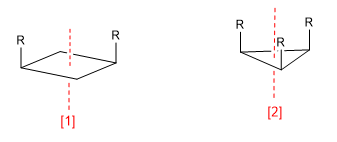
[1] Eixo de simetria (C 2 )
[2] Eixo de simetria (C 3 )
Um eixo de simetria de ordem m deixa a molécula em uma configuração indistinguível da inicial ao girar 360/m graus.
b) Plano de reflexão ( s ): Divide a molécula em duas partes iguais. Cada átomo da molécula que está de um lado do plano deve ter seu espelho do outro lado.
Ler mais: Elementos de simetria levando a moléculas aquirais
- Detalhes
- Germán Fernández
- ESTEREOQUÍMICA II
- Acessos: 3132
Quiralidade é sinônimo de assimetria, objetos quirais são caracterizados pela ausência de simetria, observe as mãos.
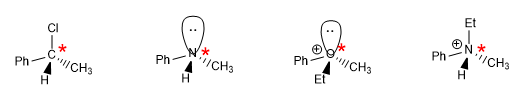
Ler mais: Elementos de assimetria levando a moléculas quirais
- Detalhes
- Germán Fernández
- ESTEREOQUÍMICA II
- Acessos: 3564
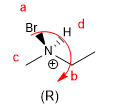
As regras para dar configuração absoluta a um centro estereogênico são as seguintes:
- Detalhes
- Germán Fernández
- ESTEREOQUÍMICA II
- Acessos: 2763
Em moléculas cujo elemento de quiralidade é um eixo, daremos a notação R a / S a , (o subscrito "a" refere-se a axial), por meio do método de projeção de Fischer. O método do tetraedro também pode ser usado.
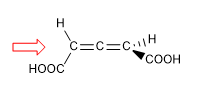
1. Para que a molécula tenha um eixo de quiralidade, é necessário que os dois grupos de cada lado sejam diferentes entre si. Neste exemplo os grupos são diferentes (-H e -COOH) e a molécula tem um eixo de quiralidade.
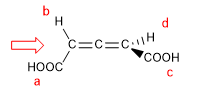
- Detalhes
- Germán Fernández
- ESTEREOQUÍMICA II
- Acessos: 2486
São moléculas que possuem uma área plana (fenil), com uma ponte que une suas extremidades na face superior ou inferior.
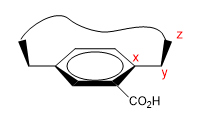
1. Atribuímos nomes a certos átomos conforme mostrado na imagem. "z" é o primeiro átomo que está fora do plano. Duas cadeias começam em x, às quais devemos dar prioridade por número atômico.
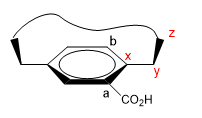
2. Projetamos o elo xy, colocando-nos na posição da seta.
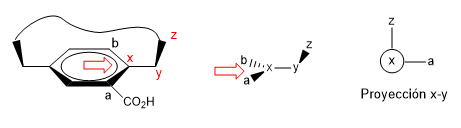
- Detalhes
- Germán Fernández
- ESTEREOQUÍMICA II
- Acessos: 2606
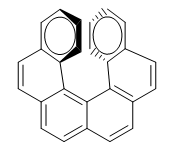
A repulsão entre os anéis impede que a molécula se disponha no plano. Assim, um dos anéis se inclina em nossa direção e o outro na parte inferior. Em um enantiômero, o anel da direita está dobrado em nossa direção e no outro, na parte inferior.
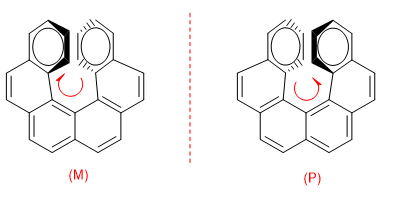
Para distinguir os dois enantiômeros, é feita uma volta do anel que vai para baixo até o que vem em nossa direção. Se essa volta for no sentido horário, o enantiômero é M, se a volta for na direção oposta, o enantiômero é P.