STEREOCHEMIE II
- Details
- Germán Fernández
- STEREOCHEMIE II
- Zugriffe: 2104
Die Bestimmung der Struktur eines organischen Moleküls beginnt mit der Analyse der darin enthaltenen Elemente und deren Anteil, was in der Regel durch Verbrennung erfolgt. Die Bestimmung der Molekülmasse, die zuvor durch kryoskopischen Abstieg durchgeführt wurde, verwendet jetzt die Technik der hochauflösenden Massenspektrometrie.
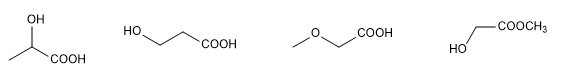
- Details
- Germán Fernández
- STEREOCHEMIE II
- Zugriffe: 3037
Die unterschiedlichen räumlichen Anordnungen, die ein Molekül einnehmen kann und die bei Raumtemperatur durch Rotation ineinander umgewandelt werden, nennt man Konformationen.
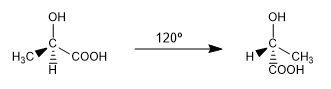
Sie sind zwei der unendlichen Konformationen, die aus dem gezogen werden können 2-Hydroxypropansäure. Bei Raumtemperatur rotiert das Molekül kontinuierlich durch alle möglichen Konformationen.
Schauen wir uns nun die beiden charakteristischsten Konformationen von Ethan an, die alternative und die verfinsterte Konformation.
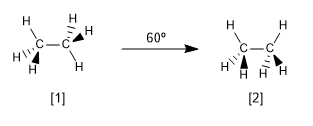
[1 ] Alternative Konformation von Ethan
[2] Verdunkelte Konformation von Ethan
- Details
- Germán Fernández
- STEREOCHEMIE II
- Zugriffe: 3419
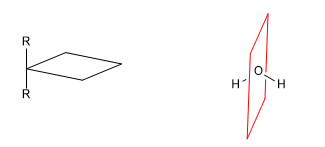
Ein chirales Molekül ist eines, das nicht mit seinem Spiegelbild überlagert werden kann. Symmetrie bewirkt, dass Moleküle ihre Chiralität verlieren. So führt das Vorhandensein von Symmetrieebenen, Inversionszentren oder alternierenden Achsen zu achiralen Molekülen.
a) Symmetrieachse (C n )
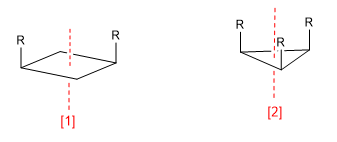
[1 ] Symmetrieachse (C 2 )
[2 ] Symmetrieachse (C 3 )
Eine Symmetrieachse der Ordnung m hinterlässt das Molekül in einer Konfiguration, die von der ursprünglichen nicht zu unterscheiden ist, wenn es um 360/m Grad gedreht wird.
b) Reflexionsebene ( s ): Teilt das Molekül in zwei gleiche Teile. Jedes Atom des Moleküls, das sich auf einer Seite der Ebene befindet, muss seinen Spiegel auf der anderen Seite haben.
Weiterlesen: Symmetrieelemente, die zu achiralen Molekülen führen
- Details
- Germán Fernández
- STEREOCHEMIE II
- Zugriffe: 2502
Chiralität ist gleichbedeutend mit Asymmetrie, chirale Objekte zeichnen sich durch das Fehlen von Symmetrie aus, schauen Sie sich die Hände an.
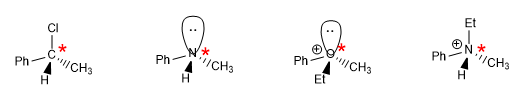
Weiterlesen: Asymmetrieelemente, die zu chiralen Molekülen führen
- Details
- Germán Fernández
- STEREOCHEMIE II
- Zugriffe: 2389
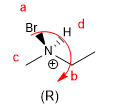
Die Regeln, um einem stereogenen Zentrum eine absolute Konfiguration zu geben, sind die folgenden:
- Details
- Germán Fernández
- STEREOCHEMIE II
- Zugriffe: 2672
In Molekülen, deren Chiralitätselement eine Achse ist, geben wir die Notation R a / S a (das tiefgestellte "a" bezieht sich auf axial) mittels der Fischer-Projektionsmethode. Auch die Tetraeder-Methode kann verwendet werden.
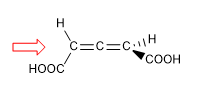
1. Damit das Molekül eine Chiralitätsachse hat, müssen sich die beiden Gruppen auf jeder Seite voneinander unterscheiden. In diesem Beispiel sind die Gruppen unterschiedlich (-H und -COOH) und das Molekül hat eine Chiralitätsachse.
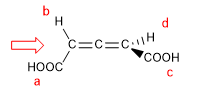
- Details
- Germán Fernández
- STEREOCHEMIE II
- Zugriffe: 2427
Dies sind Moleküle, die einen flachen Bereich (Phenyl) mit einer Brücke haben, die ihre Enden entweder auf der Ober- oder Unterseite verbindet.
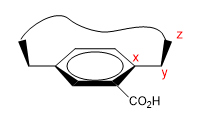
1. Wir weisen bestimmten Atomen Namen zu, wie im Bild gezeigt. "z" ist das erste Atom, das außerhalb der Ebene liegt. Zwei Ketten beginnen bei x, denen wir nach Ordnungszahl Priorität geben müssen.
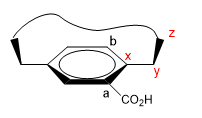
2. Wir projizieren die xy-Verbindung und platzieren uns in der Position des Pfeils.
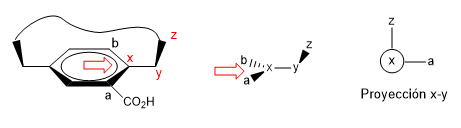
- Details
- Germán Fernández
- STEREOCHEMIE II
- Zugriffe: 1993
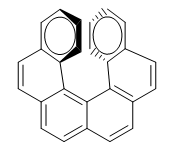
Die Abstoßung zwischen den Ringen verhindert, dass sich das Molekül in der Ebene anordnet. Einer der Ringe biegt sich also zu uns und der andere nach unten. Bei einem Enantiomer ist der rechte Ring zu uns hin gebogen und bei dem anderen nach unten.
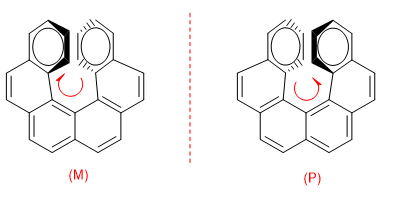
Um die beiden Enantiomere zu unterscheiden, macht man eine Drehung von dem Ring, der nach unten geht, zu dem, der auf uns zukommt: Wenn diese Drehung im Uhrzeigersinn erfolgt, ist das Enantiomer M, wenn die Drehung in die entgegengesetzte Richtung erfolgt, ist das Enantiomer P.