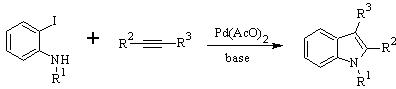Sintesi di INDOLI
(Con il metodo delle disconnessioni)
Il sistema dell'anello indolico è stato trovato in molti composti naturali di grande interesse chimico e biochimico, motivo per cui si dice che sia il più abbondante in natura. Pertanto, il triptofano è un amminoacido essenziale, l'indaco è un colorante e l'acido indolil-3-acetico è un ormone della crescita delle piante. D'altra parte, l'interesse per queste molecole deriva dal loro uso farmacologico, esempi sono il sumatriptan (antiemicranico) e il frovatriptan, anch'esso un antiemicranico.
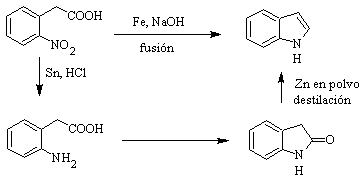
L'indolo è un solido cristallino incolore con pf 52°C, facilmente solubile nella maggior parte dei solventi organici e cristallizza dall'acqua, ha un odore gradevole ed è quindi utilizzato anche come base di profumo.
Fu preparato per la prima volta nel 1866 riscaldando l'ossindolo con polvere di zinco ed è diventato un importante prodotto commerciale. Baeyer nel 1869 propose la seguente sintesi:
I metodi di sintesi classici per gli indoli sono quelli di Fischer, Bischler, Reissert e Leimgruber-Batcho, Bartoli, Larock, Gassman, Sugasawa, Fukuyama, Hegedus e Dobbs.
1.
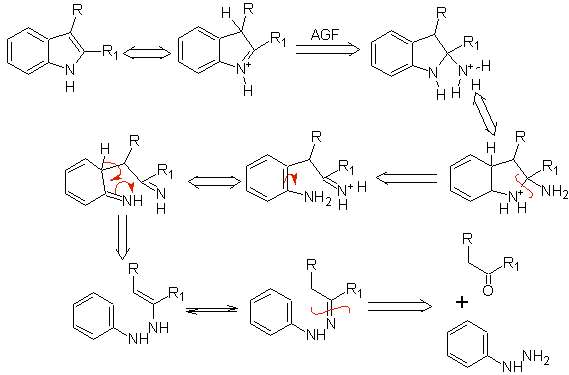
Sintesi FISCHER
Consiste nel riscaldamento di fenilidrazoni di chetoni o aldeidi, con cloruro di zinco anidro, trifluoruro di boro, acido polifosforico o qualche altro catalizzatore acido, per produrre indoli. Si verifica un riarrangiamento acido-catalizzato di un fenilidrazone con l'eliminazione di acqua e NH 3 . I gruppi di elettrodonatori favoriscono la ciclizzazione e gli elettroattrattori la ostacolano.
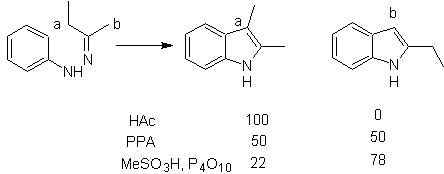
Con chetoni asimmetrici, la ciclizzazione intramolecolare dell'idrazone può portare a due indoli isomerici in proporzioni diverse a seconda delle condizioni utilizzate; in mezzi fortemente acidi, può predominare l'indolo meno sostituito.
Quando sono presenti meta sostituenti, rispetto all'idrazone azotato, la ciclizzazione può avvenire in due posizioni, portando a due indoli isomerici:
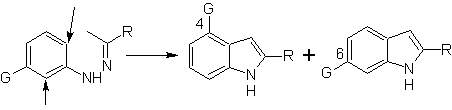
Se il sostituente G è elettro-attraente, i due isomeri (4- e 6-) si formano approssimativamente nella stessa proporzione. D'altra parte, se G è un sostituente donatore di elettroni, si forma principalmente l'isomero sostituito 6. L'analisi retrosintetica dell'indolo formato dalla sintesi di Fischer può essere considerata come segue:
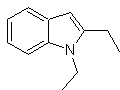
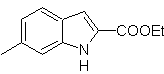
Proporre un piano di sintesi per le seguenti molecole: | MOb 119
| MOb 120
|
MOb 119. Analisi retrosintetica. La disconnessione fondamentale negli indoli che si suppone siano formati dalla sintesi di Fischer corrisponde a una retrotrasposizione, che si manifesta nella disconnessione di
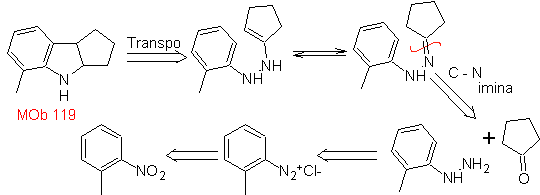
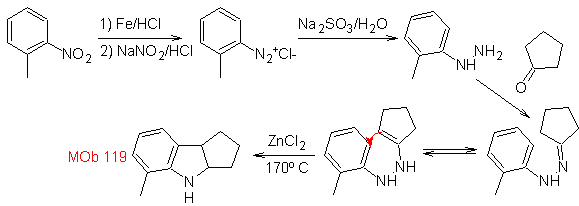
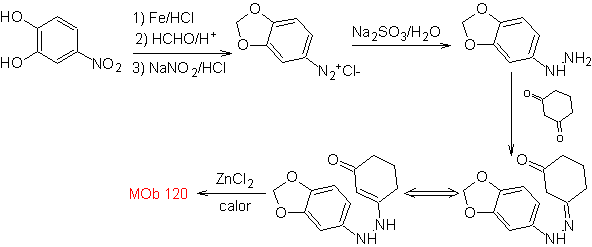
Sintesi : dall'orto-nitrotoluene si genera il derivato intermedio della fenilidrazina, necessario nella sintesi degli indoli di Fischer, si forma l'immina con un ciclopentanone, e per riscaldamento
MOb 120. Analisi retrosintetica. La retro-trasposizione di
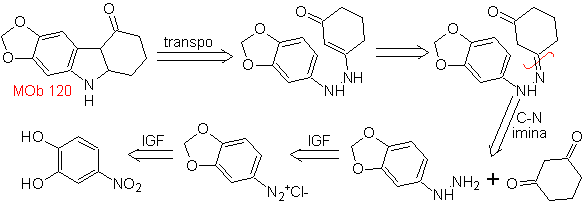
Sintesi. L'OH della molecola di partenza è protetto, formando un acetale ciclico e il gruppo nitro viene ridotto per diazotizzare successivamente l'ammino.
La riduzione del diazocomposto formato con solfito di sodio, permette di ottenere il derivato fenilfidrazinico, che viene combinato con il cicloesanone, che porta quindi a
1.
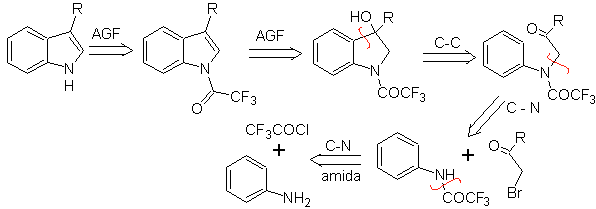
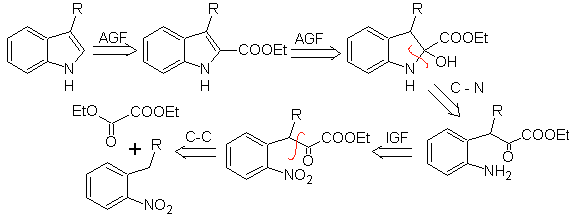
Sintesi BISCHLER
Consiste in una ciclizzazione acido-catalizzata di un α-arilaminochetone, che viene preparato da un'anilina e un α-alocarbonile. Utilizzando α-amminochetoni N-acilati, la ciclizzazione è più controllabile e consente di ottenere indoli sostituiti nell'anello eterociclico
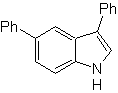
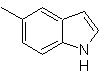
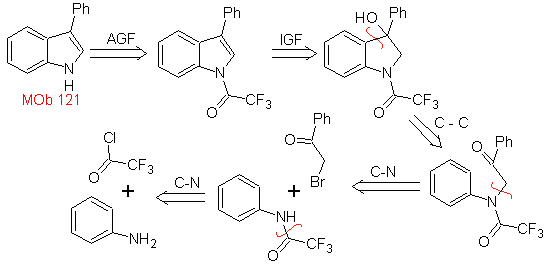
Proporre un progetto di sintesi per le seguenti molecole : | MOb 121
| MOb 122
|
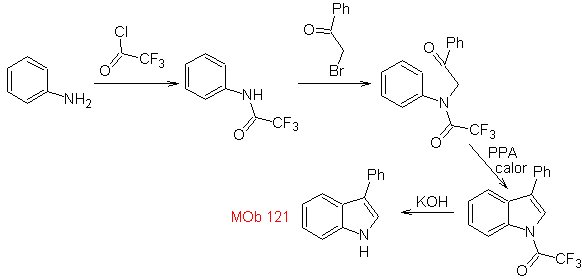
MOb 121 . Analisi retrosintetica.
Sintesi. A partire dall'anilina si può ottenere l'ammide necessaria, che poi reagirà con l'α-bromo benzofenone, formando una molecola che ciclizza con il PPA. L'applicazione di una base come KOH e il calore, forma
MOb 122 . Analisi retrosintetica.
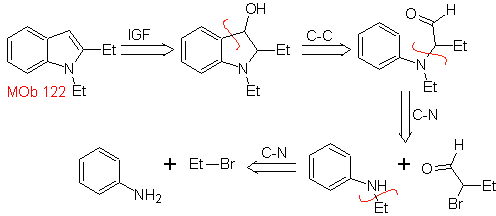
Sintesi. Ancora una volta, la sintesi di
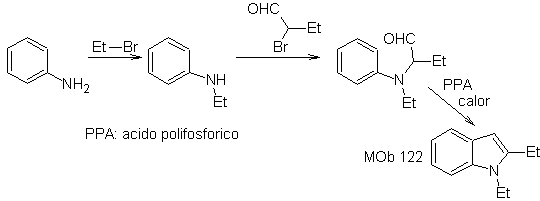
In questo metodo è essenziale che gli idrogeni del sostituente in posizione orto al gruppo nitro siano sufficientemente acidi, e quindi si garantisca al nucleofilo nella sua formazione, di combinarsi con un composto carbonilico.
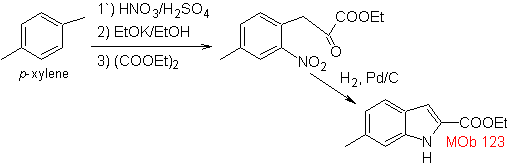
Proporre un piano di sintesi per le seguenti molecole: | MOb 123
| MOb 124
|
MOb 123 . Analisi retrosintetica.
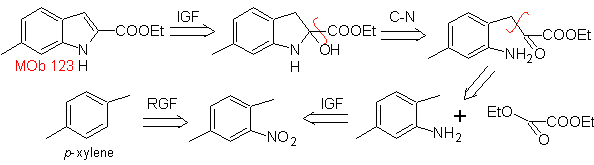
Sintesi. p-xilene viene trasformato in un nitroderivato, come intermedio richiesto, per ciclizzare, decarbossilato e quindi forma
MOb 124 . Analisi retrosintetica.
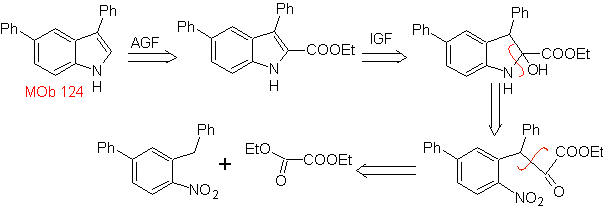
Sintesi. Il materiale di partenza proposto per la sintesi di
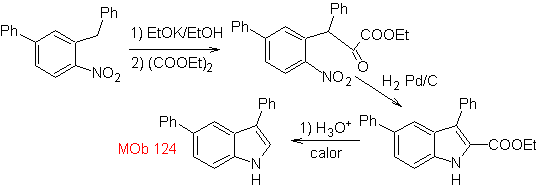
3.
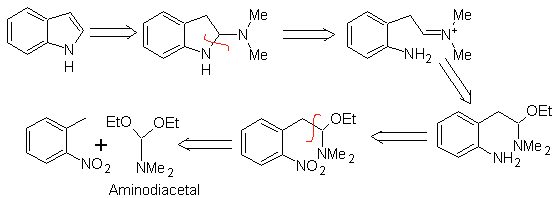
Sintesi LEIMGRUBER-BATCHO
Come nel metodo precedente, deve essere garantita l'acidità del sostituente in posizione orto al gruppo nitro, l'elettrofilo richiesto è fornito dall'amminodiacetale.
Proporre un piano di sintesi per le seguenti molecole: | MOb 125
|
| MOb 126
|
MOb 125. Analisi retrosintetica. La strategia di disconnessione che emerge dalla sintesi Leimgruber-Batcho serve a
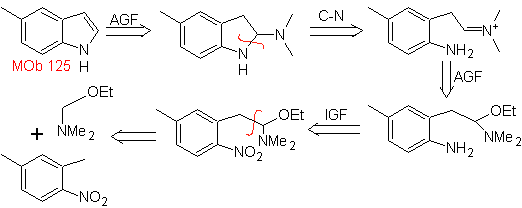
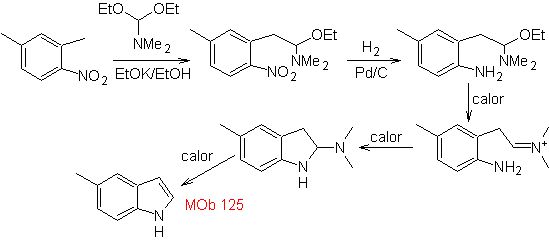
Sintesi. L'intermedio 2,4-dimetil-1-nitrobenzene può essere preparato dal benzene e proseguire con le reazioni previste dal metodo Leimgruber-Batcho, per la sintesi di
MOb 126 . Analisi retrosintetica. Il gruppo metilico in C2 dell'indolo costringe le disconnessioni a essere legate alla presenza di un gruppo acetilenico, che alla fine si combinerà con il gruppo amminico.
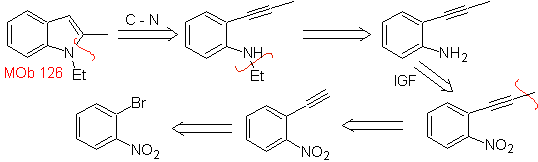
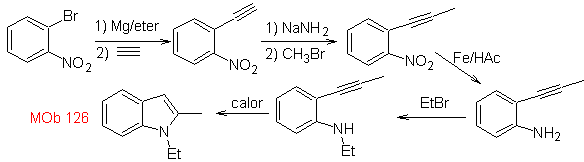
Sintesi. Per introdurre il gruppo acetilene nel benzene, un organomagnesio viene fatto reagire con l'acetilene. La ciclizzazione è prodotta da una reazione del gruppo amminico con il triplo legame. Le seguenti reazioni rendono possibile la formazione
Sintesi di HEGEDUS :
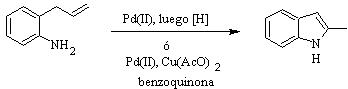
Sintesi FUKUYAMA :
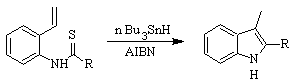
Sintesi SUGASAWA :
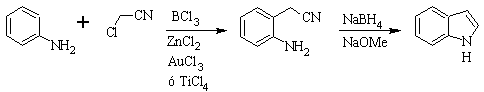
La sintesi di Gassman :
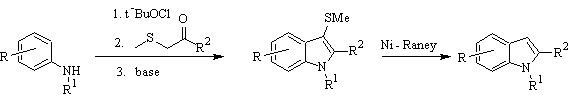
BARTOLI sintesi:
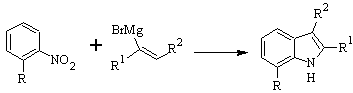
Sintesi DOBBS :
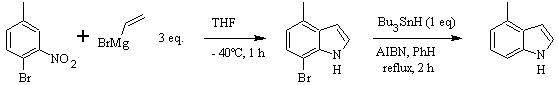
CASTRO sintesi:
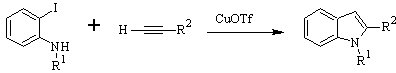
LAROCK Sintesi: