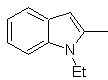
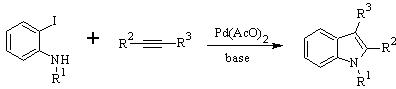Síntese de INDOLES
(Pelo método de desconexões)
O sistema de anéis indol tem sido encontrado em muitos compostos naturais de grande interesse químico e bioquímico, por isso é considerado o mais abundante na natureza. Assim, o triptofano é um aminoácido essencial, o índigo é um corante e o ácido indolil-3-acético é um hormônio de crescimento vegetal. Por outro lado, o interesse por essas moléculas decorre de seu uso farmacológico, sendo exemplos o sumatriptano (antienxaqueca) e o frovatriptano, também um antienxaqueca.
Indol é um sólido cristalino incolor com pf 52°C, facilmente solúvel na maioria dos solventes orgânicos e cristaliza na água, tem um odor agradável e, portanto, também é usado como base para perfumes.
Foi preparado pela primeira vez em 1866 por aquecimento de oxindol com pó de zinco e tornou-se um importante produto comercial. Baeyer em 1869 propôs a seguinte síntese:
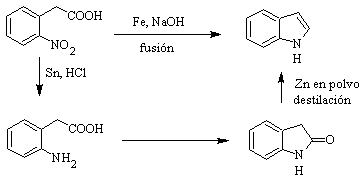
Os métodos clássicos de síntese de indóis são os de Fischer, Bischler, Reissert e Leimgruber-Batcho, Bartoli, Larock, Gassman, Sugasawa, Fukuyama, Hegedus e Dobbs.
1.
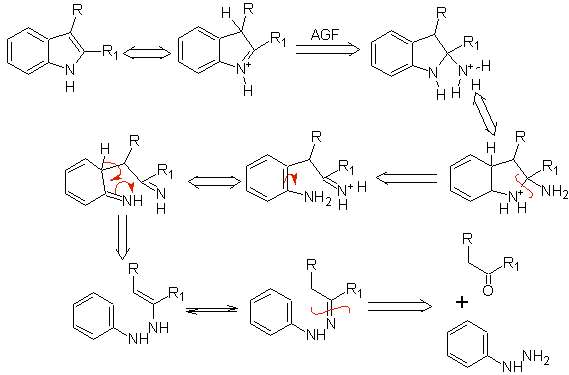
Síntese FISCHER
Consiste no aquecimento de fenilhidrazonas de cetonas ou aldeídos, com cloreto de zinco anidro, trifluoreto de boro, ácido polifosfórico ou algum outro catalisador ácido, para produzir indóis. Um rearranjo catalisado por ácido de uma fenilhidrazona ocorre com eliminação de água e NH 3 . Os grupos eletrodoadores favorecem a ciclização e os eletroatratores a impedem.
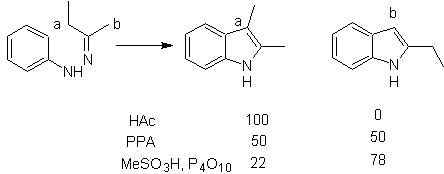
Com cetonas assimétricas, a ciclização intramolecular da hidrazona pode levar a dois indóis isoméricos em diferentes proporções dependendo das condições utilizadas; em meios fortemente ácidos, o indol menos substituído pode predominar.
Quando há substituintes meta, em relação ao nitrogênio da hidrazona, a ciclização pode ocorrer em duas posições, levando a dois indóis isoméricos:
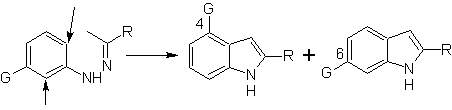
Se o substituinte G é eletroremovente, os dois isômeros (4- e 6-) são formados aproximadamente na mesma proporção. Por outro lado, se G for um substituinte doador de elétrons, forma-se principalmente o isômero substituído em 6. A análise retrossintética do indol formado pela síntese de Fischer pode ser considerada como segue:
Proponha um plano de síntese para as seguintes moléculas: | MOb 119
| MOb 120
|
MOb 119. Análise retrossintética. A desconexão fundamental nos indóis supostamente formados pela síntese de Fischer corresponde a uma retrotransposição, que se mostra na desconexão de
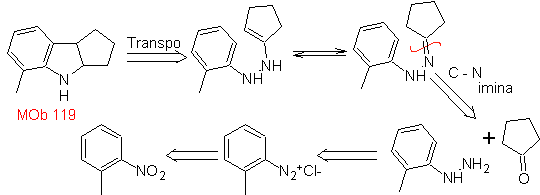
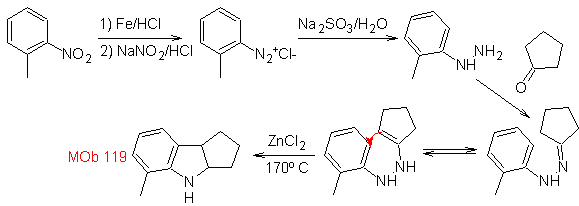
Síntese : A partir do orto-nitrotolueno, é gerado o derivado intermediário da fenil-hidrazina, necessário na síntese dos indóis de Fischer, a imina é formada com uma ciclopentanona e por aquecimento
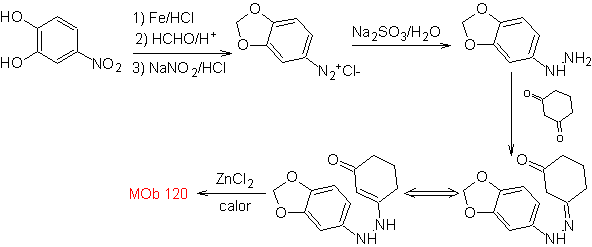
MOb 120. Análise retrossintética. A retrotransposição de
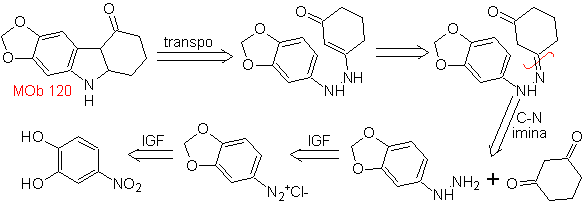
Síntese. O OH da molécula de partida é protegido, formando um acetal cíclico e o grupo nitro é reduzido para posteriormente diazotar o amino.
A redução do composto diazo formado com sulfito de sódio, permite obter o derivado fenilfidrazina, que se combina com a ciclohexanona, que então leva a
1.
Síntese BISCHLER
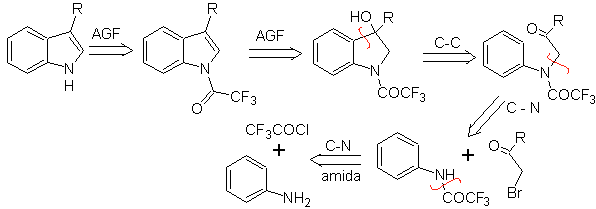
Consiste em uma ciclização catalisada por ácido de uma α-arilaminocetona, que é preparada a partir de uma anilina e um α-halocarbonil. Usando α-aminocetonas N-aciladas, a ciclização é mais controlável e permite a obtenção de indóis substituídos no anel heterocíclico
Proponha um projeto de síntese para as seguintes moléculas : | MOb 121
| MOb 122
|
MOb 121 . Análise retrossintética.
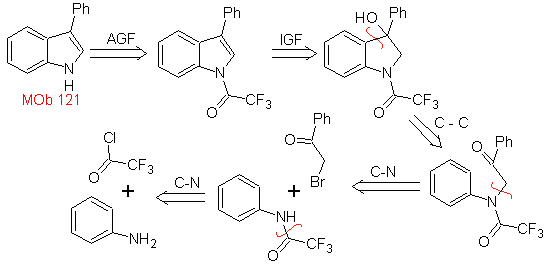
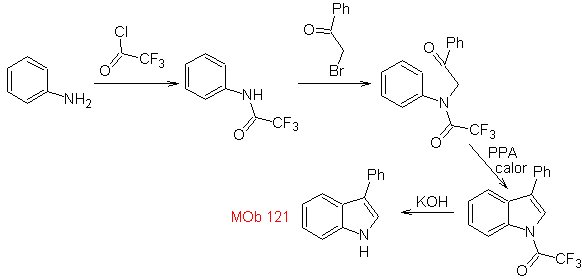
Síntese. A partir da anilina, pode-se obter a amida necessária, que reagirá com a α-bromo benzofenona, formando uma molécula que cicliza com o PPA. A aplicação de uma base como KOH e calor, forma
MOb 122 . Análise retrossintética.
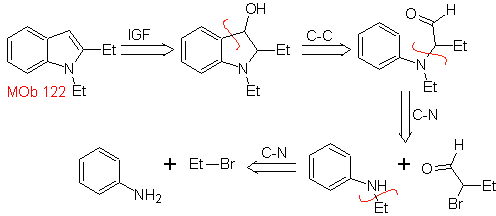
Síntese. Mais uma vez, a síntese de
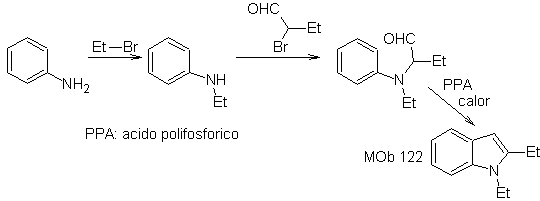
Neste método é essencial que os hidrogênios do substituinte na posição orto ao grupo nitro sejam suficientemente ácidos, e assim o nucleófilo está garantido em sua formação, para se combinar com um composto carbonílico.
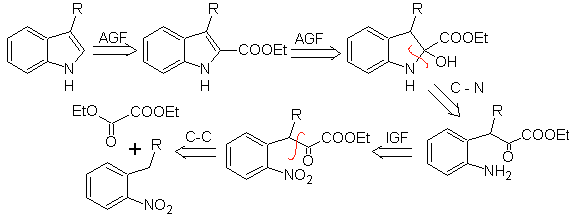
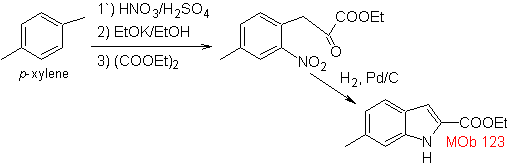
Proponha um plano de síntese para as seguintes moléculas: | MOb 123
| MOb 124
|
MOb 123 . Análise retrossintética.
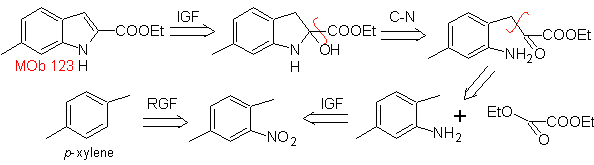
Síntese. p-xileno é transformado em um nitroderivado, como intermediário necessário, para ciclizar, descarboxilar e assim formar
MOb 124 . Análise retrossintética.
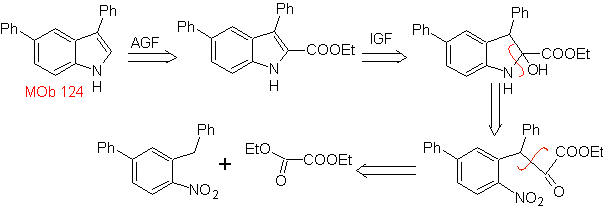
Síntese. O material de partida proposto para a síntese de
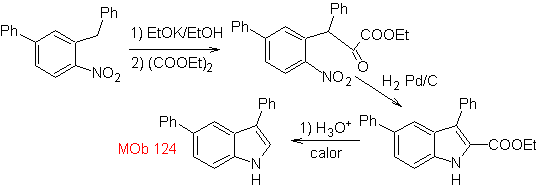
3.
Síntese de LEIMGRUBER-BATCHO
Como no método anterior, deve-se garantir a acidez do substituinte na posição orto ao grupo nitro, o eletrófilo necessário é fornecido pelo aminodiacetal.
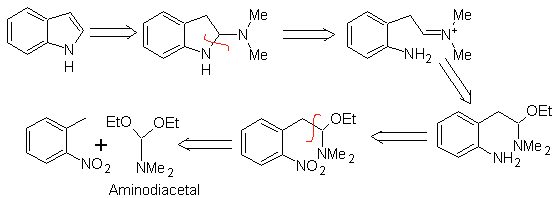
Proponha um plano de síntese para as seguintes moléculas: | MOb 125
|
| MOb 126
|
MOb 125. Análise retrossintética. A estratégia de desconexão que emerge da síntese de Leimgruber-Batcho é usada para
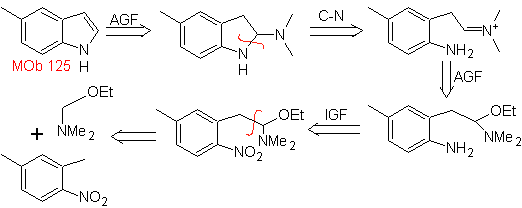
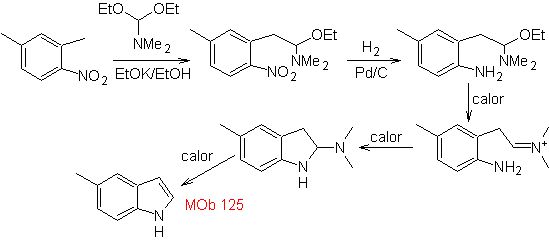
Síntese. O intermediário 2,4-dimetil-1-nitrobenzeno pode ser preparado a partir do benzeno e continuar com as reações previstas no método Leimgruber-Batcho, para a síntese de
MOb 126 . Análise retrossintética. O grupo metil em C2 do indol força as desconexões a serem ligadas à presença de um grupo acetilênico, que acabará por se combinar com o grupo amino.
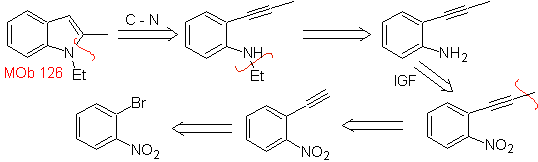
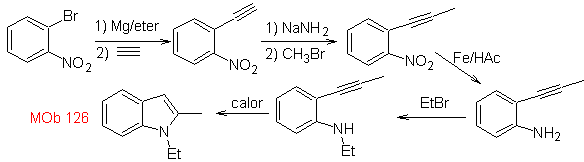
Síntese. Para introduzir o grupo acetileno no benzeno, um organomagnésio é reagido com acetileno. A ciclização é produzida por uma reação do grupo amino com a ligação tripla. As seguintes reações tornam possível formar
Síntese de HEGEDUS :
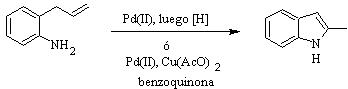
Síntese de FUKUYAMA :
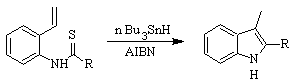
Síntese SUGASAWA :
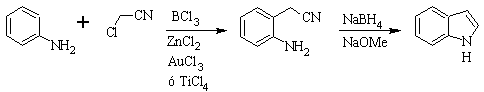
Síntese de Gassman :
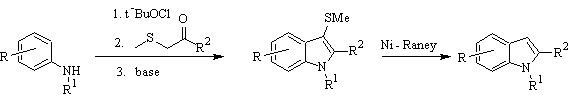
Síntese de BARTOLI:
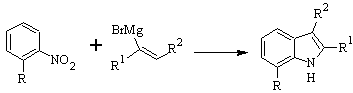
Síntese DOBBS :
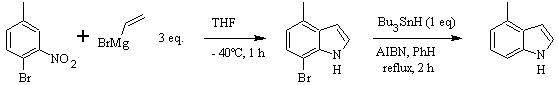
Síntese CASTRO:
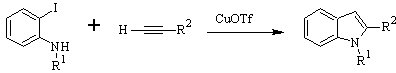
Síntese de LAROCK: