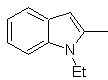
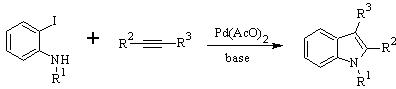Synthese von INDOLES
(Durch die Methode der Trennung)
Das Indol-Ringsystem wurde in vielen natürlichen Verbindungen von großem chemischem und biochemischem Interesse gefunden, weshalb es als das am häufigsten vorkommende in der Natur gilt. So ist Tryptophan eine essentielle Aminosäure, Indigo ein Farbstoff und Indolyl-3-Essigsäure ein Pflanzenwachstumshormon. Andererseits ergibt sich das Interesse an diesen Molekülen aus ihrer pharmakologischen Verwendung, Beispiele sind Sumatriptan (Antimigräne) und Frovatriptan, ebenfalls ein Antimigränemittel.
Indol ist ein farbloser kristalliner Feststoff mit einem Schmelzpunkt von 52 °C, der in den meisten organischen Lösungsmitteln leicht löslich ist und aus Wasser kristallisiert, einen angenehmen Geruch hat und daher auch als Parfümbasis verwendet wird.
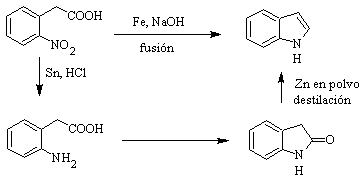
Es wurde erstmals 1866 durch Erhitzen von Oxindol mit Zinkstaub hergestellt und ist zu einem wichtigen Handelsprodukt geworden. Baeyer schlug 1869 die folgende Synthese vor:
Die klassischen Synthesemethoden für Indole sind die von Fischer, Bischler, Reissert u Leimgruber-Batcho, Bartoli, Larock, Gassman, Sugasawa, Fukuyama, Hegedus und Dobbs.
1.
FISCHER-Synthese
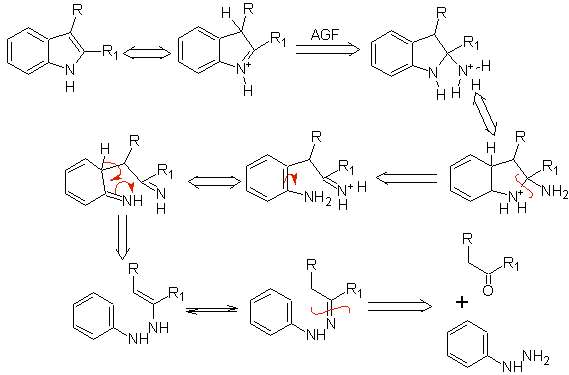
Es besteht aus dem Erhitzen von Phenylhydrazonen von Ketonen oder Aldehyden mit wasserfreiem Zinkchlorid, Bortrifluorid, Polyphosphorsäure oder einem anderen Säurekatalysator, um Indole herzustellen. Unter Abspaltung von Wasser und NH 3 erfolgt eine säurekatalysierte Umlagerung eines Phenylhydrazons. Elektronendonorgruppen begünstigen die Cyclisierung und Elektroattraktoren behindern sie.
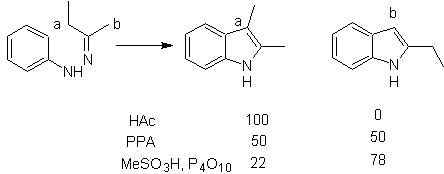
Bei asymmetrischen Ketonen kann die intramolekulare Cyclisierung des Hydrazons je nach den verwendeten Bedingungen zu zwei isomeren Indolen in unterschiedlichen Anteilen führen, wobei in stark sauren Medien das weniger substituierte Indol überwiegen kann.
Wenn meta-Substituenten in Bezug auf den Hydrazon-Stickstoff vorhanden sind, kann die Cyclisierung in zwei Positionen stattfinden, was zu zwei isomeren Indolen führt:
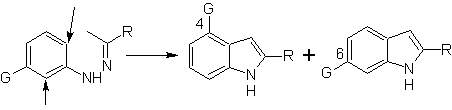
Wenn der Substituent G elektroabziehend ist, werden die beiden Isomere (4- und 6-) in ungefähr gleichen Anteilen gebildet. Wenn G andererseits ein elektronenspendender Substituent ist, wird hauptsächlich das 6-substituierte Isomer gebildet.Die retrosynthetische Analyse des durch die Fischer-Synthese gebildeten Indols kann wie folgt betrachtet werden:
Schlagen Sie einen Syntheseplan für die folgenden Moleküle vor: | MB 119
| MB 120
|
MOb 119. Retrosynthetische Analyse. Die grundsätzliche Trennung in den Indolen, die durch die Fischer-Synthese gebildet werden sollen, entspricht einer Retro-Transposition, die sich in der Trennung von zeigt
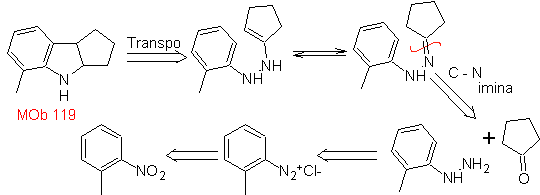
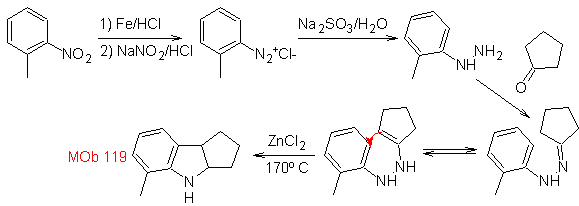
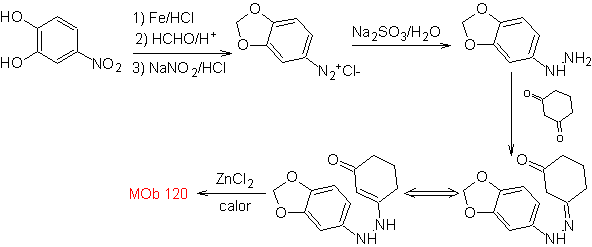
Synthese : Aus ortho-Nitrotoluol wird das Zwischenderivat von Phenylhydrazin erzeugt, das bei der Synthese von Fischer-Indolen notwendig ist, das Imin wird mit einem Cyclopentanon und durch Erhitzen gebildet
MOb 120. Retrosynthetische Analyse. Die Retrotransposition von
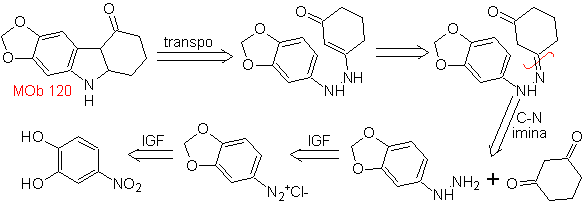
Synthese. Das OH des Ausgangsmoleküls wird geschützt, wodurch ein cyclisches Acetal gebildet wird, und die Nitrogruppe wird reduziert, um später das Amino zu diazotieren.
Die Reduktion der gebildeten Diazoverbindung mit Natriumsulfit ermöglicht den Erhalt des Phenylfidrazin-Derivats, das mit Cyclohexanon kombiniert wird, was dann zu führt
1.
BISCHLER-Synthese
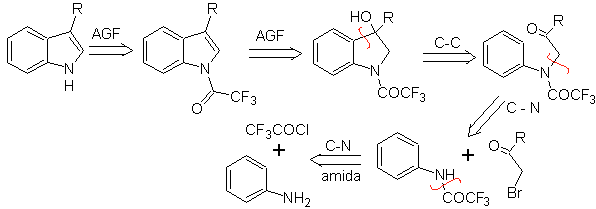
Es besteht aus einer säurekatalysierten Cyclisierung eines α-Arylaminoketons, das aus einem Anilin und einem α-Halogencarbonyl hergestellt wird. Unter Verwendung von N-acylierten α-Aminoketonen ist die Cyclisierung besser kontrollierbar und ermöglicht den Erhalt substituierter Indole im heterocyclischen Ring
Schlagen Sie ein Synthesedesign für die folgenden Moleküle vor : | MB 121
| MB 122
|
MB 121 . Retrosynthetische Analyse.
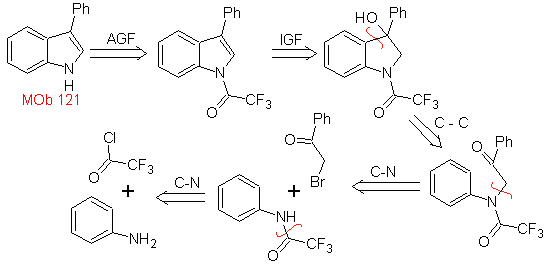
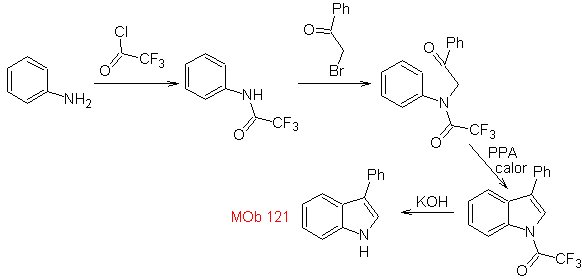
Synthese. Ausgehend von Anilin kann das erforderliche Amid erhalten werden, das dann mit α-Brombenzophenon reagiert, um ein Molekül zu bilden, das mit PPA cyclisiert. Die Anwendung einer Base, wie KOH und Wärme, bildet sich
MB 122 . Retrosynthetische Analyse.
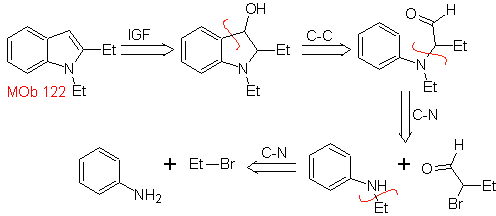
Synthese. Wieder die Synthese von
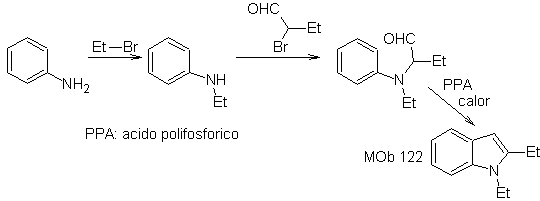
Bei diesem Verfahren ist es wesentlich, dass die Wasserstoffatome des Substituenten in ortho-Position zur Nitrogruppe sauer genug sind und daher das Nucleophil bei seiner Bildung gewährleistet ist, um sich mit einer Carbonylverbindung zu verbinden.
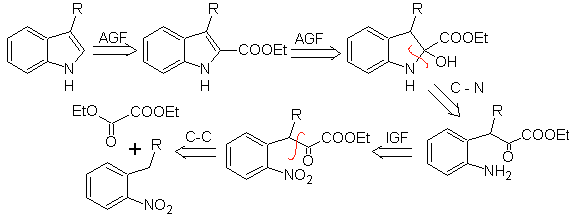
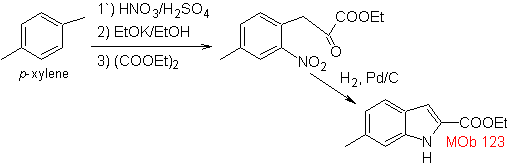
Schlagen Sie einen Syntheseplan vor für folgende Moleküle: | MB 123
| MB 124
|
MB 123 . Retrosynthetische Analyse.
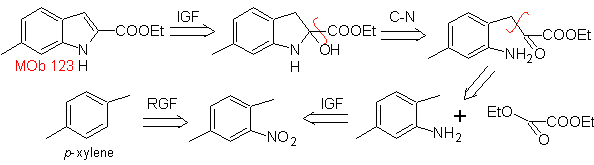
Synthese. p-Xylol wird als erforderliches Zwischenprodukt in ein Nitroderivat umgewandelt, um zu cyclisieren, decarboxylieren und so bilden
MB 124 . Retrosynthetische Analyse.
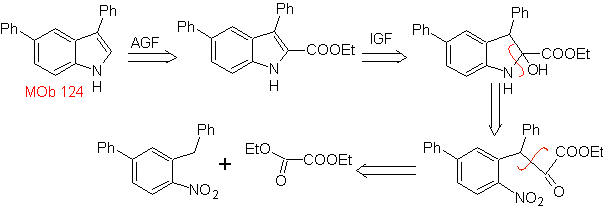
Synthese. Das für die Synthese vorgeschlagene Ausgangsmaterial von
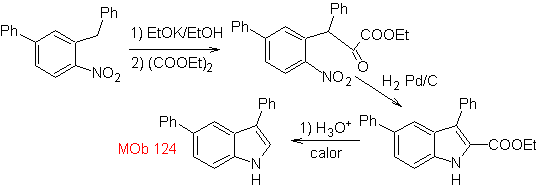
3.
LEIMGRUBER-BATCHO-Synthese
Wie beim vorigen Verfahren muss die Acidität des Substituenten in ortho-Stellung zur Nitrogruppe gewährleistet sein, das benötigte Elektrophil wird durch das Aminodiacetal bereitgestellt.
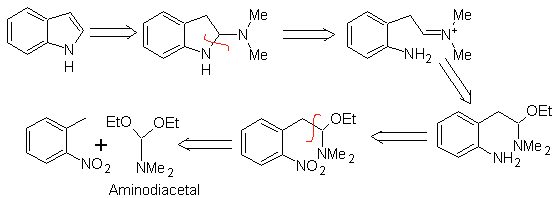
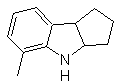
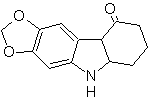
Schlagen Sie einen Syntheseplan für die folgenden Moleküle vor: | MB 125
|
| MB 126
|
MOb 125. Retrosynthetische Analyse. Die Abschaltstrategie, die sich aus der Leimgruber-Batcho-Synthese ergibt, ist gewöhnungsbedürftig
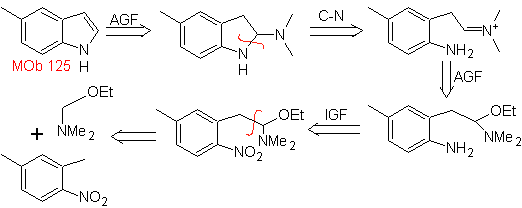
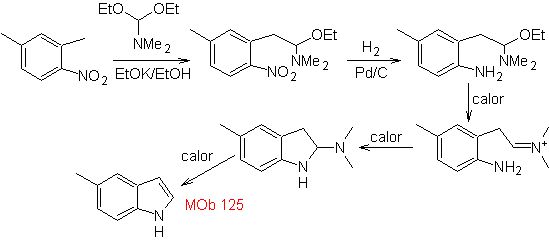
Synthese. Das Zwischenprodukt 2,4-Dimethyl-1-nitrobenzol kann aus Benzol hergestellt und mit den im Leimgruber-Batcho-Verfahren vorgesehenen Reaktionen zur Synthese weitergeführt werden
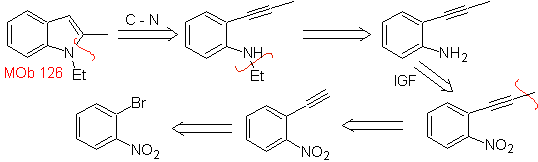
MB 126 . Retrosynthetische Analyse. Die Methylgruppe an C2 des Indols erzwingt die Bindung der Trennungen an das Vorhandensein einer Acetylengruppe, die sich schließlich mit der Aminogruppe verbinden wird.
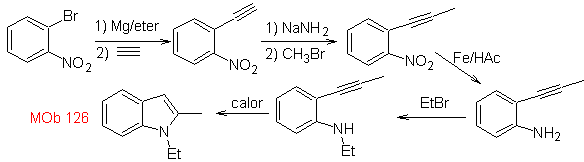
Synthese. Um die Acetylengruppe in Benzol einzuführen, wird ein Organomagnesium mit Acetylen umgesetzt. Die Cyclisierung entsteht durch eine Reaktion der Aminogruppe mit der Dreifachbindung. Die folgenden Reaktionen ermöglichen die Bildung
HEGEDUS-Synthese :
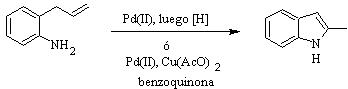
FUKUYAMA-Synthese :
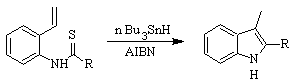
SUGASAWA-Synthese :
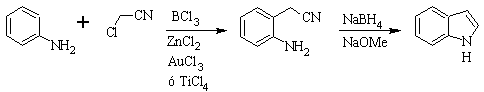
Gassmans Synthese :
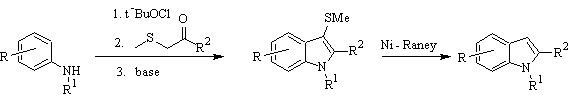
BARTOLI-Synthese:
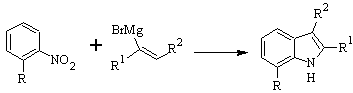
DOBBS-Synthese :
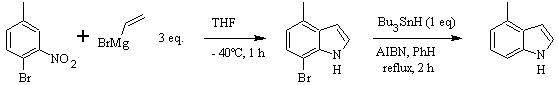
CASTRO-Synthese:
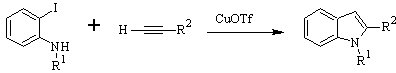
LAROCK-Synthese: