1,6-дифункциональные соединения предпочтительно используют стратегию повторного соединения для их соответствующего синтеза; Эту стратегию можно очень хорошо комбинировать с реакцией Дильса-Альдера, которая обычно дает шестичленные олефиновые аддукты, или с реакцией Берча бензольных колец, которая также дает шестичленные олефиновые продукты.
1.
1,6-диоксигенированные соединения
Реакция образования дикарбонильных соединений в различных возможных сочетаниях: дикетоны, кетокислоты, кетоальдегиды, дикислоты и т. д. и на разном расстоянии друг от друга, несомненно, является реакцией озонолиз олефиновых соединений.
В зависимости от структуры субстрата и условий реакции на образующемся озонидном промежуточном продукте в результате разрыва олефиновой двойной связи будет получено огромное разнообразие соединений. Из них особый интерес представляют те, которые находятся в 1,6-диоксигенированном соотношении, что можно сделать из следующей синтетической операции «пересоединения»:
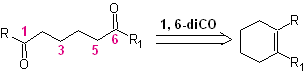
Лучший способ понять работу этой «синтетической операции повторного подключения» — это
будет достигнуто за счет решения синтеза следующих органических молекул:
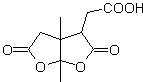
МОБ 50
| МОБ 51
| МОБ 52
| ||
МОБ 53
| Моб 54
| МОБ 55
|
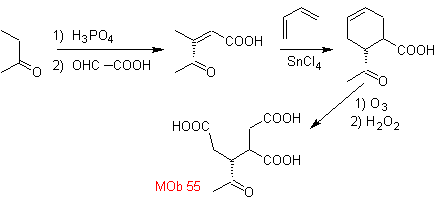
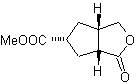
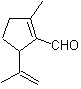
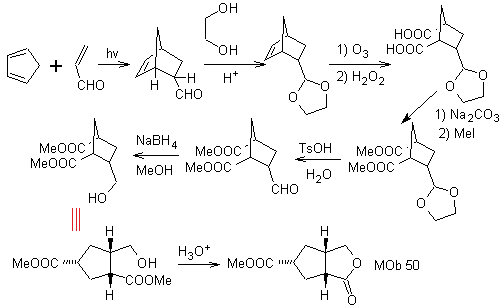
МОБ 50 . Ретросинтетический анализ : в первую очередь это связано с лактонной функцией молекулы . По образовавшейся молекуле-предшественнику, в свою очередь, можно утверждать , что ее образование могло происходить из диакарбоновой кислоты в положении 1-6. Которые повторно соединяются с образованием алкена, который их произвел в результате реакции окислительного озонолиза. Образовавшийся алкен представляет собой типичный аддукт Дильса-Альдера между циклопентадиеном и кротоновым альдегидом.
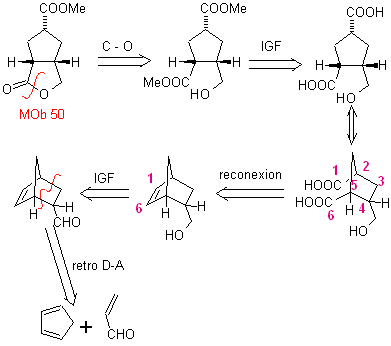
Синтез: реакция Дильса-Альдера между циплопентадиен и α,β-ненасыщенный альдегид обеспечивает алкеновый аддукт для его соответствующего раскрытия окислительным озонолизом перед реакцией защиты альдегидной группы, с которой впоследствии снимают защиту, для восстановления до спиртовой функции. Этот спирт реагирует со сложноэфирной группой в кислой среде с образованием желаемого лактона, MOb 50.
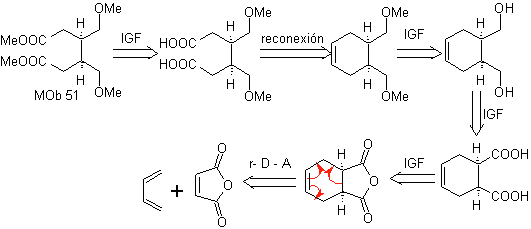
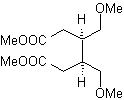
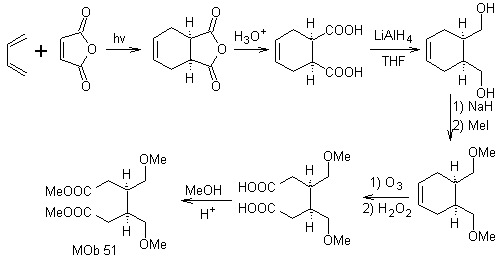
Синтез. В реакции Дильса-Альдера образуется аддукт циклического ангидрида, который после гидролиза восстанавливается до соответствующего спирта, который по Вильямсону превращается в эфиры. Циклогексен раскрывается окислительным озонолизом, и кислотные группы реагируют в кислой среде с метиловым спиртом, превращаясь в
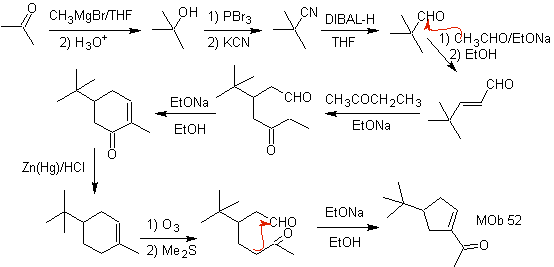
МОБ 52 . Ретросинтетический анализ: изначально отключен
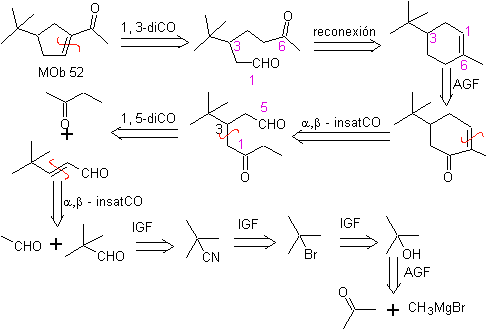
Синтез : Ацетон позволяет образовать промежуточный трет-бутилформальдегид, который в основной среде и этаноле конденсируется с этаналем. К продукту, образующемуся α, β-инсатур СО, добавляют енолят бутанона, та же основная среда допускает внутримолекулярную циклизацию. Затем C=O путем восстановления превращается в –CH2. Полученный циклоалкен вскрывают озонолизом в Me 2 S. И снова циклизуют в щелочной среде с получением
МОБ 53 . Ретросинтетический анализ: начинается с одновременного отсоединения лактонов от
С другой стороны, бутанон получают из концевого ацетилена, а последний из этилгалогенида и ацетилена натрия.
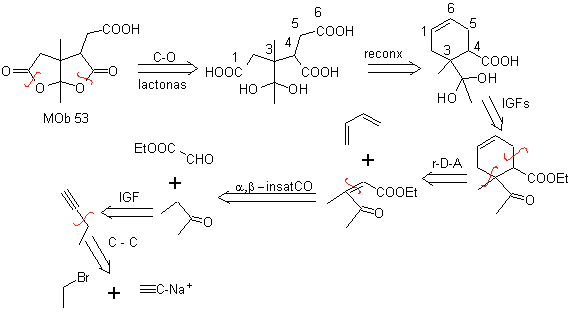
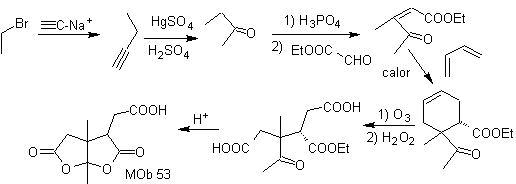
Синтез. После открытия циклогексена окислительным озонолизом, Кислотного гидролиза оставшейся сложноэфирной группы и соответствующего образования гидрата кетона достаточно для образования лактонов и соответствующего замыкания цикла, чтобы получить
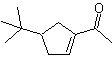
МОБ 54 . Ретросинтетический анализ : разрыв двойной связи
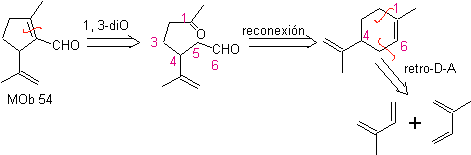
Синтез: Реакция Дильса-Альдера между двумя молекулами 2-метилбутадиена образует аддукт, который с HMCPBA образует эпоксид с наиболее реакционноспособным центром.
·
При кислотном гидролизе эпоксида образуется диол, который окисляется кислотой. периодическим, в сторону соединения 1,6-диСО.Группу СНО защищают енамином, активируя при этом его С альфа, для конденсации в кислой среде нагреваем систему и получаем
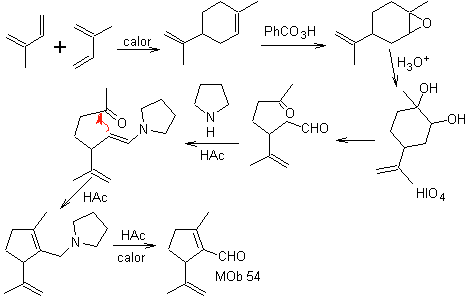
MOb 55. Ретросинтетический анализ : синтез
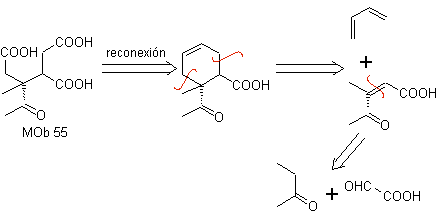
Синтез. Указанные реакции уже изучены при синтезе