PEMUTUSAN SENYAWA 1,6-DIOKSIGEN
Senyawa 1,6-difungsional lebih disukai menggunakan strategi rekoneksi untuk sintesisnya masing-masing; Strategi ini dapat dikombinasikan dengan sangat baik dengan reaksi Diels-Alder, yang umumnya menghasilkan adisi olefin beranggota enam, atau reduksi Birch dari cincin benzena, yang juga menghasilkan produk olefin beranggota enam.
1. senyawa 1,6-dioksigenasi
Reaksi yang menghasilkan senyawa dikarbonil, dengan berbagai kemungkinan kombinasi: diketon, asam keto, ketoaldehida, asam diasam, dll. Dan pada jarak yang berbeda satu sama lain, tidak diragukan lagi merupakan reaksi dari ozonolisis senyawa olefin.
Bergantung pada struktur substrat dan kondisi reaksi pada zat antara ozonida yang terbentuk, keragaman senyawa yang sangat besar akan dicapai sebagai hasil dari pembelahan ikatan rangkap olefinik. Dari jumlah tersebut, yang berada dalam rasio 1,6-dioksigenasi sangat menarik, seperti yang dapat disimpulkan dari operasi "penyambungan kembali" sintetik berikut:
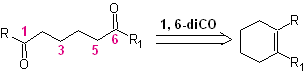
Cara terbaik untuk memahami pengoperasian "operasi rekoneksi sintetik" ini adalah akan dicapai melalui solusi sintesis molekul organik berikut:
MO 50
| MO 51
| MO 52
| ||
MO 53
| MO 54
| MO 55
|
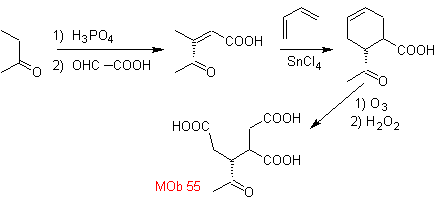
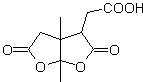
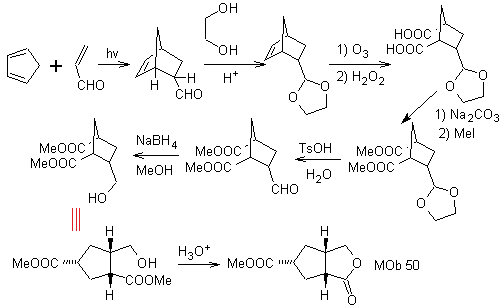
MOb 50 . Analisis retrosintetik : Pada contoh pertama, ia terputus oleh fungsi lakton molekul . Pada molekul prekursor yang dihasilkan, pada gilirannya, dapat dikatakan bahwa pembentukannya mungkin terjadi dari asam diakarboksilat pada posisi 1-6. Yang dihubungkan kembali untuk menimbulkan alkena yang menghasilkannya melalui reaksi ozonolisis oksidatif. Alkena yang terbentuk adalah adisi Diels-Alder yang khas antara siklopentadiena dan krotonaldehida.
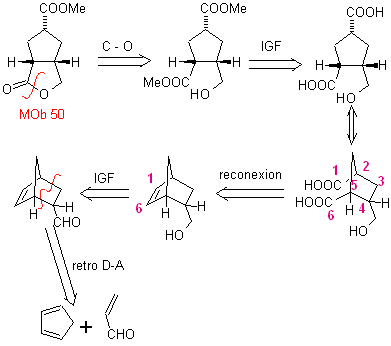
Sintesis: Reaksi Diels-Alder antara siplopentadiena dan aldehida tak jenuh α,β memberikan adisi alkena, untuk pembukaan yang sesuai dengan ozonolisis oksidatif, sebelum reaksi perlindungan gugus aldehida, yang kemudian dihilangkan perlindungannya, untuk direduksi menjadi fungsi alkohol. Alkohol ini bereaksi dengan gugus ester dalam media asam untuk membentuk lakton yang diinginkan, MOb 50
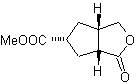
MOb 51 , Analisis retrosintetik : Se memproyeksikan molekul prekursor dari
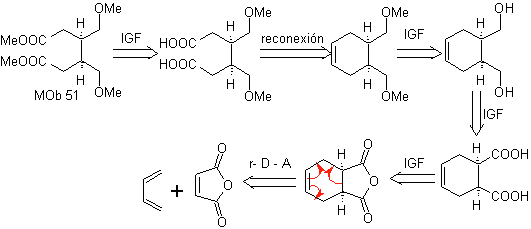
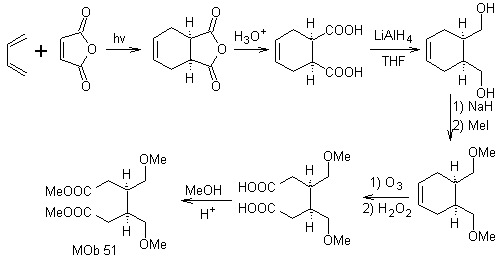
Perpaduan. Dengan reaksi Diels-Alder, adisi anhidrida siklik terbentuk, yang setelah dihidrolisis direduksi menjadi alkohol masing-masing, yang oleh Williamson diubah menjadi eter. Sikloheksena dibuka oleh ozonolisis oksidatif dan gugus asam bereaksi dalam media asam dengan metil alkohol untuk berubah menjadi
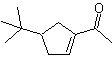
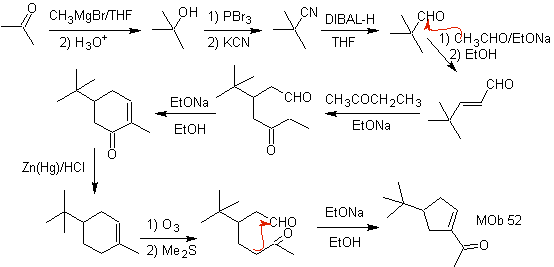
MOb 52 . Analisis retrosintetik: Awalnya terputus
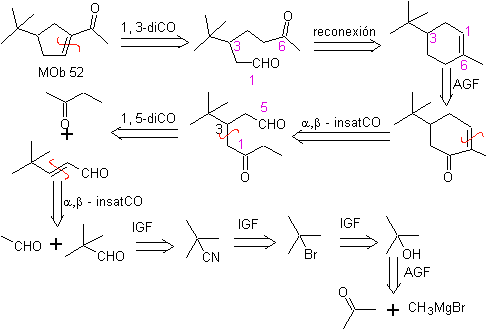
Sintesis : Aseton memungkinkan pembentukan zat antara t-Butilformaldehida, yang dalam medium basa dan etanol mengembun dengan etanal. Untuk produk, α, β-insat CO terbentuk, butanon enolat ditambahkan, media dasar yang sama memungkinkan siklisasi intramolekul. Kemudian C=O diubah menjadi –CH2, dengan reduksi. Sikloalkena yang dihasilkan dibuka oleh ozonolisis di Me 2 S. Dan disiklus lagi dalam media dasar untuk mendapatkan
MOb 53 . Analisis retrosintetik: Ini dimulai dengan pemutusan simultan lakton dari
Di sisi lain, butanon dibuat dari asetilena terminal dan yang terakhir dari etil halida dan natrium asetilena.
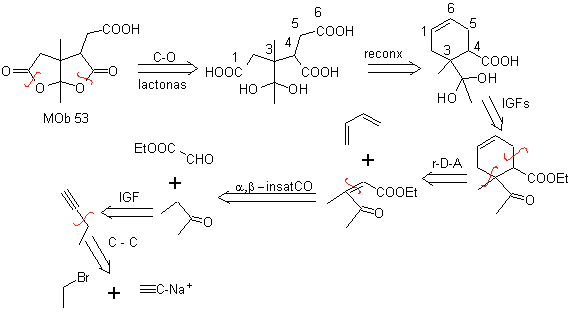
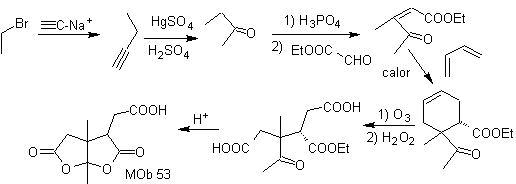
Perpaduan. Setelah pembukaan sikloheksena, dengan ozonolisis oksidatif, Hidrolisis asam dari gugus ester yang tersisa dan pembentukan keton hidrat yang sesuai cukup untuk pembentukan lakton dan masing-masing penutupan siklus, untuk menghasilkan
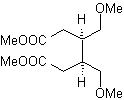
MOb 54 . Analisis retrosintetik : Pemutusan oleh ikatan rangkap dari
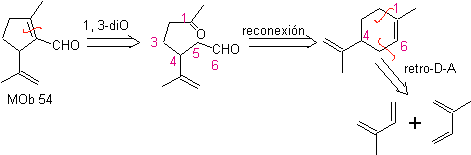
Sintesis: Reaksi Diels-Alder antara dua molekul 2-metil butadiena membentuk adukan yang dengan HMCPBA membentuk epoksida dengan pusat paling reaktif.
· Pada hidrolisis asam epoksida terbentuk diol yang dioksidasi oleh asam. periodik, menuju senyawa 1,6-diCO Gugus CHO dilindungi dengan enamina, sambil mengaktifkan C alfa, untuk kondensasi dalam media asam, sistem dipanaskan dan kami memperoleh
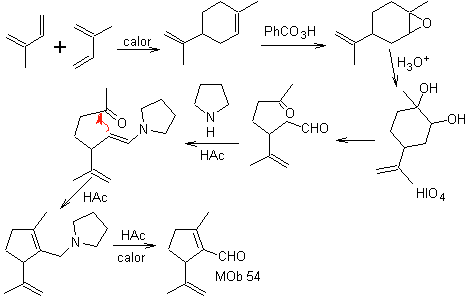
MOb 55. Analisis retrosintetik : Sintesis dari
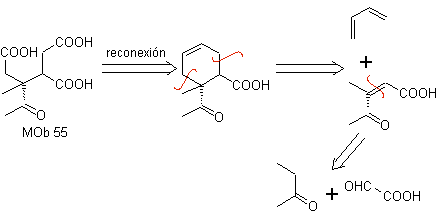
Perpaduan. Reaksi yang ditunjukkan telah dipelajari dalam sintesis