Die 1,6-difunktionalisierten Verbindungen verwenden vorzugsweise die Wiederverbindungsstrategie für ihre jeweilige Synthese; Diese Strategie kann sehr gut mit der Diels-Alder-Reaktion, die im Allgemeinen sechsgliedrige olefinische Addukte liefert, oder der Birch-Reduktion von Benzolringen, die ebenfalls sechsgliedrige olefinische Produkte erzeugt, kombiniert werden.
1.
1,6-dioxygenierte Verbindungen
Die Reaktion, die Dicarbonylverbindungen verschiedener möglicher Kombinationen erzeugt: Diketone, Ketosäuren, Ketoaldehyde, Disäuren usw. und in unterschiedlichen Abständen voneinander, ist zweifellos die Reaktion von Ozonolyse olefinischer Verbindungen.
Je nach Struktur des Substrats und den Reaktionsbedingungen am gebildeten Ozonid-Zwischenprodukt wird durch die Spaltung der olefinischen Doppelbindung eine enorme Verbindungsvielfalt erreicht. Von besonderem Interesse sind dabei diejenigen, die in einem 1,6-dioxygenierten Verhältnis vorliegen, wie aus der folgenden synthetischen „Wiederverbindungs“-Operation gefolgert werden kann:
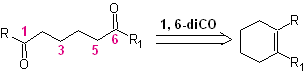
Der beste Weg, um die Funktionsweise dieser "synthetischen Wiederverbindungsoperation" zu verstehen, ist
wird durch die Lösung der Synthese der folgenden organischen Moleküle erreicht:
MB 50
| MB 51
| MB 52
| ||
MB 53
| MB 54
| MB 55
|
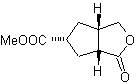
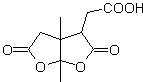
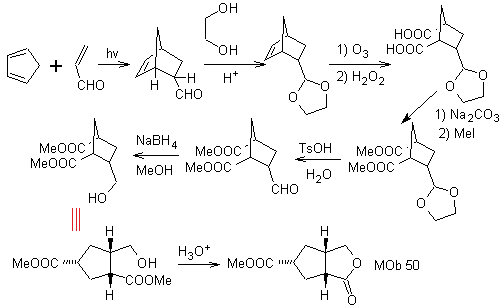
MB 50 . Retrosynthetische Analyse : In erster Linie wird es durch die Lactonfunktion des Moleküls getrennt. An dem erzeugten Vorläufermolekül wiederum kann argumentiert werden , dass seine Bildung möglicherweise aus der Diacarbonsäure in Position 1-6 erfolgt ist. Die wieder verbunden werden, um das Alken zu ergeben, das sie durch oxidative Ozonolysereaktion erzeugt hat. Das gebildete Alken ist ein typisches Diels-Alder-Addukt zwischen Cyclopentadien und Crotonaldehyd.
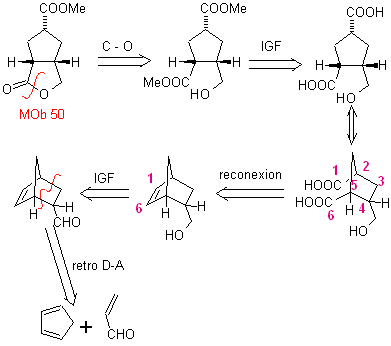
Synthese: Die Diels-Alder-Reaktion zwischen Cyclopentadien und der α,β-ungesättigte Aldehyd stellt das Alken-Addukt für seine entsprechende Öffnung durch oxidative Ozonolyse vor einer Schutzreaktion der Aldehydgruppe bereit, die anschließend entschützt wird, um zur Alkoholfunktion reduziert zu werden. Dieser Alkohol reagiert mit der Estergruppe in einem sauren Medium, um das gewünschte Lacton, MOb 50, zu bilden
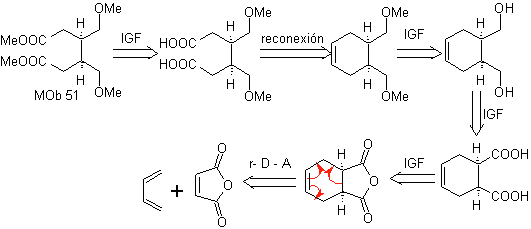
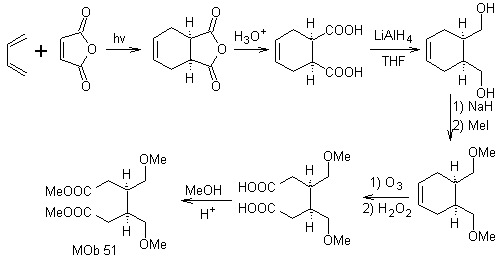
Synthese. Bei der Diels-Alder-Reaktion wird das zyklische Anhydrid-Addukt gebildet, das nach der Hydrolyse zum entsprechenden Alkohol reduziert wird, der von Williamson umgewandelt wird Äther. Das Cyclohexen wird durch oxidative Ozonolyse geöffnet und die Säuregruppen reagieren in einem sauren Medium mit dem Methylalkohol unter Umwandlung in
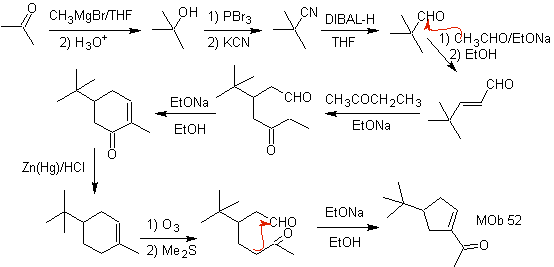
MB 52 . Retrosynthetische Analyse: Anfänglich getrennt
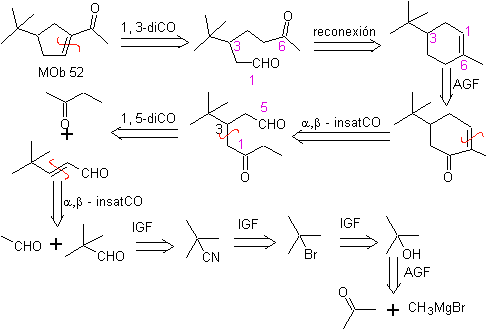
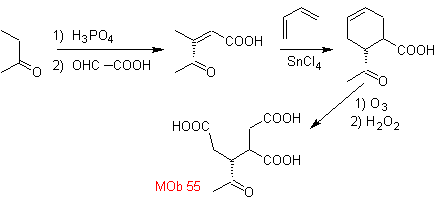
Synthese : Aceton ermöglicht die Bildung des Zwischenprodukts t-Butylformaldehyd, das in basischem Medium und Ethanol mit Ethanal kondensiert. Zu dem gebildeten Produkt α,β-insat CO wird das Butanonenolat gegeben, das gleiche basische Medium ermöglicht eine intramolekulare Cyclisierung. Dann wird das C=O durch Reduktion in –CH2 umgewandelt. Das hergestellte Cycloalken wird durch Ozonolyse in Me 2 S geöffnet. Und es wird erneut in einem basischen Medium cyclisiert, um es zu erhalten
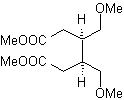
MB 53 . Retrosynthetische Analyse: Sie beginnt mit der gleichzeitigen Abspaltung der Lactone aus
Andererseits wird Butanon aus einem endständigen Acetylen und letzteres aus einem Ethylhalogenid und Natriumacetylen hergestellt.
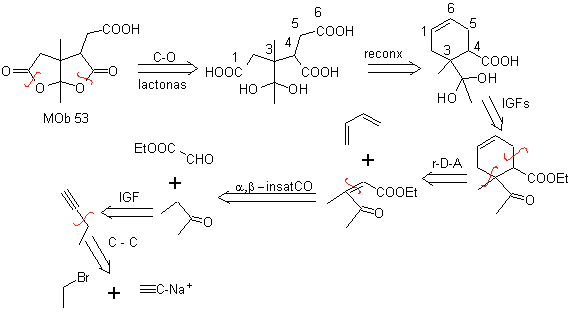
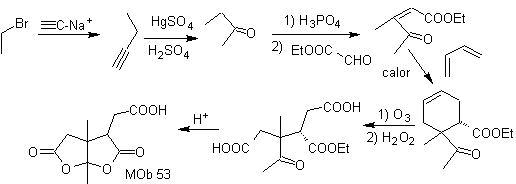
Synthese. Nach der Öffnung des Cyclohexens durch oxidative Ozonolyse Die saure Hydrolyse der verbleibenden Estergruppe und die entsprechende Bildung des Ketonhydrats reicht aus, um die Bildung der Lactone und den jeweiligen Kreislaufschluss herzustellen
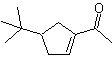
MB 54 . Retrosynthetische Analyse : Die Trennung durch die Doppelbindung von
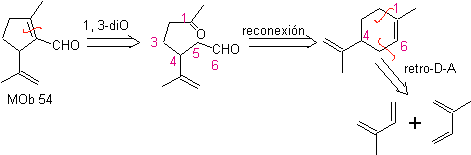
Synthese: Die Diels-Alder-Reaktion zwischen zwei Molekülen 2-Methylbutadien bildet ein Addukt, das mit HMCPBA ein Epoxid mit dem reaktivsten Zentrum bildet.
·
Bei der Säurehydrolyse des Epoxids wird ein Diol gebildet, das durch Säure oxidiert wird. periodisch zu einer 1,6-diCO-Verbindung Die CHO-Gruppe wird mit einem Enamin geschützt, während ihr C alpha aktiviert wird, für eine Kondensation in einem sauren Medium wird das System erhitzt und wir erhalten
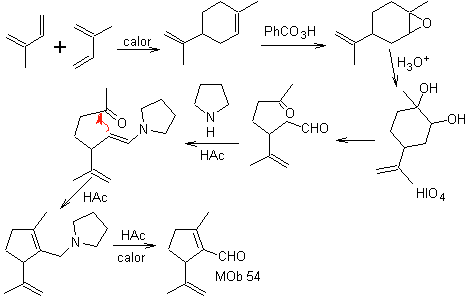
MOb 55. Retrosynthetische Analyse : Die Synthese von
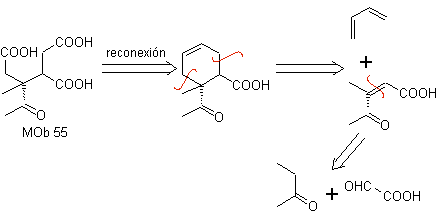
Synthese. Die angegebenen Reaktionen wurden bereits bei der Synthese von untersucht