Risonanza magnetica nucleare
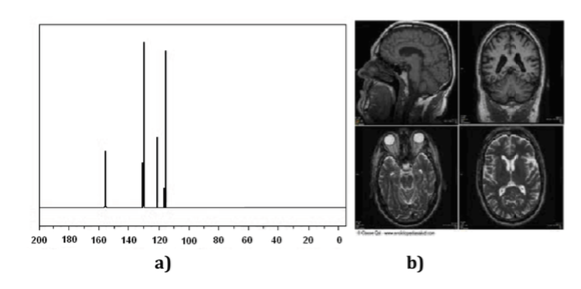
Le tecniche di Risonanza Magnetica Nucleare (NMR) sono uno strumento indispensabile per la chimica così come per altre branche della Scienza. Con la spettroscopia NMR è possibile identificare le molecole (figura uno spettro), determinarne la struttura o studiare i processi dinamici. Ad esempio, è stato fondamentale per determinare la struttura delle proteine in soluzione e, d'altra parte, le tecniche di imaging NMR sono uno strumento indispensabile nella diagnosi medica, come illustrato nella (Figura b).
NMR si basa su tre elementi:
a) Il carattere magnetico dei nuclei delle molecole studiate:
Molti nuclei atomici, a causa dello spin nucleare, hanno caratteristiche magnetiche. In un certo senso si può ritenere che i nuclei si comportino come piccoli magneti.
b) L'applicazione di un campo magnetico intenso:
Quando le molecole studiate sono immerse in un campo magnetico, i livelli nucleari si dispiegano in vari livelli energetici. Ciascuno dei livelli energetici che appaiono corrispondono a diversi orientamenti degli spin dei nuclei (piccoli magneti) rispetto al campo magnetico.
c) Illuminazione del campione con radiazione elettromagnetica:
Come in altre tecniche spettroscopiche, l'illuminazione del campione con l'adeguata frequenza di radiazione farà passare i nuclei da un livello all'altro. La frequenza della radiazione necessaria per produrre questo salto di livello dipenderà dal tipo di nucleo, dal suo ambiente chimico, dal tipo di nuclei presenti nelle sue vicinanze e dal campo esterno applicato. Nel corso di questo argomento si studieranno i fondamenti fisici di questa tecnica, e si spiegheranno le tecniche sperimentali che permettono di ottenere gli spettri, analizzando anche le cause che rendono differenti gli spettri delle varie molecole.
Nozioni di base sull'NMR:
Spin nucleare e momento angolare dello spin nucleare
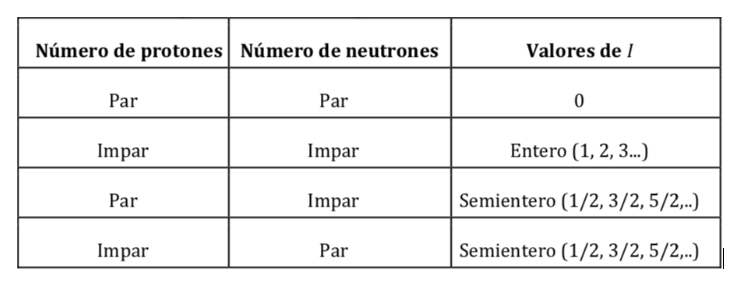
I nuclei atomici sono formati da protoni e neutroni. Entrambi i nucleoni hanno momento angolare orbitale e momento angolare di spin (sia i protoni che i neutroni hanno spin 1/2). La risultante della somma vettoriale di tutti i momenti (orbitali e di spin) di tutti i protoni e neutroni del nucleo dà come risultato il momento angolare di spin nucleare ed è simboleggiato da I e le sue unità sono J s. Secondo la meccanica quantistica, la grandezza del momento angolare di spin nucleare, |I|, è quantizzata, con un valore I(I+1)h dove I è il numero quantico di spin nucleare o spin nucleare e ħ è h/2p(che nel sistema internazionale vale 1,05457·10-34J·s). Il valore di I è una caratteristica fissa di ogni tipo di nucleo atomico e può assumere un valore intero o semiintero (0,1, 2, 3,…½ , 3/2 , 5/2…).
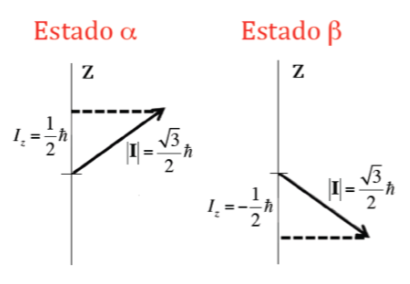
Oltre al modulo, è importante conoscere anche la componente del momento angolare attorno all'asse z, Iz. Questo può assumere anche valori quantizzati dati dall'espressione m I h dove m I è il numero quantico associato alla componente z del momento angolare di spin nucleare e che può assumere i seguenti valori: –I, (‐I+1) , ... , (I-1), I. Quindi, per un dato nucleo, di valore I, esistono (2I+1) orientamenti del momento angolare di spin nucleare. Si consideri ad esempio il nucleo atomico dell'isotopo più comune dell'atomo di idrogeno, 1H, che è formato da un protone ed è noto che il suo spin nucleare, I , è 1/2, e quindi m I può assumere due valori +1/2 e -1/2 (in NMR l'isotopo 1H è spesso indicato come un protone). Il protone ha quindi due possibili stati nucleari, uno detto a con m I =+1/2 e l'altro b con m I =‐1/2. La figura sottostante mostra i due possibili orientamenti del momento angolare di spin nucleare corrispondenti agli stati a e b, che sono energeticamente equivalenti.
Valori di I in base al numero di protoni e neutroni nel nucleo:
Proprietà magnetiche di vari nuclei:
Momento di dipolo magnetico nucleare (magnetone nucleare, rapporto giromagnetico):
Proprio come l'elettrone ha un momento di dipolo magnetico, alcuni nuclei atomici, ma non tutti, hanno un momento di dipolo magnetico. Come indicato, i nuclei si comportano come piccoli magneti, essendo l'origine di questo carattere magnetico il momento angolare dello spin nucleare. Il momento angolare di spin nucleare, I, dà origine a un momento di dipolo magnetico nucleare mI che è dato da:
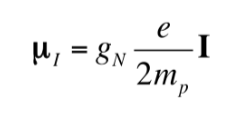
dove gN è il fattore g nucleare. Si noti che questa espressione usa la massa e la carica del protone (mp ye) per definizione, invece della massa e della carica del nucleo in questione. Le differenze da un nucleo all'altro sono incluse nel fattore gN nucleare. Il valore di gN non può essere ottenuto teoricamente, quindi è determinato sperimentalmente. Le unità di mI sono JT-1
La relazione tra mI e I può anche essere espressa come segue:
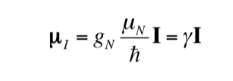
con
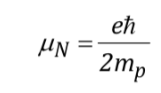
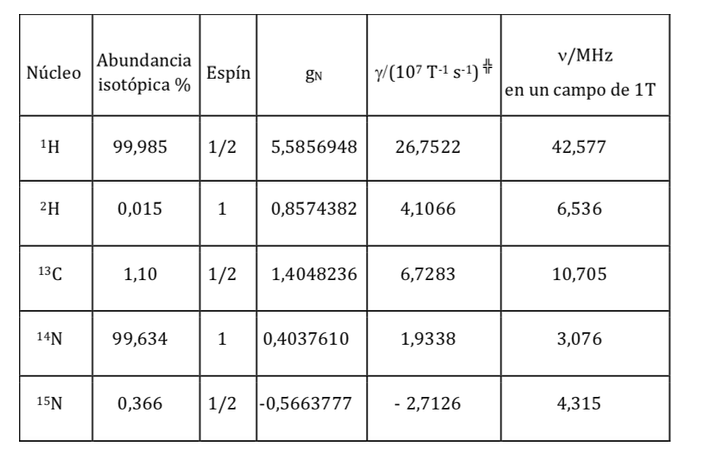
essendo una costante con un valore di 5.050 10-27J T-1 detto magnetone nucleare e g è il rapporto giromagnetico (T-1s-1).Nelle tabelle precedenti erano già stati riportati valori di queste magnitudini per alcuni isotopi. Sebbene nella maggior parte dei casi mI e I abbiano lo stesso senso, a volte è opposto, come si può dedurre dai valori negativi del fattore gN e g per l'isotopo 15N, ad esempio.
Nel caso del protone dove si erano viste due possibili orientazioni del momento angolare, si avranno due possibili orientazioni del momento magnetico dipolare, come illustrato nella figura seguente, entrambe le orientazioni essendo energeticamente equivalenti, poiché la scelta di una direzione z è arbitrario.
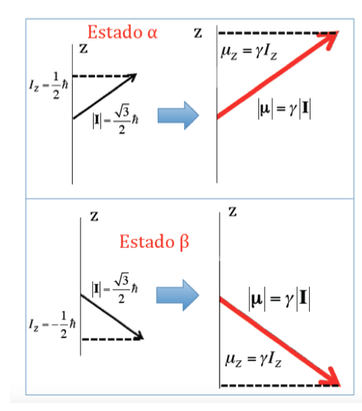
Energia di interazione del campo magnetico con il momento magnetico nucleare:
Se una molecola viene introdotta in un campo magnetico, con densità di flusso o campo magnetico B, il momento magnetico di dipolo di ciascuno dei suoi nuclei interagirà con essa, come illustrato nella figura seguente, l'energia dell'interazione essendo espressa da:
![]()
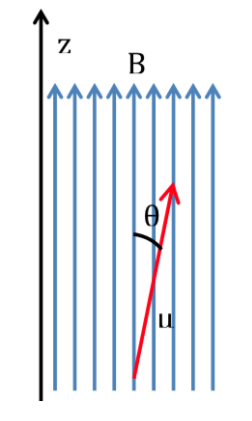
Secondo la fisica classica, sono consentiti tutti gli orientamenti di un dipolo magnetico all'interno di un campo magnetico e quindi q può assumere qualsiasi valore compreso tra 0 e 180o. A seconda dell'orientamento del dipolo, l'energia sarà maggiore o minore:
L'interazione più favorevole si verifica quando entrambe le grandezze hanno la stessa direzione: q=0 e quindi cos q=1 e :
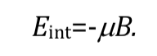
Tuttavia, secondo la meccanica quantistica, non sono consentiti tutti gli orientamenti del dipolo magnetico nucleare, gli orientamenti sono quantizzati e sono possibili solo determinati valori di q. Sono ammessi tanti orientamenti quanti sono i valori di Iz o mI (‐I, ‐I+1,..., I‐1, I) cioè orientamenti 2I+1. Ovviamente il numero di orientazioni del momento di dipolo varia con il tipo di nucleo atomico. Per definire gli orientamenti si prende come riferimento per l'asse Z la direzione e la direzione del campo B.
Quindi l'energia di interazione del campo magnetico esterno B e del dipolo nucleare sarà data da: j
Frequenza di Langmor
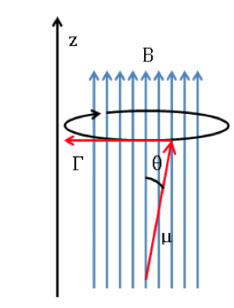
Se sul nucleo agisce un campo magnetico esterno di intensità B, il dipolo magnetico nucleare subisce una coppia di forze come mostrato nella seguente formula data da:
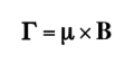
che tende ad allineare il dipolo con il campo magnetico. Poiché il dipolo magnetico non può essere allineato con il campo magnetico, il sistema non è in grado di dissipare questa energia e le precessioni, chiamate precessioni di Larmor, in
sulla direzione del campo applicato. La frequenza di questa precessione è chiamata frequenza di Larmor, con un valore:
schema langmor:
Spettroscopia NMR
La chiave di ogni tecnica spettroscopica si basa sulla possibilità che la molecola in studio possa trovarsi a più di un livello energetico, in modo tale che facendosi influenzare da radiazioni elettromagnetiche (rem) di frequenza opportuna, possa passare nel nostro sistema (molecola) da un livello energetico a un altro. Come visto nella sezione precedente, il nucleo di un protone, immerso in un campo magnetico, può occupare due diversi livelli associati allo spin nucleare, facendo così cadere un raggio rem di opportuna frequenza su un nucleo 1H che sta occupando il livello inferiore, può essere passato al livello superiore. Questo tipo di transizioni è ciò che dà origine alla spettroscopia di risonanza magnetica nucleare (NMR). D'ora in poi ci concentreremo sul caso del protone 1H, in quanto è la spettroscopia più utilizzata, anche se tutto quanto indicato è applicabile ad altri nuclei. In effetti, vengono utilizzate sempre più varietà di core.
Frequenza di risonanza:
La frequenza che provoca la transizione si ottiene applicando la condizione di risonanza:
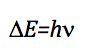
Poiché la differenza di energia tra due livelli consecutivi è:
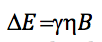
uguagliando entrambe le espressioni e isolando n:
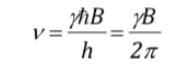
che, come si vede, coincide con la frequenza della precessione di Larmor.
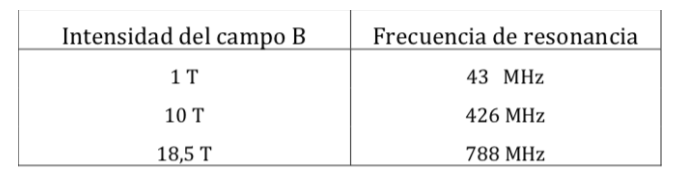
Frequenze di risonanza NMR protoniche per varie intensità di campo:
Regole di selezione:
Le regole di selezione studiate in altre spettroscopie corrispondono all'interazione del dipolo elettrico con il campo elettrico della radiazione. In NMR, invece, avviene l'interazione tra il dipolo magnetico del nucleo e il campo magnetico variabile della radiazione. Per determinare le regole di selezione occorre ricordare l'espressione generale che determina la probabilità di passaggio tra due stati:
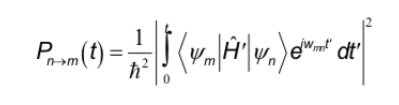
L'Hamiltoniana, in questo caso, è il prodotto dell'operatore del campo magnetico oscillante della radiazione per l'operatore del momento di dipolo del nucleo.
![]()
Si può dimostrare che affinché vi sia una transizione tra due livelli la regola di selezione corrispondente è:
m io = ± 1
Potenza del segnale (livelli di popolazione):
L'intensità del segnale è direttamente correlata alla popolazione dei livelli coinvolti nella transizione. Secondo la legge di distribuzione di Boltzman, per un sistema a due livelli, come il protone, il rapporto tra la popolazione del livello superiore, Nb, e la popolazione del livello inferiore, Na, è dato da:
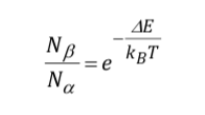
Descrizione dell'apparecchiatura NMR:
Quale procedura sperimentale viene utilizzata per ottenere lo spettro? Generalmente in spettroscopia si varia la frequenza della radiazione incidente, fino a che non si osserva l'assorbimento. Tuttavia, nella spettroscopia NMR c'è anche la possibilità di mantenere fissa la frequenza di radiazione e variare la distanza tra i livelli, variando l'ampiezza del campo B applicato finché non si osserva l'assorbimento. Nella figura seguente in cui è presentato uno schema di un'apparecchiatura NMR. Il campione viene posto in un tubo, che a volte viene ruotato rapidamente per ottenere l'omogeneizzazione del segnale, sebbene l'uso della rotazione sia attualmente in discussione, poiché può introdurre errori. Il tubo, a sua volta, si trova tra due poli magnetici che sono quelli che generano il campo magnetico. C'è un trasmettitore e un ricevitore di radiofrequenza. Il segnale dell'emettitore può essere controllato per eseguire uno sweep di frequenza. Con le bobine di scansione è possibile controllare una scansione del campo. Le attuali apparecchiature NMR quasi non utilizzano più:
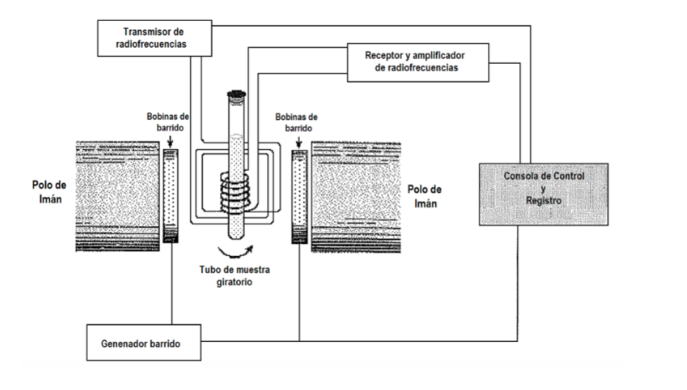
procedure precedenti, ma si basano sull'uso di tecniche di trasformata di Fourier. B viene tenuto fermo e il campione viene illuminato con un impulso a radiofrequenza limitato nel tempo ad alta potenza con frequenza nrad, un valore fisso nell'intervallo di frequenza NMR del tipo di nucleo studiato. L'impulso dura diversi microsecondi, quindi può essere dimostrato matematicamente da una tecnica chiamata analisi di Fourier che l'impulso a radiofrequenza è equivalente a un intervallo di frequenze ∆n attorno a nrad ed eccita tutte le possibili risonanze NMR. Il segnale osservato nel rivelatore conterrà tutte le frequenze di risonanza e viene analizzato da un computer utilizzando tecniche di trasformata di Fourier. Questa procedura consente una risoluzione molto elevata e lavorare con nuclei che con le procedure precedenti avevano segnali molto deboli.
Schermatura nucleare:
Nella risonanza magnetica vengono utilizzati nuclei con momento angolare di spin diverso da zero, come 1H e 13C. Tuttavia, le frequenze di risonanza non sono le stesse per tutti i nuclei di idrogeno o carbonio, dipendono dall'ambiente chimico che circonda ciascun nucleo. Questo è dovuto al fatto che gli elettroni che circondano ogni nucleo generano un campo magnetico che si oppone a quello applicato, si dice che i nuclei sono schermati, dove σ è la costante di schermatura.
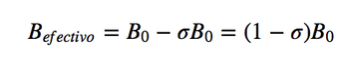
Bef è il campo magnetico netto che agisce sul protone; B0 è il campo magnetico applicato; σ è la costante di schermatura, indipendente dal campo applicato. In questa nuova situazione, con i nuclei schermati dalla densità elettronica che li circonda, la frequenza di risonanza diventa
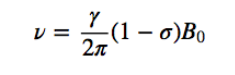
I nuclei con ambienti chimici diversi hanno una costante di schermatura diversa, generando segnali diversi nello spettro NMR.
spettro dell'etanolo:
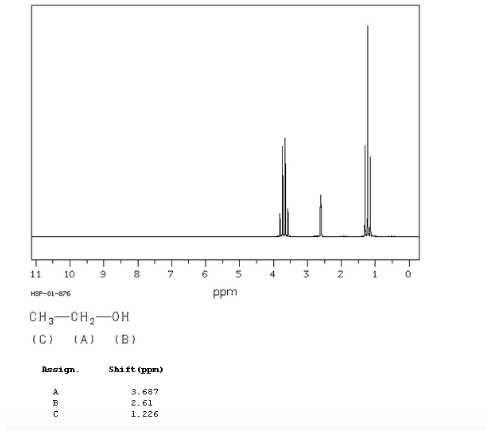
Nello spettro NMR dell'etanolo si osservano tre diversi segnali, dovuti all'esistenza di 3 tipi di idrogeni con differenti ambienti chimici. Gli idrogeni A sono più non schermati di C a causa della presenza di ossigeno (atomo elettronegativo che rimuove la densità elettronica). Anche l'ambiente chimico dell'idrogeno B, direttamente attaccato all'ossigeno, è diverso, risuonando a una frequenza diversa dalle precedenti.
spostamento chimico
I segnali nello spettro NMR sono misurati su una scala indipendente dal campo magnetico applicato, chiamato spostamento chimico e rappresentato dalla lettera δ. Indipendentemente dal campo magnetico a cui lavora lo spettrofotometro, i segnali di un composto chimico si ottengono sempre agli stessi valori di δ:

Tabella degli spostamenti:
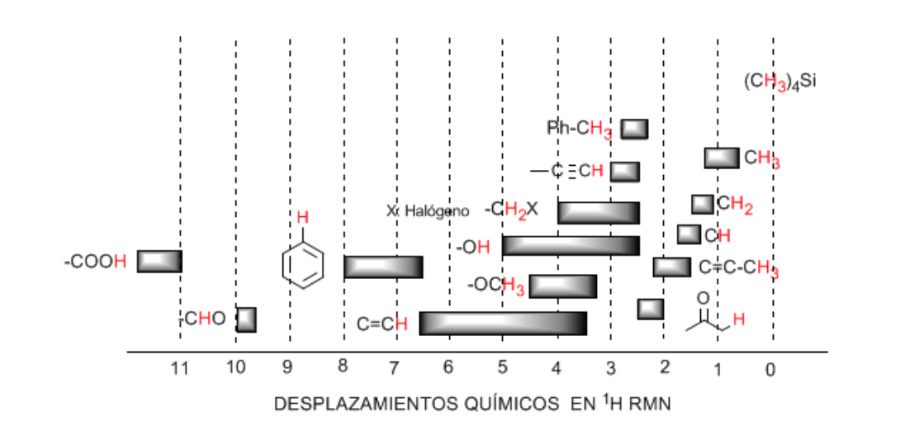
Gli idrogeni situati sulle catene alifatiche presentano valori δ prossimi a 1. Questo aumenta leggermente quando si passa da carboni primari a secondari o terziari.
Gli idrogeni allilici si trovano tra 1,5 e 2,1.
Gli idrogeni alfa rispetto ai carbonili e ai derivati acidi sono compresi tra 2 e 2,5.
Gli idrogeni benzilici tra 2,3 e 2,7.
L'idrogeno degli alchini terminali tra 2,5 e 3.
Idrogeni attaccati ai carboni con alogeni tra 2,5 e 4 a seconda dell'elettronegatività dell'alogeno
Gli idrogeni del gruppo idrossile tra 2,5 e 5. Intervallo molto ampio dovuto alla formazione di legami idrogeno.
Idrogeni di carbonio attaccati all'ossigeno di tipo etere tra 3,3 e 4,5.
Idrogeni olefinici tra 3,5 e 6,5.
Idrogeni legati a sistemi aromatici tra 6,5 e 8.
Idrogeno aldeidico 9,5-10
Idrogeno dal gruppo dell'acido carbossilico superiore a 11.
I gruppi elettronegativi deschermano i nuclei:
I sostituenti elettronegativi rimuovono la densità elettronica, non schermando gli idrogeni e spostano il segnale verso valori δ elevati.
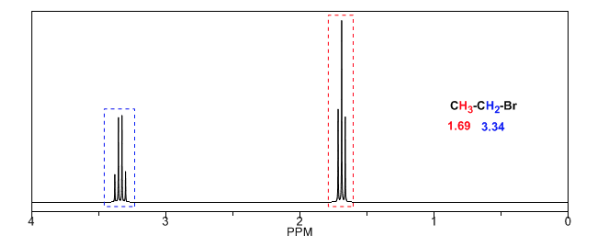
Nella tabella seguente puoi vedere l'influenza di diversi atomi sul segnale degli idrogeni metilici.
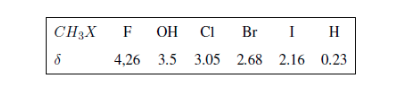
Nei seguenti spettri si possono osservare i suddetti effetti sugli spostamenti chimici.
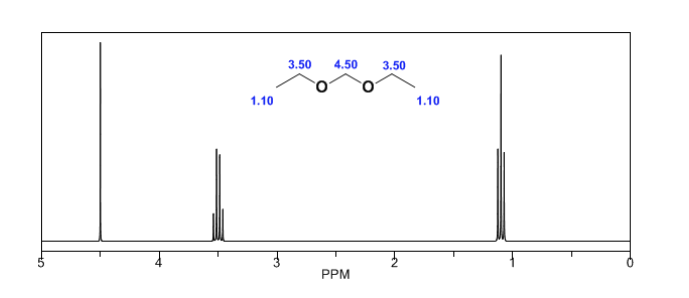
Anisotropia magnetica:
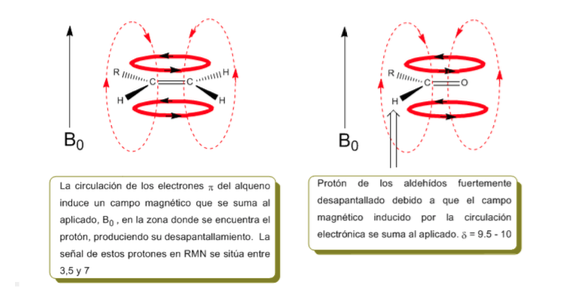
I protoni vicini ai doppi legami e agli anelli aromatici sono particolarmente non schermati a causa del campo magnetico indotto dalle correnti elettroniche di questi sistemi. Il campo indotto si somma a quello applicato, producendo uno spostamento maggiore del previsto.
Nell'immagine seguente possiamo vedere la circolazione elettronica (curve in grassetto) e il campo magnetico indotto (linee tratteggiate) per un alchene e un carbonile. Si osservi come nella regione del protone il campo magnetico indotto abbia la stessa direzione e verso di quello applicato.
Una situazione simile si osserva nel caso del benzene. Tuttavia, negli alchini, la circolazione elettronica induce un campo magnetico che si oppone a quello applicato nell'area del protone. Gli idrogeni acetilenici sono schermati con segnali nello spettro NMR a bassi offset.
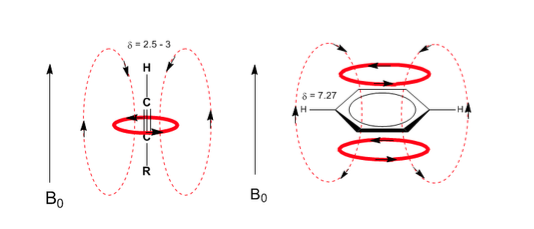
Si osservi come i campi indotti aumentino notevolmente gli spostamenti del protone olefinico, influenzando anche le posizioni alliliche.
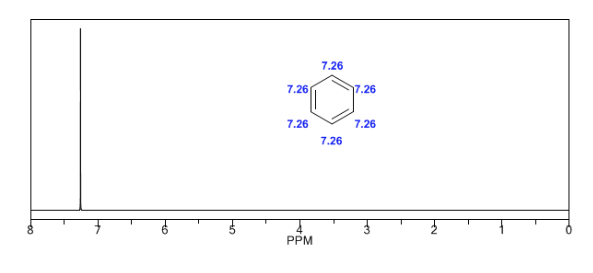
Gli idrogeni aromatici sono fortemente non schermati a causa del campo indotto dalle correnti anulari.
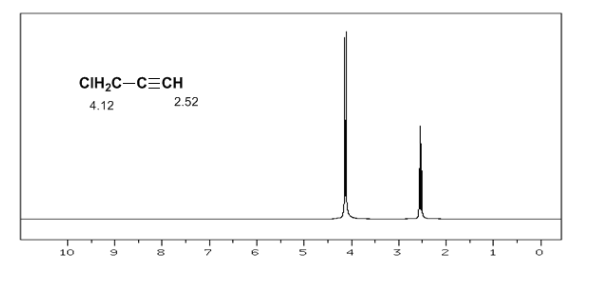
L'idrogeno acetilenico ha un basso spostamento, perché le correnti producono un campo magnetico che si oppone a quello applicato.
I più comuni spostamenti di idrogeno acido nelle molecole organiche sono:
- ·Acidi carbossilici (RCOOH) δ= 10 - 12 ppm
- ·Ammine (R−NH2) δ= 0,5 - 5 ppm
- Ammidi (RCONH2) δ= 5-8 ppm
- ·Alcoli (ROH) δ= 0,5 - 5 ppm
- Fenoli (Ph-OH) δ= 4 - 7 ppm
Accoppiamento spin-spin:
L'informazione strutturale dell'NMR deriva da due fattori: i diversi spostamenti osservati a seconda dell'ambiente chimico che circonda il protone e l'accoppiamento tra gli spin dei protoni vicini, che produce la scissione dei segnali.
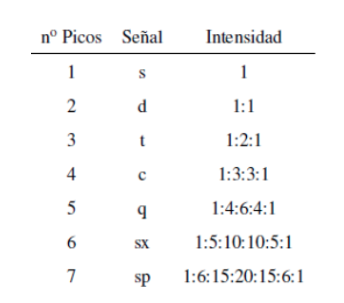
Sebbene alcuni segnali nello spettro siano singoli picchi, è comune trovare segnali composti da più picchi molto ravvicinati, che vengono denominati con la seguente notazione: singoletto (s), doppietto (d), tripletto (t), quadrupletto (c) , quintuplet ( q), sestuplet (sx) e septuplet (sp), i segnali complessi sono designati come multiplet. Il valore di δ di questi segnali è assegnato al loro centro, a meno che il multipletto non sia irregolare, nel qual caso è indicato l'intervallo.
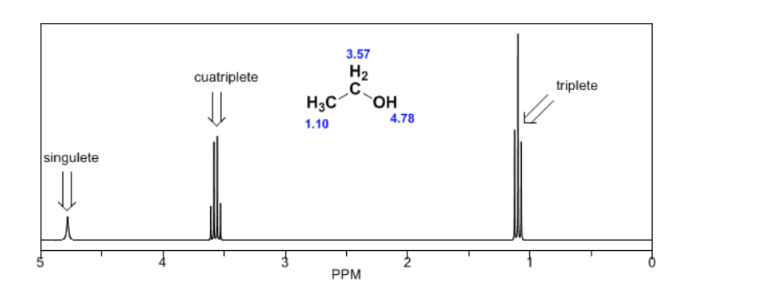
Nello spettro dell'etanolo si può vedere che l'idrogeno idrossilico produce un singoletto, la coppia di idrogeni sul carbonio uno dà origine a un quadruplo, ei tre idrogeni sul carbonio due producono una tripletta.
Spiegazione dell'accoppiamento spin-spin.
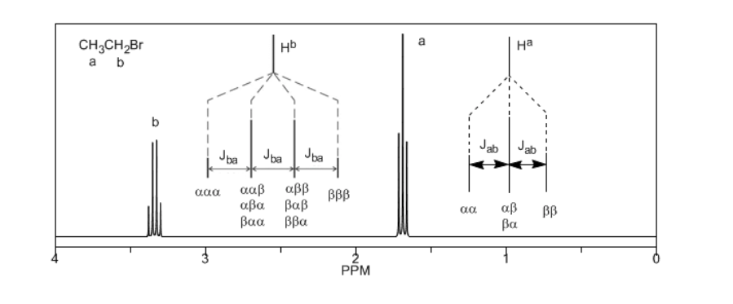
Per comprendere lo sdoppiamento dei segnali dovuto all'accoppiamento spin-spin studieremo lo spettro dell'1,1-dicloro-2,2-difeniletano ( Cl 2 CH a CH b Ph 2 ).
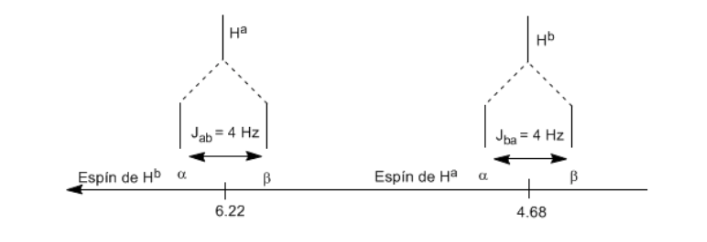
Il protone Ha sottoposto ad un campo magnetico B0 produce un segnale a δa=6.22ppm. Tuttavia, il protone Hb genera un piccolo campo magnetico che influenza il protone Ha. Circa la metà delle molecole ha il protone Hb allineato con il campo applicato (spin alfa) e l'altra metà lo ha orientato contro il campo (spin beta). . Quando Hb ha spin α, Ha è soggetto a un campo leggermente più grande e risuona a una frequenza più alta (δ leggermente più alta). Quando Hb ha spin β, Ha è soggetto a un campo leggermente più piccolo e risuona a una frequenza inferiore (δ leggermente inferiore), che divide il picco iniziale in due segnali separati da una distanza di 4 Hz, chiamata costante di accoppiamento (J). Questo stesso ragionamento può essere fatto per il protone Hb.
Infine, discuteremo l'accoppiamento di un protone con tre protoni vicini equivalenti. In questo caso si osserva un segnale composto da quattro picchi (quadtripletto). I picchi centrali sono tre volte più intensi dei picchi estremi.
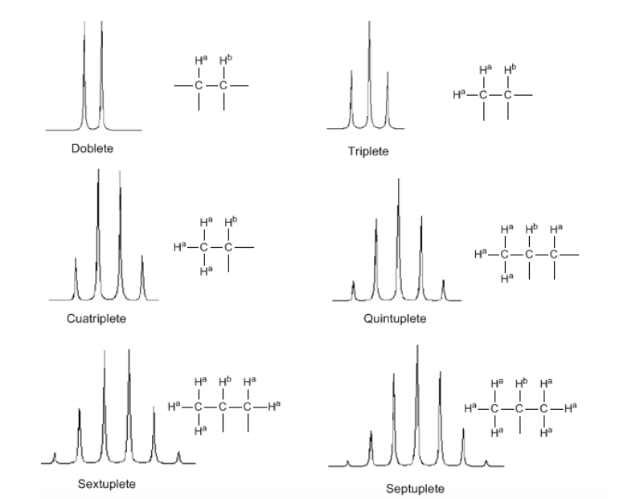
Regola N+1
Dalla discussione precedente si può dedurre che un protone produce un segnale con un numero di picchi un'unità maggiore del numero di idrogeni vicini. Nell'immagine seguente possiamo vedere i picchi prodotti da un idrogeno Hb quando accoppiato con un numero variabile di idrogeni
L'intensità dei picchi di un segnale è data dal triangolo di Pascal (Tartaglia):
Due considerazioni devono essere prese in considerazione quando si applica la regola N+1:
- Nelle molecole del tipo A−CHa2−CHb2−CHa2−A i protoni Hb appaiono come un quintuplo.
- Nelle molecole del tipo A−CH2−CH2−A, i quattro protoni sono equivalenti e danno un singoletto.
Accoppiamento di tre nuclei non equivalenti:
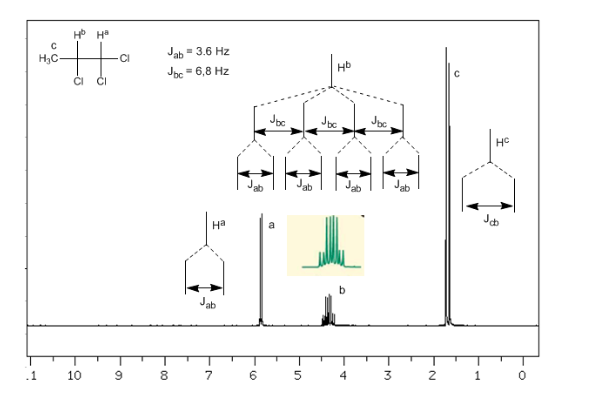
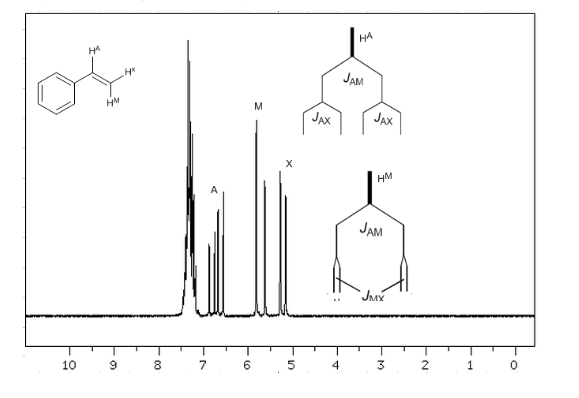
Tenendo conto che l'ordine delle costanti di accoppiamento negli alcheni è Jtrans>Jcis>Jgeminal, gli alberi di accoppiamento per gli idrogeni Ha e HM sono quelli indicati nello spettro. Saresti in grado di disegnare l'albero per Hx?
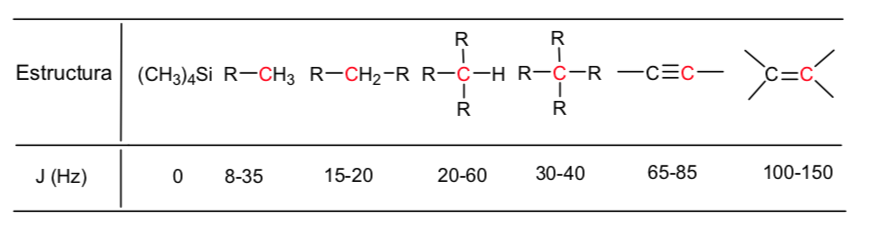
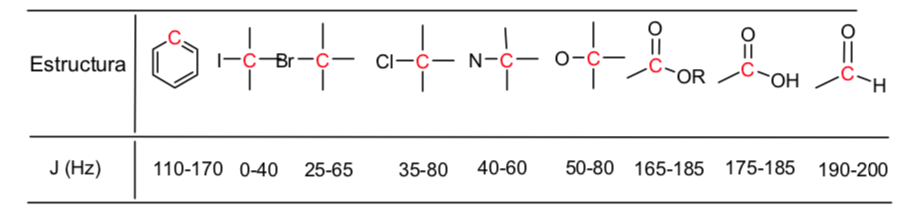
Risonanza magnetica nucleare 13C
La risonanza magnetica nucleare di 13C è complementare a quella di 1H. Quest'ultima tecnica viene utilizzata per dedurre la struttura dello scheletro di carbonio osservando gli ambienti magnetici degli atomi di idrogeno, mentre la spettroscopia 13C NMR determina l'ambiente magnetico degli atomi di carbonio.
Gli spostamenti chimici del carbonio sono da 15 a 20 volte maggiori di quelli dell'idrogeno perché il carbonio è direttamente attaccato agli atomi che sono schermati o non schermati. Ad esempio, il protone di un'aldeide assorbe a 9,4 ppm nello spettro 1H mentre il carbonio carbonilico assorbe a 180 ppm nello spettro 13C.
Inoltre, i segnali nello spettro 13C sono linee verticali, cioè non ci sono divisioni spin-spin. Questo perché solo l'1% degli atomi di carbonio entra in risonanza, e quindi c'è una probabilità molto piccola che un nucleo 13C sia adiacente ad un altro nucleo 13C.
Di seguito è riportata una tabella dei valori approssimativi degli spostamenti chimici in uno spettro di risonanza magnetica nucleare 13C:
Riferimenti consigliati per ampliare la ricerca:
1. Spettroscopia di emissione Aga Fano SA. (Consultato il 10 settembre 2007). http://hiq.aga.com.co/International/Web/LG/CO/likelgspgco.nsf/DocByAlias/anal_icp .
2. Alonso, P. et al. chimica Cou..Ed. McGraw Hill. 1990.
3. Álvarez Jiménez, MD e Gómez del Río, MI Guida Didattica Chimica Analitica II. UNED. 1999.
4. Arrivi Jimeno Sirò; Burriel Barceló Fernando; Hernandez Mendez Gesù; Lucena Conte Felipe. Chimica analitica qualitativa. ISBN: 8497321405. ISB. 2006.
5. Ayres, Gilbert H. Analisi chimica quantitativa. Edizioni del Castello, 4a ed . ISBN: 8421902806. 1981.
6. Bermejo Barrera. M. del Pilar. Chimica analitica generale, quantitativa e strumentale. Editoriale Paraninfo. 7a edizione. ISBN: 8428318093. 1990.
7. Blanco, M., Cerdá, V. e Sanz Medel, A., spettroscopia atomica analitica, pubblicazioni universitarie Autonoma di Barcellona. 1990.
8. Brodo. RW, spettroscopia chimica, New York 1952.
9. Burriel, MF, Lucena, CF. Chimica analitica quantitativa. Edizione rivoluzionaria. L'Avana.1978.
10. Burriel, F. Chimica analitica qualitativa. Editoriale Paraninfo. ISBN: 8497321405. pp 1072. , 2003.