Résonance magnétique nucléaire
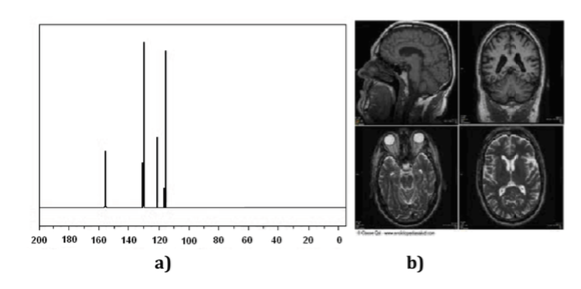
Les techniques de résonance magnétique nucléaire (RMN) sont un instrument indispensable pour la chimie ainsi que pour d'autres branches de la science. Avec la spectroscopie RMN, on peut identifier des molécules (Figure un spectre), déterminer leur structure ou étudier des processus dynamiques. Par exemple, il a joué un rôle clé dans la détermination de la structure des protéines en solution et, d'autre part, les techniques d'imagerie RMN sont un outil indispensable dans le diagnostic médical, comme illustré dans (Figure b).
La RMN est basée sur trois éléments :
a) Le caractère magnétique des noyaux des molécules étudiées :
De nombreux noyaux atomiques, dus au spin nucléaire, ont des caractéristiques magnétiques. D'une certaine manière on peut considérer que les noyaux se comportent comme de petits aimants.
b) L'application d'un champ magnétique intense :
Lorsque les molécules étudiées sont immergées dans un champ magnétique, les niveaux nucléaires se déploient en différents niveaux d'énergie. Chacun des niveaux d'énergie qui apparaissent correspond à des orientations différentes des spins des noyaux (petits aimants) par rapport au champ magnétique.
c) Illumination de l'échantillon avec un rayonnement électromagnétique :
Comme dans d'autres techniques spectroscopiques, l'illumination de l'échantillon avec la fréquence de rayonnement adéquate fera passer les noyaux d'un niveau à un autre. La fréquence du rayonnement nécessaire pour produire ce saut de niveau dépendra du type de noyau, de son environnement chimique, du type de noyaux présents à son voisinage et du champ extérieur appliqué. Tout au long de ce sujet, les fondements physiques de cette technique seront étudiés et les techniques expérimentales permettant d'obtenir les spectres seront expliquées, en analysant également les causes qui rendent les spectres des différentes molécules différents.
Bases de la RMN :
Spin nucléaire et moment angulaire du spin nucléaire
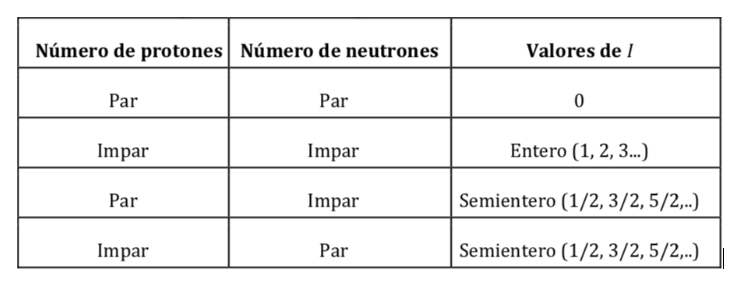
Les noyaux atomiques sont constitués de protons et de neutrons. Les deux nucléons ont un moment cinétique orbital et un moment cinétique de spin (les protons et les neutrons ont un spin 1/2). La résultante de la somme vectorielle de tous les moments (orbital et spin) de tous les protons et neutrons du noyau donne comme résultat le moment cinétique de spin nucléaire et est symbolisé par I et ses unités sont J s. Selon la mécanique quantique, la grandeur du moment cinétique de spin nucléaire, |I|, est quantifiée, avec une valeur I(I+1)h où I est le nombre quantique de spin nucléaire ou spin nucléaire et ħ est h/2p(qui dans le système international il vaut 1,05457·10-34J·s). La valeur de I est une caractéristique fixe de chaque type de noyau atomique et peut prendre une valeur entière ou semi-entière (0,1, 2, 3,… ½ , 3/2 , 5/2…).
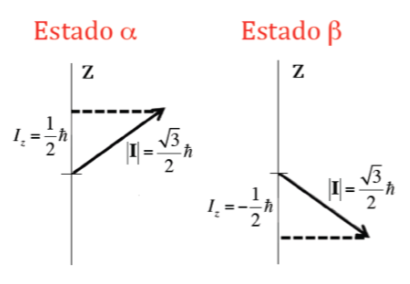
En plus du module, il est également important de connaître la composante du moment cinétique autour de l'axe z, Iz. Celui-ci peut aussi prendre des valeurs quantifiées données par l'expression m I h où m I est le nombre quantique associé à la composante z du moment cinétique de spin nucléaire et qui peut prendre les valeurs suivantes : –I, (‐I+1) , ... , (I-1), I. Ainsi, pour un noyau donné, de valeur I, il existe (2I+1) orientations du moment cinétique de spin nucléaire. Par exemple, considérons le noyau atomique de l'isotope le plus commun de l'atome d'hydrogène, 1H, qui est formé par un proton et on sait que son spin nucléaire, I , est de 1/2, et donc m I peut prendre deux valeurs +1/2 et -1/2 (en RMN, l'isotope 1H est souvent appelé proton). Le proton a donc deux états nucléaires possibles, l'un appelé a avec m I =+1/2 et l'autre b avec m I =‐1/2. La figure ci-dessous montre les deux orientations possibles du moment cinétique de spin nucléaire correspondant aux états a et b, énergétiquement équivalents.
Valeurs de I en fonction du nombre de protons et de neutrons dans le noyau :
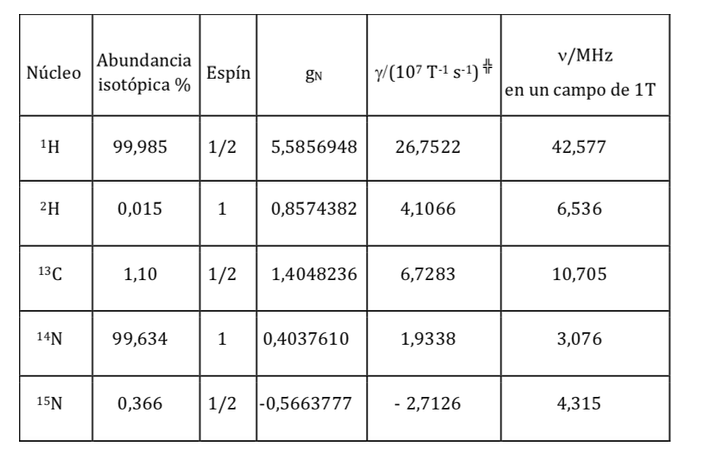
Propriétés magnétiques de divers noyaux :
Moment dipolaire magnétique nucléaire (magnéton nucléaire, rapport gyromagnétique):
Tout comme l'électron a un moment dipolaire magnétique, certains noyaux atomiques, mais pas tous, ont un moment dipolaire magnétique. Comme indiqué, les noyaux se comportent comme de petits aimants, l'origine de ce caractère magnétique étant le moment cinétique du spin nucléaire. Le moment cinétique de spin nucléaire, I, donne naissance à un moment dipolaire magnétique nucléaire mI qui est donné par :
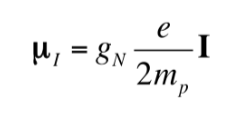
où gN est le facteur g nucléaire. Notez que cette expression utilise la masse et la charge du proton (mp ye) par définition, au lieu de la masse et de la charge du noyau en question. Les différences d'un noyau à l'autre sont incluses dans le facteur gN nucléaire. La valeur de gN ne peut pas être obtenue théoriquement, elle est donc déterminée expérimentalement. Les unités de mI sont JT-1
La relation entre mI et I peut également être exprimée comme suit :
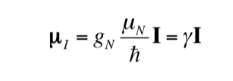
avec
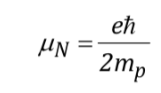
étant une constante d'une valeur de 5 050 10-27J T-1 appelée magnéton nucléaire et g est la relation gyromagnétique (T-1s-1).Dans les tableaux précédents, des valeurs de ces magnitudes étaient déjà indiquées pour certains isotopes. Bien que dans la plupart des cas mI et I aient le même sens, il est parfois opposé, comme on peut le déduire des valeurs négatives du facteur gN et g pour l'isotope 15N, par exemple.
Dans le cas du proton où deux orientations possibles du moment cinétique ont été vues, il y aura deux orientations possibles du moment magnétique dipolaire, comme illustré sur la figure suivante, les deux orientations étant énergétiquement équivalentes, puisque le choix d'une direction z est arbitraire.
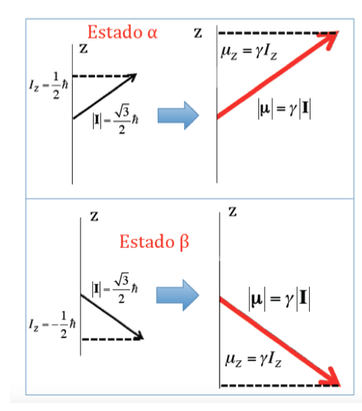
Energie d'interaction du champ magnétique avec le moment magnétique nucléaire :
Si une molécule est introduite dans un champ magnétique, de densité de flux ou de champ magnétique B, le moment magnétique dipolaire de chacun de ses noyaux va interagir avec elle, comme illustré sur la figure suivante, l'énergie de l'interaction étant exprimée par :
![]()
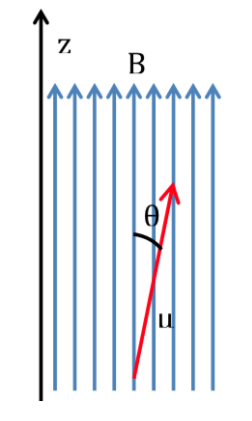
Selon la physique classique, toutes les orientations d'un dipôle magnétique dans un champ magnétique sont autorisées et donc q peut prendre n'importe quelle valeur entre 0 et 180o. Selon l'orientation du dipôle, l'énergie sera plus ou moins élevée :
L'interaction la plus favorable se produit lorsque les deux grandeurs ont la même direction : q=0 et donc cos q=1 et :
Cependant, selon la mécanique quantique, toutes les orientations du dipôle magnétique nucléaire ne sont pas autorisées, les orientations sont quantifiées et seules certaines valeurs de q sont possibles. Il y a autant d'orientations autorisées que de valeurs Iz ou mI (‐I, ‐I+1,..., I‐1, I) soit 2I+1 orientations. Évidemment, le nombre d'orientations du moment dipolaire varie avec le type de noyau atomique. Afin de définir les orientations, la direction et la direction du champ B sont prises comme référence pour l'axe Z.
Ainsi l'énergie d'interaction du champ magnétique externe B et du dipôle nucléaire sera donnée par : j
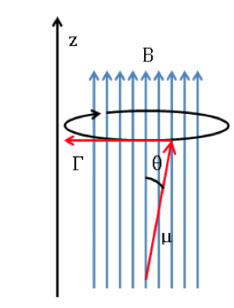
Fréquence de Langmor
Si un champ magnétique externe d'intensité B agit sur le noyau, le dipôle magnétique nucléaire subit un couple de forces comme indiqué dans la formule suivante donnée par :
qui tend à aligner le dipôle avec le champ magnétique. Comme le dipôle magnétique ne peut pas être aligné avec le champ magnétique, le système est incapable de dissiper cette énergie et précessions, appelées la précession de Larmor, dans
sur la direction du champ appliqué. La fréquence de cette précession est appelée fréquence de Larmor, avec pour valeur :
schéma langmor :
Spectroscopie RMN
La clé de toute technique spectroscopique repose sur la possibilité que la molécule étudiée puisse se trouver à plus d'un niveau d'énergie, de telle sorte qu'en faisant en sorte qu'un rayonnement électromagnétique (rem) de la fréquence appropriée l'affecte, elle puisse passer dans notre système. .(molécule) d'un niveau d'énergie à un autre. Comme vu dans la section précédente, le noyau d'un proton, plongé dans un champ magnétique, peut occuper deux niveaux différents associés au spin nucléaire, faisant ainsi tomber un faisceau rem de fréquence appropriée sur un noyau 1H qui occupe le niveau inférieur, il peut être transmis au niveau supérieur. Ce type de transitions est à l'origine de la spectroscopie par résonance magnétique nucléaire (RMN). Nous nous concentrerons désormais sur le cas du proton 1H, car c'est la spectroscopie la plus utilisée, même si tout ce qui est indiqué est applicable à d'autres noyaux. En fait, de plus en plus de variétés de noyaux sont utilisées.
Fréquence de résonance:
La fréquence qui provoque la transition est obtenue en appliquant la condition de résonance :
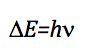
Comme la différence d'énergie entre deux niveaux consécutifs est :
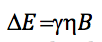
assimilant les deux expressions et isolant n :
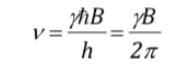
qui, comme on peut le voir, coïncide avec la fréquence de précession de Larmor.
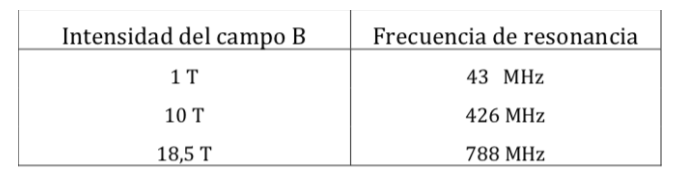
Fréquences de résonance RMN du proton pour différentes intensités de champ :
Règles de sélection :
Les règles de sélection qui ont été étudiées dans d'autres spectroscopies correspondent à l'interaction du dipôle électrique avec le champ électrique du rayonnement. D'autre part, en RMN, l'interaction se produit entre le dipôle magnétique du noyau et le champ magnétique variable du rayonnement. Pour déterminer les règles de sélection, il faut retenir l'expression générale qui détermine la probabilité de passage entre deux états :
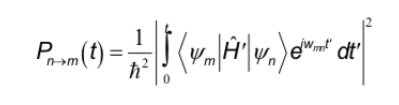
L'hamiltonien, dans ce cas, est le produit de l'opérateur du champ magnétique oscillant du rayonnement par l'opérateur du moment dipolaire du noyau.
![]()
On peut montrer que pour qu'il y ait transition entre deux niveaux la règle de sélection correspondante est :
m je = ± 1
Force du signal (niveaux de population) :
L'intensité du signal est directement liée à la population de niveaux impliqués dans la transition. Selon la loi de distribution de Boltzman, pour un système à deux niveaux, tel que le proton, le rapport de la population du niveau supérieur, Nb, et de la population du niveau inférieur, Na, est donné par :
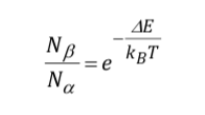
Description de l'équipement RMN :
Quelle procédure expérimentale est utilisée pour obtenir le spectre ? En général, en spectroscopie, on fait varier la fréquence du rayonnement incident jusqu'à ce qu'une absorption soit observée. Cependant, en spectroscopie RMN, il existe également la possibilité de maintenir la fréquence de rayonnement fixe et de faire varier l'espacement entre les niveaux, en faisant varier l'amplitude du champ appliqué B jusqu'à ce que l'absorption soit observée. Dans la figure suivante où un schéma d'un équipement RMN est présenté. L'échantillon est placé dans un tube, qui est parfois tourné rapidement pour obtenir une homogénéisation du signal, bien que l'utilisation de la rotation soit actuellement en discussion, car elle peut introduire des erreurs. Le tube, à son tour, est situé entre deux pôles magnétiques qui sont ceux qui génèrent le champ magnétique. Il y a un émetteur et un récepteur de radiofréquence. Le signal de l'émetteur peut être contrôlé pour effectuer un balayage de fréquence. Avec les bobines de balayage, un balayage du champ peut être contrôlé. Les équipements RMN actuels n'utilisent quasiment plus :
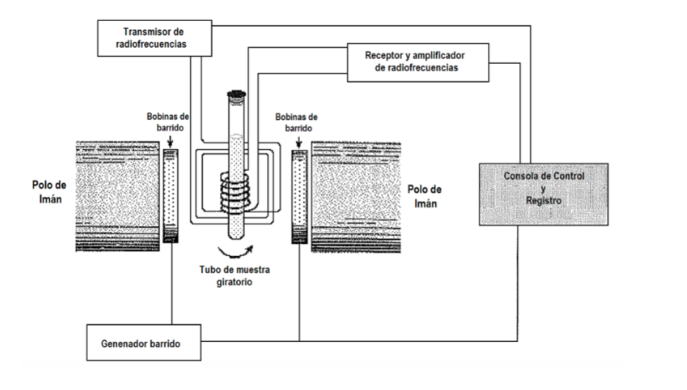
procédures précédentes, mais sont basés sur l'utilisation de techniques de transformée de Fourier. B est maintenu immobile et l'échantillon est éclairé par une impulsion radiofréquence de forte puissance et limitée dans le temps avec une fréquence nrad, une valeur fixe dans la gamme de fréquences RMN du type de noyau étudié. L'impulsion dure plusieurs microsecondes, il peut donc être démontré mathématiquement par une technique appelée analyse de Fourier que l'impulsion radiofréquence est équivalente à une gamme de fréquences ∆n autour de nrad et excite toutes les résonances RMN possibles. Le signal observé dans le détecteur contiendra toutes les fréquences de résonance et est analysé par un ordinateur en utilisant des techniques de transformée de Fourier. Cette procédure permet une résolution très élevée et de travailler avec des noyaux qui, avec les procédures précédentes, avaient des signaux très faibles.
Blindage nucléaire :
En résonance magnétique, des noyaux avec un moment cinétique de spin autre que zéro sont utilisés, tels que 1H et 13C. Cependant, les fréquences de résonance ne sont pas les mêmes pour tous les noyaux d'hydrogène ou de carbone, elles dépendent de l'environnement chimique qui entoure chaque noyau. Cela est dû au fait que les électrons qui entourent chaque noyau génèrent un champ magnétique qui s'oppose à celui appliqué, on dit que les noyaux sont blindés, où σ est la constante de blindage.
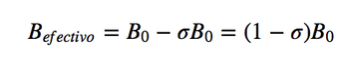
Bef est le champ magnétique net agissant sur le proton ; B0 est le champ magnétique appliqué ; σ est la constante de blindage, indépendante du champ appliqué. Dans cette nouvelle situation, avec les noyaux protégés par la densité électronique qui les entoure, la fréquence de résonance devient
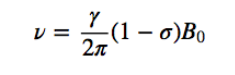
Les noyaux avec différents environnements chimiques ont une constante de criblage différente, générant des signaux différents dans le spectre RMN.
spectre éthanol :
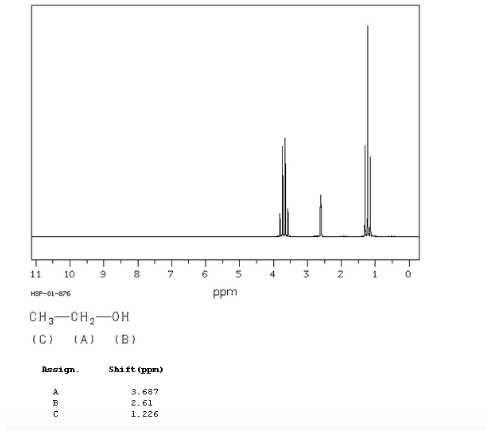
Dans le spectre RMN de l'éthanol, trois signaux différents sont observés, dus à l'existence de 3 types d'hydrogènes avec des environnements chimiques différents. Les hydrogènes A sont plus non blindés que C en raison de la présence d'oxygène (atome électronégatif qui supprime la densité électronique). L'environnement chimique de l'hydrogène B, directement attaché à l'oxygène, est également différent, résonnant à une fréquence différente des précédents.
Changement chimique
Les signaux dans le spectre RMN sont mesurés sur une échelle indépendante du champ magnétique appliqué, appelée déplacement chimique et représentée par la lettre δ. Quel que soit le champ magnétique auquel travaille le spectrophotomètre, les signaux d'un composé chimique sont toujours obtenus aux mêmes valeurs de δ :

Tableau de déplacement :
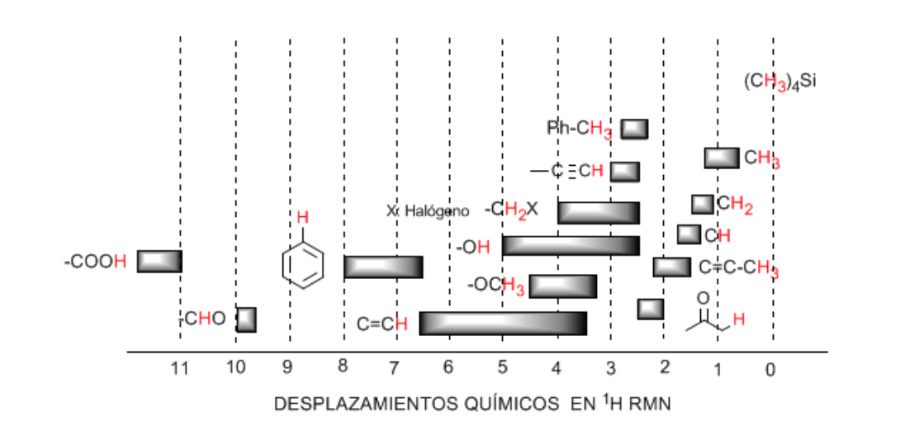
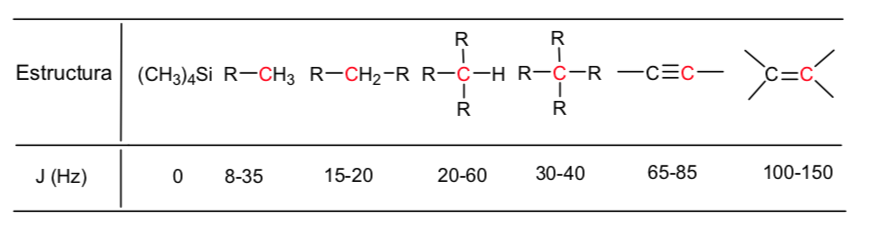
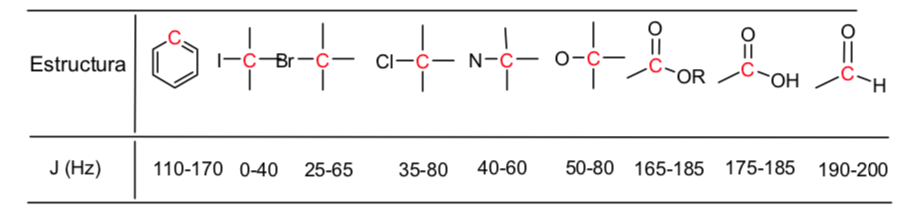
Les hydrogènes situés sur les chaînes aliphatiques présentent des valeurs de δ proches de 1. Celle-ci augmente légèrement lorsqu'on passe des carbones primaires aux carbones secondaires ou tertiaires.
Les hydrogènes allyliques sont situés entre 1,5 et 2,1.
Les hydrogènes alpha par rapport aux carbonyles et aux dérivés acides sont compris entre 2 et 2,5.
Les hydrogènes benzyliques entre 2,3 et 2,7.
L'hydrogène des alcynes terminaux entre 2,5 et 3.
Hydrogènes attachés aux carbones avec des halogènes entre 2,5 et 4 selon l'électronégativité de l'halogène
Les hydrogènes du groupe hydroxyle entre 2,5 et 5. Très large gamme due à la formation de liaisons hydrogène.
Hydrogènes carbonés liés à l'oxygène de type éther entre 3,3 et 4,5.
Hydrogènes oléfiniques entre 3,5 et 6,5.
Hydrogènes liés aux systèmes aromatiques entre 6,5 et 8.
Aldéhyde hydrogène 9,5-10
Hydrogène du groupe acide carboxylique au-dessus de 11.
Les groupes électronégatifs déblindent les noyaux :
Les substituants électronégatifs suppriment la densité électronique, démasquant les hydrogènes et déplacent le signal vers des valeurs δ élevées.
Dans le tableau suivant, vous pouvez voir l'influence de différents atomes sur le signal des hydrogènes de méthyle.
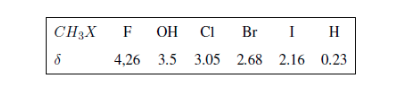
Dans les spectres suivants, les effets susmentionnés sur les déplacements chimiques peuvent être observés.
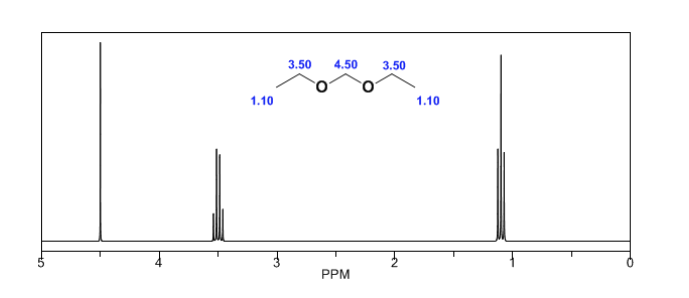
Anisotropie magnétique :
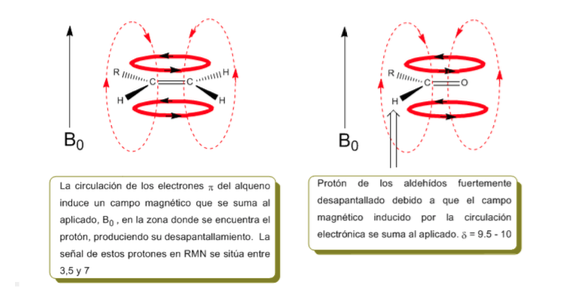
Les protons proches des doubles liaisons et des cycles aromatiques sont notamment non blindés du fait du champ magnétique induit par les courants électroniques de ces systèmes. Le champ induit s'ajoute à celui appliqué, produisant un déplacement plus important que prévu.
Dans l'image suivante on peut voir la circulation électronique (courbes en gras) et le champ magnétique induit (lignes pointillées) pour un alcène et un carbonyle. Observez comment, dans la région du proton, le champ magnétique induit a la même direction et la même direction que celui appliqué.
Une situation similaire est observée dans le cas du benzène. Or, dans les alcynes, la circulation électronique induit un champ magnétique opposé à celui appliqué dans le domaine des protons. Les hydrogènes acétyléniques sont protégés par des signaux dans le spectre RMN à faibles décalages.
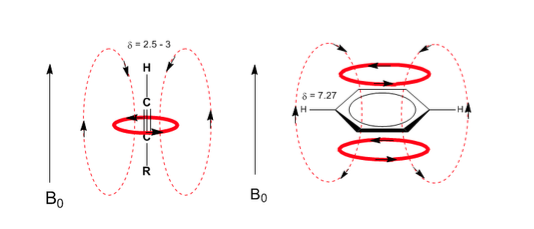
Observez comment les champs induits augmentent considérablement les déplacements du proton oléfinique, les positions allyliques étant également affectées.
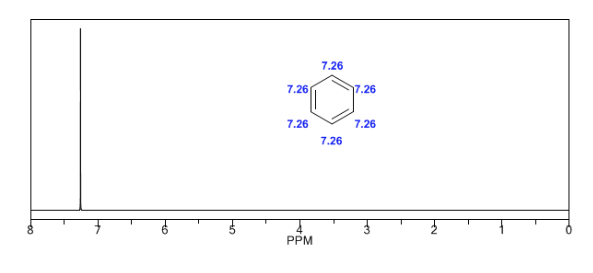
Les hydrogènes aromatiques sont fortement non blindés en raison du champ induit par les courants annulaires.
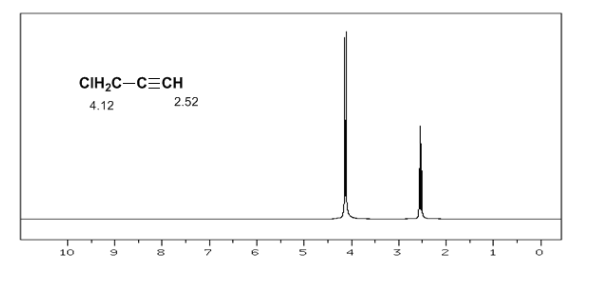
L'hydrogène acétylénique a un faible déplacement, car les courants produisent un champ magnétique qui s'oppose à celui appliqué.
Les déplacements d'hydrogène acide les plus courants dans les molécules organiques sont :
- ·Acides carboxyliques (RCOOH) δ= 10 - 12 ppm
- ·Amines (R−NH2) δ= 0,5 - 5 ppm
- Amides (RCONH2) δ= 5-8 ppm
- ·Alcools (ROH) δ= 0,5 - 5 ppm
- Phénols (Ph-OH) δ= 4 - 7 ppm
Couplage spin-spin :
L'information structurale de la RMN provient de deux facteurs : les différents déplacements observés en fonction de l'environnement chimique qui entoure le proton et le couplage entre les spins des protons proches, qui produit le dédoublement des signaux.
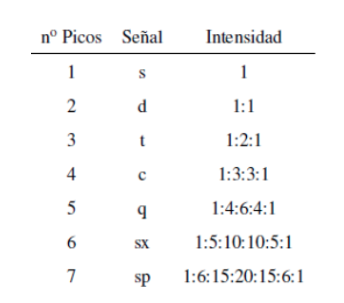
Bien que certains signaux du spectre soient des pics uniques, il est courant de trouver des signaux composés de plusieurs pics très proches, qui sont nommés avec la notation suivante : singulet(s), doublet (d), triplet (t), quadruplet (c) , quintuplet (q), sextuplé (sx) et septuplé (sp), les signaux complexes sont désignés sous le nom de multiplets. La valeur de δ de ces signaux est affectée à leur centre, sauf si le multiplet est irrégulier, auquel cas l'intervalle est indiqué.
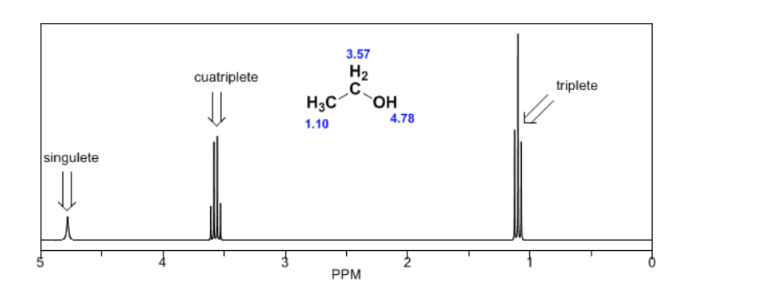
Dans le spectre de l'éthanol, on peut voir que l'hydrogène hydroxyle produit un singulet, la paire d'hydrogènes sur le carbone un donne naissance à un quadruplet et les trois hydrogènes sur le carbone deux produisent un triplet.
Explication du couplage spin-spin.
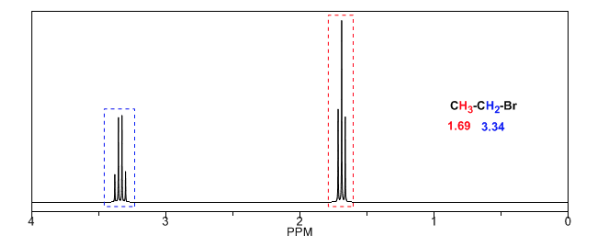
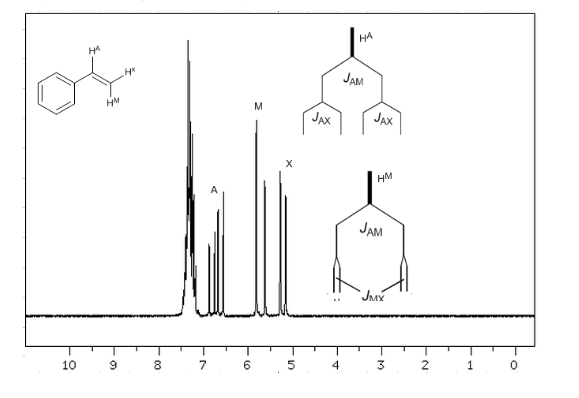
Pour comprendre le dédoublement des signaux dû au couplage spin-spin nous allons étudier le spectre du 1,1-dichloro-2,2-diphényléthane ( Cl 2 CH a CH b Ph 2 ).
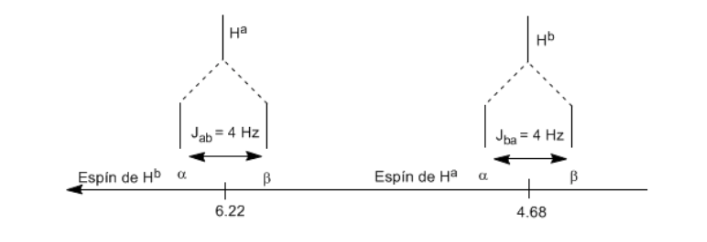
Le proton Ha soumis à un champ magnétique B0 produit un signal à δa = 6,22ppm. Cependant, le proton Hb génère un petit champ magnétique qui affecte le proton Ha. Environ la moitié des molécules ont le proton Hb aligné avec le champ appliqué (spin alpha) et l'autre moitié l'ont orienté contre le champ (spin bêta). ) . Lorsque Hb a un spin α, Ha est soumis à un champ légèrement plus grand et résonne à une fréquence plus élevée (δ légèrement plus élevé). Lorsque Hb a un spin β, Ha est soumis à un champ légèrement plus petit et résonne à une fréquence plus basse (δ légèrement plus faible), ce qui divise le pic initial en deux signaux séparés par une distance de 4 Hz, appelée constante de couplage ( J ). Ce même raisonnement peut être fait pour le proton Hb.
Enfin, nous aborderons le couplage d'un proton avec trois protons voisins équivalents. Dans ce cas, on observe un signal composé de quatre pics (quadtriplet). Les pics centraux sont trois fois plus intenses que les pics extrêmes.
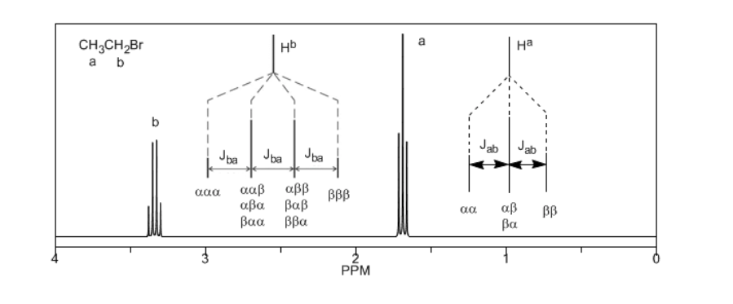
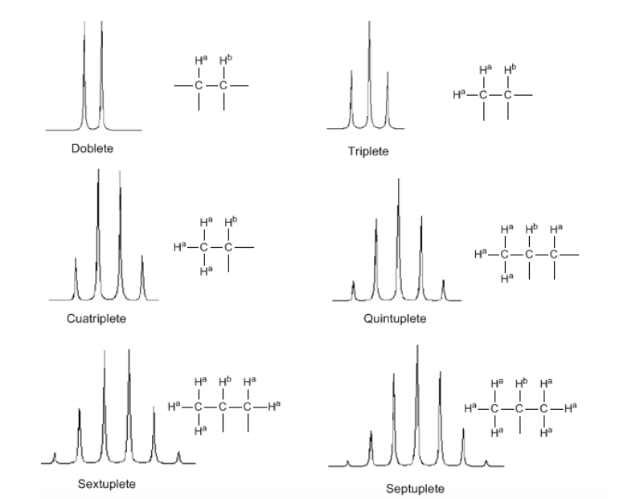
Règle N+1
De la discussion ci-dessus, on peut déduire qu'un proton produit un signal avec un nombre de pics supérieur d'une unité au nombre d'hydrogènes voisins. Dans l'image suivante, nous pouvons voir les pics produits par un hydrogène Hb lorsqu'il est couplé à un certain nombre d'hydrogènes variables
L'intensité des pics d'un signal est donnée par le triangle de Pascal (Tartaglia) :
Deux considérations doivent être prises en compte lors de l'application de la règle N+1 :
- Dans les molécules de type A−CHa2−CHb2−CHa2−A les protons Hb apparaissent comme un quintuplet.
- Dans les molécules de type A-CH2-CH2-A, les quatre protons sont équivalents et donnent un singulet.
Couplage de trois noyaux non équivalents :
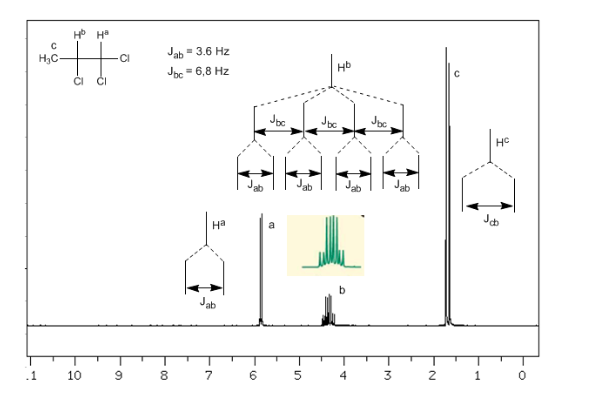
En tenant compte du fait que l'ordre des constantes de couplage dans les alcènes est Jtrans>Jcis>Jgeminal, les arbres de couplage pour les hydrogènes Ha et HM sont ceux indiqués dans le spectre. Seriez-vous capable de dessiner l'arbre pour Hx ?
Résonance magnétique nucléaire 13C
La résonance magnétique nucléaire du 13C est complémentaire de celle du 1H. Cette dernière technique permet de déduire la structure du squelette carboné en observant les environnements magnétiques des atomes d'hydrogène, tandis que la spectroscopie RMN 13C détermine l'environnement magnétique des atomes de carbone.
Les déplacements chimiques du carbone sont 15 à 20 fois supérieurs à ceux de l'hydrogène car le carbone est directement attaché aux atomes qui se trouvent être soit protecteurs, soit non protecteurs. Par exemple, le proton d'un aldéhyde absorbe à 9,4 ppm dans le spectre 1H tandis que le carbone carbonyle absorbe à 180 ppm dans le spectre 13C.
De plus, les signaux dans le spectre 13C sont des lignes verticales, c'est-à-dire qu'il n'y a pas de séparation spin-spin. En effet, seulement 1% des atomes de carbone entrent en résonance, et il y a donc une très faible probabilité qu'un noyau 13C soit adjacent à un autre noyau 13C.
Un tableau des valeurs approximatives des déplacements chimiques dans un spectre de résonance magnétique nucléaire 13C est donné ci-dessous :
Références recommandées pour élargir la recherche :
1. Spectroscopie d'émission Aga Fano SA. (Consulté le 10 septembre 2007). http://hiq.aga.com.co/International/Web/LG/CO/likelgspgco.nsf/DocByAlias/anal_icp .
2. Alonso, P. et al. chimie Cou..Ed. McGraw-Hill. 1990.
3. Álvarez Jiménez, MD et Gómez del Río, MI Guide didactique Chimie analytique II. UNED. 1999.
4. Arrivées Jimeno Siro; Burriel Barcelo Fernando; Hernandez Mendez Jésus; Lucena Comte Felipe. Chimie Analytique Qualitative. ISBN : 8497321405. ISB. 2006.
5. Ayres, Gilbert H. Analyse chimique quantitative. Éditions du Château, 4e éd . ISBN : 8421902806. 1981.
6. Bermejo Barrera. M del Pilar. Chimie analytique générale, quantitative et instrumentale. Paraninfo éditoriale. 7e édition. ISBN : 8428318093. 1990.
7. Blanco, M., Cerdá, V. et Sanz Medel, A., Spectroscopie atomique analytique, Publications universitaires Autonome de Barcelone. 1990.
8. Brodé. RW, Spectroscopie chimique, New York 1952.
9. Burriel, MF, Lucena, CF. Chimie Analytique Quantitative. Édition révolutionnaire. La Havane.1978.
10. Burriel, F. Chimie analytique qualitative. Paraninfo éditoriale. ISBN : 8497321405. pp 1072. , 2003.