Resonansi magnetik nuklir
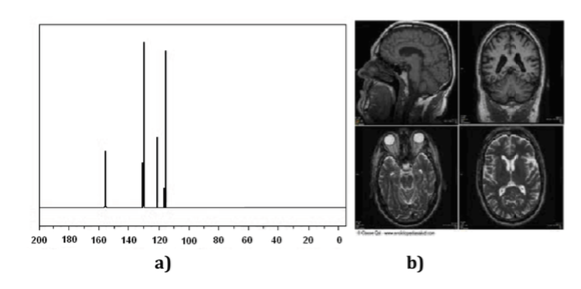
Teknik Resonansi Magnetik Nuklir (NMR) adalah instrumen yang sangat diperlukan untuk kimia serta untuk cabang Ilmu lainnya. Dengan spektroskopi NMR seseorang dapat mengidentifikasi molekul (Gambar spektrum), menentukan strukturnya atau mempelajari proses dinamis. Misalnya, telah menjadi kunci dalam menentukan struktur protein dalam larutan dan, di sisi lain, teknik pencitraan NMR adalah alat yang sangat diperlukan dalam diagnosis medis, seperti yang diilustrasikan pada (Gambar b).
NMR didasarkan pada tiga elemen:
a) Karakter magnetik inti molekul yang diteliti:
Banyak inti atom, karena spin nuklir, memiliki karakteristik magnetik. Dengan cara tertentu dapat dianggap bahwa inti berperilaku seperti magnet kecil.
b) Penerapan medan magnet yang kuat:
Ketika molekul yang diteliti dibenamkan dalam medan magnet, tingkat inti terungkap ke berbagai tingkat energi. Setiap tingkat energi yang muncul sesuai dengan orientasi berbeda dari putaran inti (magnet kecil) sehubungan dengan medan magnet.
c) Pencahayaan sampel dengan radiasi elektromagnetik:
Seperti pada teknik spektroskopi lainnya, penyinaran sampel dengan frekuensi radiasi yang memadai akan menyebabkan inti berpindah dari satu tingkat ke tingkat lainnya. Frekuensi radiasi yang diperlukan untuk menghasilkan lompatan level ini akan bergantung pada jenis inti, lingkungan kimianya, jenis inti yang ada di sekitarnya, dan medan eksternal yang diterapkan. Sepanjang topik ini, dasar fisik dari teknik ini akan dipelajari, dan teknik eksperimental yang memungkinkan memperoleh spektrum akan dijelaskan, juga menganalisis penyebab yang membuat spektrum dari berbagai molekul berbeda.
Dasar-dasar NMR:
Putaran nuklir dan momentum sudut putaran nuklir
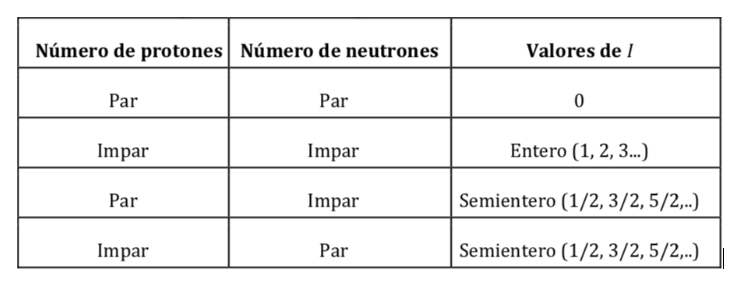
Inti atom terdiri dari proton dan neutron. Kedua nukleon memiliki momentum sudut orbit dan momentum sudut spin (baik proton maupun neutron memiliki spin 1/2). Hasil penjumlahan vektor semua momen (orbital dan spin) dari semua proton dan neutron inti menghasilkan momentum sudut spin nuklir dan dilambangkan dengan I dan satuannya adalah J s. Menurut mekanika kuantum, besarnya momentum sudut spin nuklir, |I|, dikuantisasi, dengan nilai I(I+1)h di mana I adalah bilangan kuantum spin nuklir atau spin nuklir dan ħ adalah h/2p(yang dalam sistem internasional bernilai 1,05457·10-34J·s). Nilai I adalah karakteristik tetap dari setiap jenis inti atom dan dapat berupa nilai integer atau semi-integer (0,1, 2, 3,… ½ , 3/2 , 5/2…).
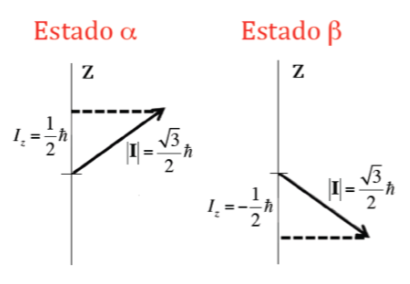
Selain modulus, penting juga untuk mengetahui komponen momentum sudut terhadap sumbu z, Iz. Ini juga dapat mengambil nilai terkuantisasi yang diberikan oleh ekspresi m I h di mana m I adalah bilangan kuantum yang terkait dengan komponen z dari momentum sudut spin nuklir dan yang dapat mengambil nilai berikut: –I, (‐I+1) , ... , (I-1), I. Jadi, untuk inti tertentu, dengan nilai I, terdapat (2I+1) orientasi momentum sudut spin inti. Misalnya, perhatikan inti atom dari isotop atom hidrogen yang paling umum, 1H, yang dibentuk oleh proton dan diketahui bahwa spin nuklirnya, I , adalah 1/2, dan oleh karena itu m I dapat mengambil dua nilai +1/2 dan ‐1/2 (dalam NMR isotop 1H sering disebut sebagai proton). Oleh karena itu, proton memiliki dua kemungkinan keadaan inti, satu disebut a dengan m I =+1/2 dan b lainnya dengan m I =‐1/2. Gambar di bawah ini menunjukkan dua kemungkinan orientasi momentum sudut spin nuklir yang sesuai dengan keadaan a dan b, yang setara secara energetik.
Nilai I menurut jumlah proton dan neutron dalam inti:
Sifat magnetik berbagai inti:
Momen dipol magnetik nuklir (magneton nuklir, rasio gyromagnetic):
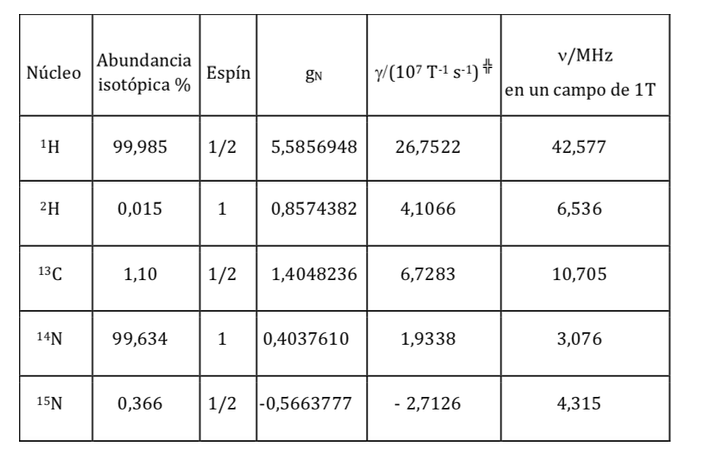
Sama seperti elektron yang memiliki momen dipol magnetik, beberapa, tetapi tidak semua, inti atom memiliki momen dipol magnetik. Seperti yang ditunjukkan, inti berperilaku seperti magnet kecil, asal karakter magnetik ini menjadi momentum sudut putaran nuklir. Momentum sudut spin nuklir, I, menimbulkan momen dipol magnetik nuklir mI yang diberikan oleh:
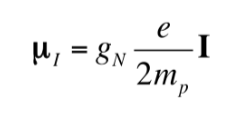
di mana gN adalah faktor g nuklir. Perhatikan bahwa ungkapan ini menggunakan massa dan muatan proton (mp ye) menurut definisi, bukan massa dan muatan inti yang dimaksud. Perbedaan dari satu nukleus ke nukleus lainnya termasuk dalam faktor gN nuklir. Nilai gN tidak dapat diperoleh secara teoritis, sehingga ditentukan secara eksperimental. Satuan mI adalah JT-1
Hubungan antara mI dan I juga dapat dinyatakan sebagai berikut:
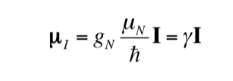
dengan
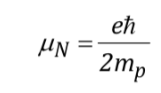
menjadi konstanta dengan nilai 5,050 10-27J T-1 disebut magneton nuklir dan g adalah hubungan gyromagnetic (T-1s-1).Pada tabel sebelumnya nilai besaran ini telah ditunjukkan untuk beberapa isotop. Meskipun dalam banyak kasus mI dan I memiliki pengertian yang sama, terkadang kebalikannya, seperti yang dapat disimpulkan dari nilai negatif faktor gN dan g untuk isotop 15N, misalnya.
Dalam kasus proton di mana dua kemungkinan orientasi momentum sudut telah terlihat, akan ada dua kemungkinan orientasi momen magnet dipol, seperti yang diilustrasikan pada gambar berikut, kedua orientasi tersebut ekivalen secara energetik, karena pilihan arah z adalah sewenang-wenang.
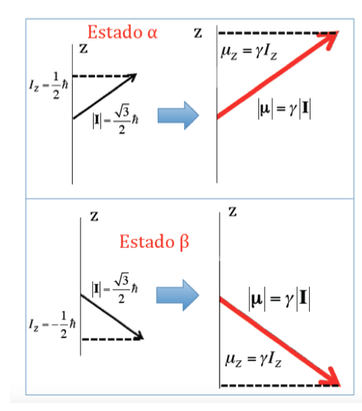
Energi interaksi medan magnet dengan momen magnet nuklir:
Jika sebuah molekul dimasukkan ke dalam medan magnet, dengan kerapatan fluks atau medan magnet B, momen magnet dipol dari masing-masing nukleusnya akan berinteraksi dengannya, seperti yang diilustrasikan pada gambar berikut, energi interaksi dinyatakan oleh:
![]()
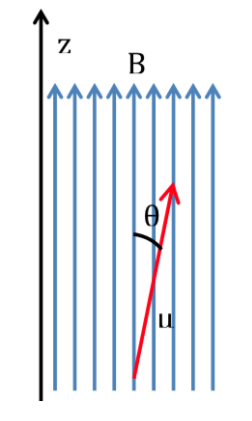
Menurut fisika klasik, semua orientasi dipol magnet dalam medan magnet diperbolehkan dan oleh karena itu q dapat mengambil nilai antara 0 dan 180o. Bergantung pada orientasi dipol, energinya akan lebih tinggi atau lebih rendah:
Interaksi yang paling menguntungkan terjadi ketika kedua besaran memiliki arah yang sama: q=0 dan karenanya cos q=1 dan :
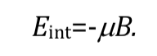
Namun, menurut mekanika kuantum, tidak semua orientasi dipol magnet nuklir diizinkan, orientasinya terkuantisasi dan hanya nilai q tertentu yang dimungkinkan. Ada banyak orientasi yang diperbolehkan seperti nilai Iz atau mI (‐I, −I+1,..., I‐1, I) yaitu orientasi 2I+1. Jelas jumlah orientasi momen dipol bervariasi dengan jenis inti atom. Untuk menentukan orientasi, arah dan arah bidang B diambil sebagai referensi untuk sumbu Z.
Dengan demikian energi interaksi medan magnet luar B dan dipol nuklir akan diberikan oleh: j
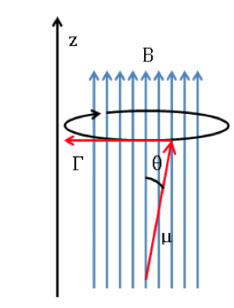
frekuensi Langmor
Jika medan magnet luar dengan intensitas B bekerja pada inti, dipol magnet inti mengalami beberapa gaya seperti yang ditunjukkan dalam rumus berikut yang diberikan oleh:
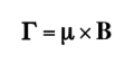
yang cenderung menyelaraskan dipol dengan medan magnet. Karena dipol magnet tidak dapat disejajarkan dengan medan magnet, sistem tidak dapat menghilangkan energi dan presesi ini, yang disebut presesi Larmor, di
tentang arah bidang yang diterapkan. Frekuensi presesi ini disebut frekuensi Larmor, dengan nilai:
skema langmor:
spektroskopi NMR
Kunci untuk setiap teknik spektroskopi didasarkan pada kemungkinan bahwa molekul yang diteliti mungkin berada pada lebih dari satu tingkat energi, sedemikian rupa sehingga dengan membuat radiasi elektromagnetik (rem) dari frekuensi yang sesuai mempengaruhinya, ia dapat masuk ke sistem kita. (molekul) dari satu tingkat energi ke tingkat energi lainnya. Seperti yang terlihat pada bagian sebelumnya, inti proton, yang terendam dalam medan magnet, dapat menempati dua tingkat berbeda yang terkait dengan putaran nuklir, sehingga membuat sinar rem dengan frekuensi yang sesuai jatuh pada inti 1H yang menempati tingkat yang lebih rendah, itu bisa diteruskan ke tingkat atas. Jenis transisi inilah yang memunculkan Nuclear Magnetic Resonance Spectroscopy (NMR). Mulai sekarang kita akan fokus pada kasus proton 1H, karena ini adalah spektroskopi yang paling banyak digunakan, meskipun semua yang disebutkan dapat diterapkan pada inti lainnya. Bahkan, semakin banyak variasi inti yang digunakan.
Frekuensi resonansi:
Frekuensi yang menyebabkan transisi diperoleh dengan menerapkan kondisi resonansi:
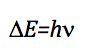
Karena perbedaan energi antara dua tingkat berturut-turut adalah:
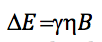
menyamakan kedua ekspresi dan mengisolasi n:
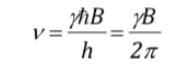
yang, seperti dapat dilihat, bertepatan dengan frekuensi presesi Larmor.
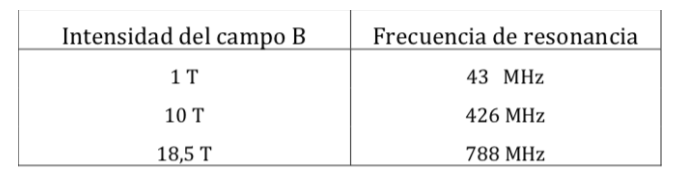
Frekuensi resonansi NMR proton untuk berbagai kekuatan medan:
Aturan pemilihan:
Aturan pemilihan yang dipelajari dalam spektroskopi lain sesuai dengan interaksi dipol listrik dengan medan listrik radiasi. Di sisi lain, dalam NMR interaksi terjadi antara dipol magnet inti dan medan magnet variabel radiasi. Untuk menentukan aturan pemilihan, ekspresi umum yang menentukan probabilitas lewatnya antara dua keadaan harus diingat:
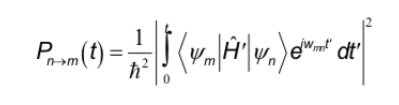
Hamiltonian, dalam hal ini, adalah produk dari operator medan magnet osilasi radiasi oleh operator momen dipol inti.
![]()
Dapat ditunjukkan bahwa untuk ada transisi antara dua level, aturan pemilihan yang sesuai adalah:
m I = ± 1
Kekuatan sinyal (tingkat populasi):
Intensitas sinyal berhubungan langsung dengan populasi level yang terlibat dalam transisi. Menurut hukum distribusi Boltzman, untuk sistem dua tingkat, seperti proton, rasio populasi tingkat atas, Nb, dan populasi tingkat bawah, Na, diberikan oleh:
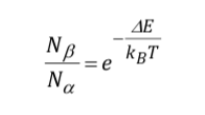
Deskripsi peralatan NMR:
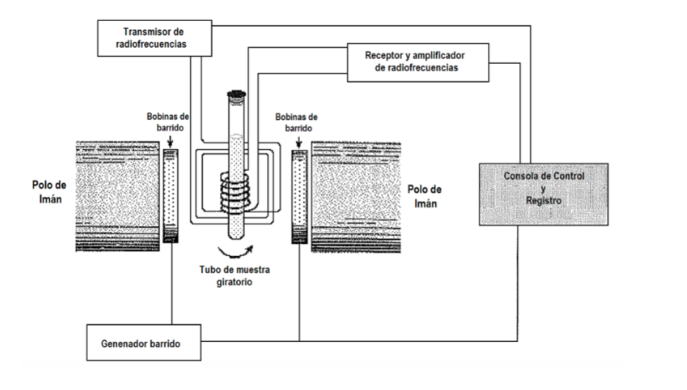
Prosedur percobaan apa yang digunakan untuk mendapatkan spektrum? Umumnya dalam spektroskopi frekuensi radiasi insiden bervariasi, sampai penyerapan diamati. Namun, dalam spektroskopi NMR ada juga opsi untuk menjaga frekuensi radiasi tetap dan memvariasikan jarak antar level, memvariasikan besarnya medan B yang diterapkan hingga penyerapan diamati. Pada gambar berikut di mana skema peralatan NMR disajikan. Sampel ditempatkan dalam tabung, yang terkadang diputar dengan cepat untuk mendapatkan homogenisasi dalam sinyal, meskipun penggunaan rotasi saat ini sedang dibahas, karena dapat menimbulkan kesalahan. Tabung, pada gilirannya, terletak di antara dua kutub magnet yang menghasilkan medan magnet. Ada pemancar dan penerima frekuensi radio. Sinyal emitor dapat dikontrol untuk melakukan sapuan frekuensi. Dengan kumparan sapuan, satu sapuan bidang dapat dikontrol. Peralatan NMR saat ini hampir tidak lagi menggunakan:
prosedur sebelumnya, tetapi didasarkan pada penggunaan teknik transformasi Fourier. B dipertahankan stasioner dan sampel disinari dengan pulsa frekuensi radio berkekuatan tinggi, terbatas waktu dengan frekuensi nrad, nilai tetap dalam rentang frekuensi NMR dari tipe nukleus yang sedang dipelajari. Denyut nadi berlangsung beberapa mikrodetik, sehingga dapat ditunjukkan secara matematis dengan teknik yang disebut analisis Fourier bahwa denyut frekuensi radio setara dengan rentang frekuensi ∆n di sekitar nrad dan menggairahkan semua kemungkinan resonansi NMR. Sinyal yang diamati pada detektor akan berisi semua frekuensi resonansi dan dianalisis oleh komputer menggunakan teknik transformasi Fourier. Prosedur ini memungkinkan resolusi yang sangat tinggi dan bekerja dengan nukleus yang pada prosedur sebelumnya memiliki sinyal yang sangat lemah.
Perisai nuklir:
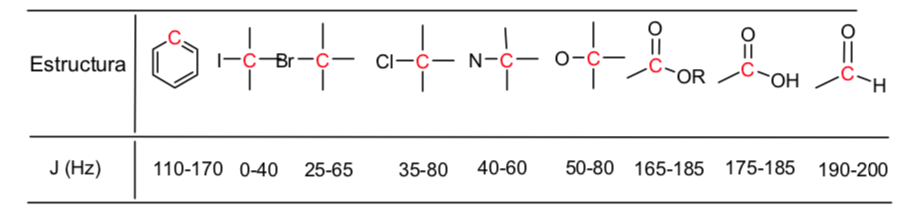
Dalam resonansi magnetik, inti dengan momentum sudut spin selain nol digunakan, seperti 1H dan 13C. Namun, frekuensi resonansi tidak sama untuk semua inti hidrogen atau karbon, mereka bergantung pada lingkungan kimiawi yang mengelilingi setiap inti. Hal ini disebabkan oleh fakta bahwa elektron yang mengelilingi setiap inti menghasilkan medan magnet yang berlawanan dengan medan magnet yang diterapkan, dikatakan bahwa inti terlindung, di mana σ adalah konstanta pelindung.
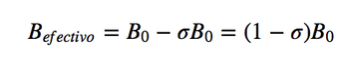
Bef adalah medan magnet total yang bekerja pada proton; B0 adalah medan magnet yang diterapkan; σ adalah konstanta pelindung, tidak bergantung pada bidang yang diterapkan. Di bawah situasi baru ini, dengan inti terlindung oleh kerapatan elektronik yang mengelilinginya, frekuensi resonansi menjadi
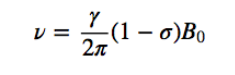
Inti dengan lingkungan kimia yang berbeda memiliki konstanta penyaringan yang berbeda, menghasilkan sinyal yang berbeda dalam spektrum NMR.
spektrum etanol:
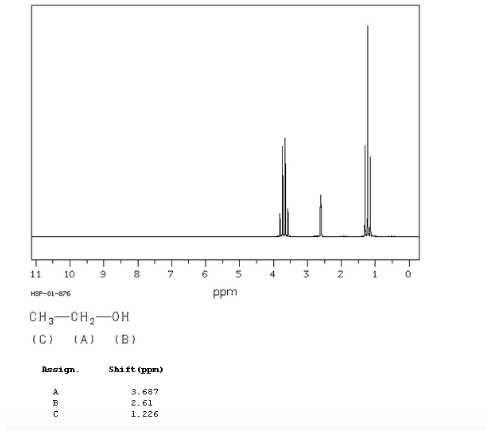
Dalam spektrum NMR etanol, tiga sinyal berbeda diamati, karena adanya 3 jenis hidrogen dengan lingkungan kimia yang berbeda. Hidrogen A lebih tidak terlindungi daripada C karena adanya oksigen (atom elektronegatif yang menghilangkan kerapatan elektron). Lingkungan kimiawi hidrogen B, yang langsung menempel pada oksigen, juga berbeda, beresonansi pada frekuensi yang berbeda dari frekuensi sebelumnya.
pergeseran kimia
Sinyal dalam spektrum NMR diukur pada skala independen dari medan magnet yang diterapkan, yang disebut pergeseran kimia dan diwakili oleh huruf δ. Terlepas dari medan magnet tempat spektrofotometer bekerja, sinyal senyawa kimia selalu diperoleh dengan nilai δ yang sama:

Tabel perpindahan:
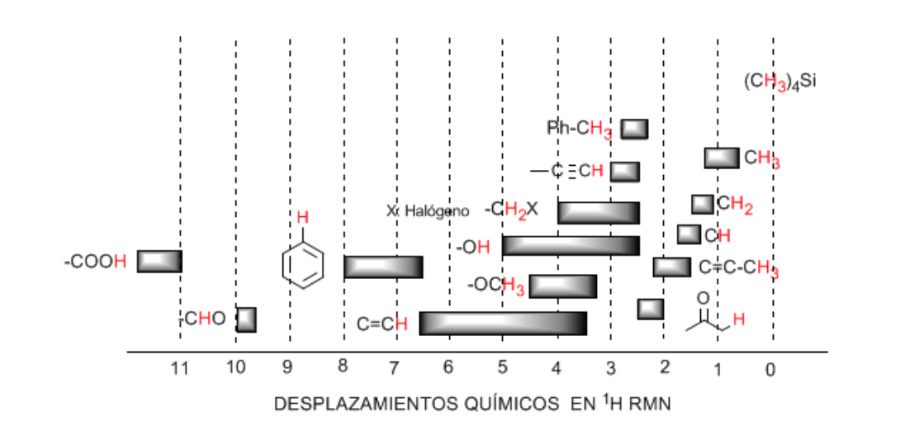
Hidrogen yang terletak pada rantai alifatik menunjukkan nilai δ mendekati 1. Ini sedikit meningkat ketika berpindah dari karbon primer ke karbon sekunder atau tersier.
Hidrogen alilik terletak antara 1,5 dan 2,1.
Hidrogen alfa sehubungan dengan karbonil dan turunan asam adalah antara 2 dan 2,5.
Hidrogen benzilik antara 2,3 dan 2,7.
Hidrogen alkin terminal antara 2,5 dan 3.
Hidrogen terikat pada karbon dengan halogen antara 2,5 dan 4 tergantung pada keelektronegatifan halogen
Hidrogen dari gugus hidroksil antara 2,5 dan 5. Kisaran yang sangat luas karena pembentukan ikatan hidrogen.
Karbon hidrogen terikat pada oksigen tipe eter antara 3,3 dan 4,5.
Hidrogen olefinik antara 3,5 dan 6,5.
Hidrogen terikat pada sistem aromatik antara 6,5 dan 8.
Aldehida hidrogen 9,5-10
Hidrogen dari gugus asam karboksilat di atas 11.
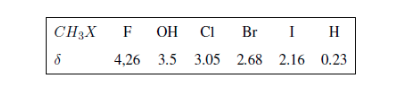
Gugus elektronegatif menghilangkan pelindung inti:
Substituen elektronegatif menghilangkan kerapatan elektron, membuka pelindung hidrogen, dan menggeser sinyal menuju nilai δ yang tinggi.
Pada tabel berikut Anda dapat melihat pengaruh atom yang berbeda pada sinyal hidrogen metil.
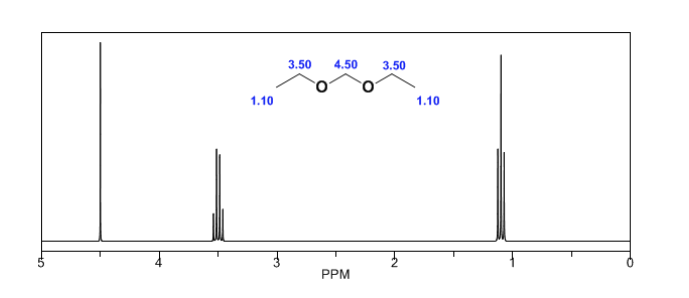
Dalam spektrum berikut, efek pergeseran kimia yang disebutkan di atas dapat diamati.
Anisotropi magnetik:
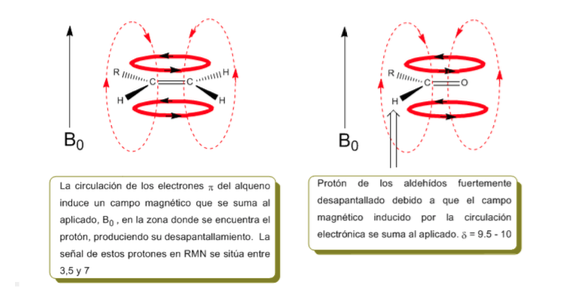
Proton yang dekat dengan ikatan rangkap dan cincin aromatik secara khusus tidak terlindung karena medan magnet yang diinduksi oleh arus elektronik dari sistem ini. Medan terinduksi ditambahkan ke yang diterapkan, menghasilkan perpindahan yang lebih besar dari yang diharapkan.
Pada gambar berikut kita dapat melihat sirkulasi elektronik (kurva dicetak tebal) dan medan magnet induksi (garis putus-putus) untuk alkena dan karbonil. Amati bagaimana di wilayah proton medan magnet yang diinduksi memiliki arah dan arah yang sama dengan yang diterapkan.
Situasi serupa diamati dalam kasus benzena. Namun, dalam alkuna, sirkulasi elektronik menginduksi medan magnet yang berlawanan dengan yang diterapkan di area proton. Hidrogen asetilen terlindung dengan sinyal dalam spektrum NMR pada offset rendah.
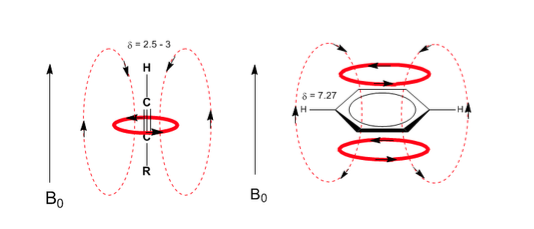
Amati bagaimana medan terinduksi sangat meningkatkan perpindahan proton olefin, posisi alilik juga terpengaruh.
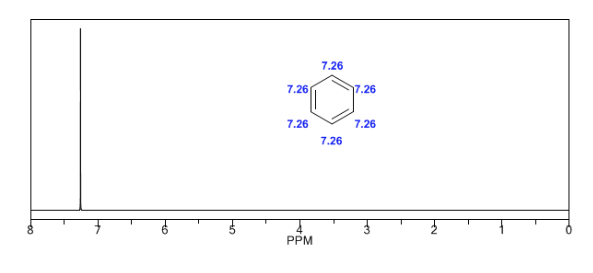
Hidrogen aromatik sangat tidak terlindungi karena medan yang diinduksi oleh arus cincin.
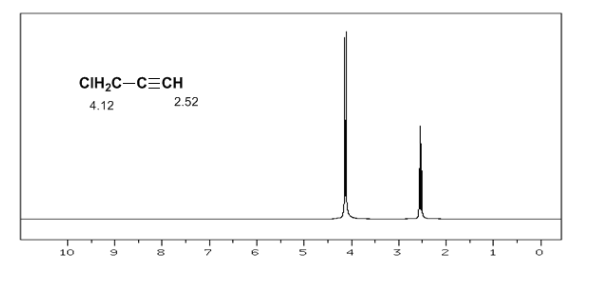
Hidrogen asetilena memiliki perpindahan yang rendah, karena arus menghasilkan medan magnet yang berlawanan dengan yang diterapkan.
Pergeseran hidrogen asam yang paling umum dalam molekul organik adalah:
- ·Asam karboksilat (RCOOH) δ= 10 - 12 ppm
- ·Amina (R−NH2) δ= 0,5 - 5 ppm
- Amida (RCONH2) δ= 5-8 ppm
- ·Alkohol (ROH) δ= 0,5 - 5 ppm
- Fenol (Ph-OH) δ= 4 - 7 ppm
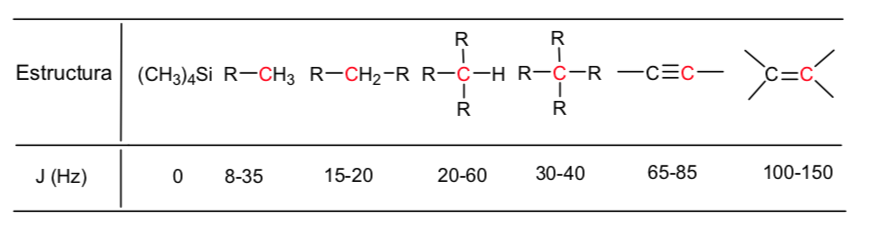
Kopling spin-spin:
Informasi struktural NMR berasal dari dua faktor: perpindahan berbeda yang diamati tergantung pada lingkungan kimiawi yang mengelilingi proton dan kopling antara putaran proton terdekat, yang menghasilkan pemisahan sinyal.
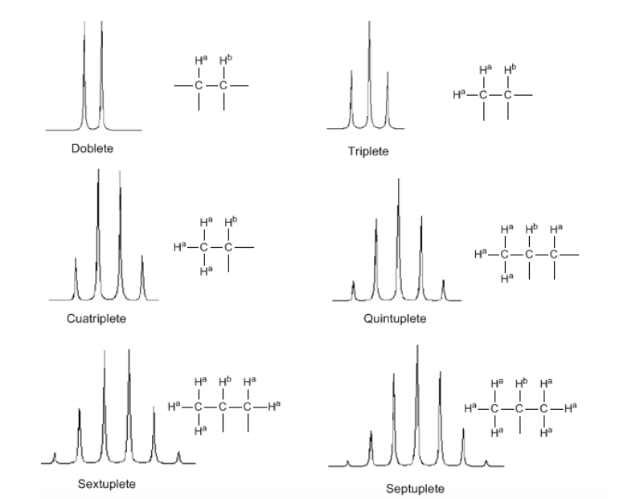
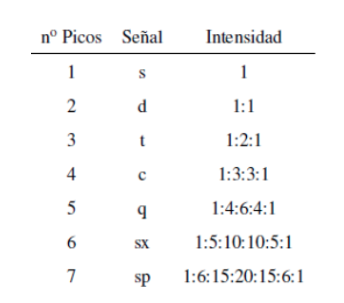
Meskipun beberapa sinyal dalam spektrum adalah puncak tunggal, adalah umum untuk menemukan sinyal yang terdiri dari beberapa puncak yang sangat dekat, yang diberi nama dengan notasi berikut: singlet (s), doublet (d), triplet (t), quadruplet (c) , kuintuplet ( q), sextuplet (sx) dan septuplet (sp), sinyal kompleks ditetapkan sebagai multiplet. Nilai δ dari sinyal-sinyal ini ditetapkan ke pusatnya, kecuali multipletnya tidak beraturan, dalam hal ini intervalnya ditunjukkan.
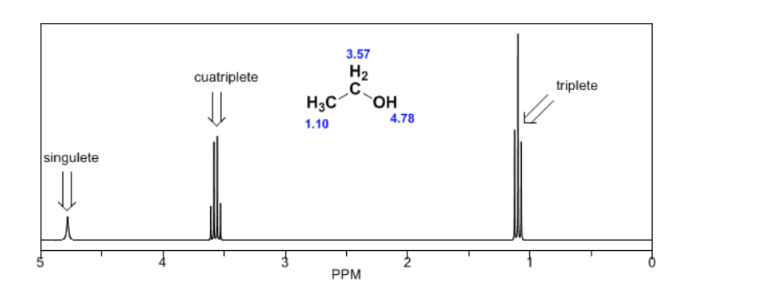
Dalam spektrum etanol dapat dilihat bahwa hidrogen hidroksil menghasilkan singlet, pasangan hidrogen pada karbon satu menimbulkan quadruplet, dan tiga hidrogen pada karbon dua menghasilkan triplet.
Penjelasan spin-spin kopling.
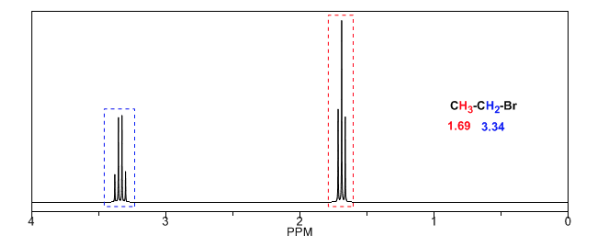
Untuk memahami pemisahan sinyal akibat kopling spin-spin kita akan mempelajari spektrum 1,1-dikloro-2,2-difeniletana ( Cl 2 CH a CH b Ph 2 ).
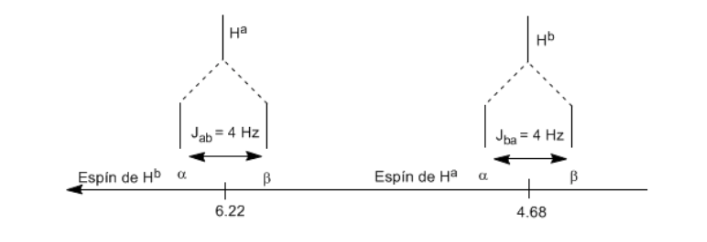
Proton Ha yang dikenai medan magnet B0 menghasilkan sinyal pada δa=6,22ppm. Namun, proton Hb menghasilkan medan magnet kecil yang mempengaruhi proton Ha. Kira-kira setengah dari molekul memiliki proton Hb yang sejajar dengan medan yang diterapkan (spin alfa) dan separuh lainnya berorientasi terhadap medan (spin beta). ) . Ketika Hb berputar α, Ha mengalami medan yang sedikit lebih besar dan beresonansi pada frekuensi yang lebih tinggi (δ sedikit lebih tinggi). Ketika Hb memiliki putaran β, Ha mengalami medan yang sedikit lebih kecil dan beresonansi pada frekuensi yang lebih rendah (δ sedikit lebih rendah), yang membagi puncak awal menjadi dua sinyal yang dipisahkan oleh jarak 4 Hz, yang disebut konstanta kopling (J). Alasan yang sama dapat dilakukan untuk proton Hb.
Terakhir, kita akan membahas kopling proton dengan tiga proton tetangga yang ekuivalen. Dalam hal ini, sinyal yang terdiri dari empat puncak (quadtriplet) diamati. Puncak pusat tiga kali lebih kuat dari puncak ekstrim.
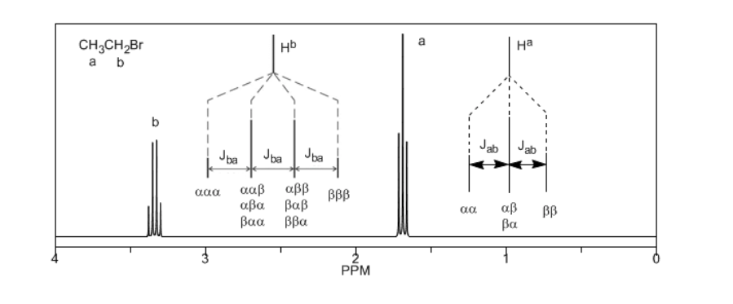
Aturan N+1
Dari pembahasan di atas dapat ditarik kesimpulan bahwa sebuah proton menghasilkan sinyal dengan jumlah puncak satu unit lebih besar dari jumlah hidrogen tetangganya. Pada gambar berikut kita dapat melihat puncak yang dihasilkan oleh hidrogen Hb bila digabungkan dengan sejumlah hidrogen variabel
Intensitas puncak sinyal diberikan oleh segitiga Pascal (Tartaglia):
Dua pertimbangan harus diperhitungkan saat menerapkan aturan N+1:
- Dalam molekul bertipe A−CHa2−CHb2−CHa2−A, proton Hb muncul sebagai kuintuplet.
- Dalam molekul bertipe A−CH2−CH2−A, keempat protonnya ekuivalen dan menghasilkan singlet.
Kopling dari tiga inti yang tidak setara:
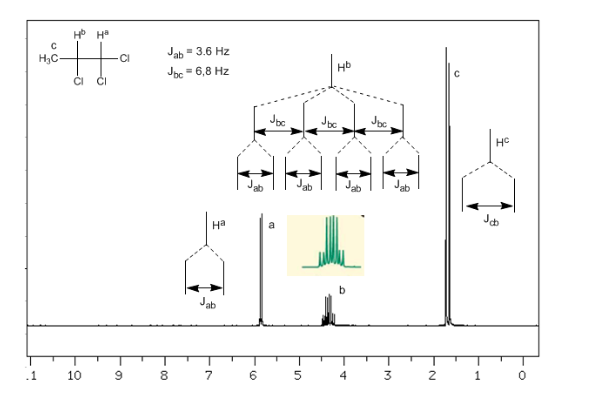
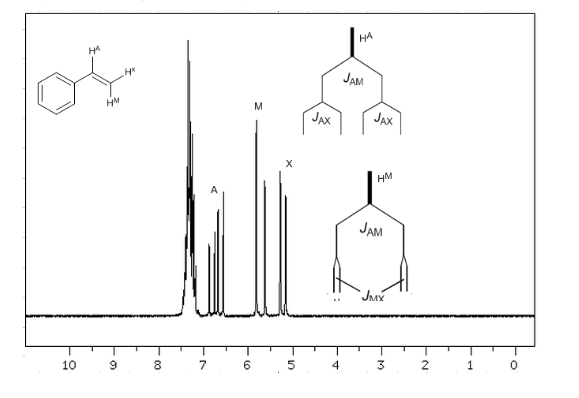
Mempertimbangkan bahwa urutan konstanta kopling dalam alkena adalah Jtrans>Jcis>Jgeminal, pohon kopling untuk hidrogen Ha dan HM adalah yang ditunjukkan dalam spektrum. Bisakah Anda menggambar pohon untuk Hx?
resonansi magnetik nuklir 13C
Resonansi magnetik nuklir 13C komplementer dengan 1H. Teknik terakhir digunakan untuk menyimpulkan struktur kerangka karbon dengan mengamati lingkungan magnetik atom hidrogen, sedangkan spektroskopi 13C NMR menentukan lingkungan magnetik atom karbon.
Pergeseran kimia karbon adalah 15 sampai 20 kali lebih besar daripada hidrogen karena karbon secara langsung melekat pada atom yang kebetulan melindungi atau melepaskan. Misalnya, proton aldehida menyerap pada 9,4 ppm dalam spektrum 1H sedangkan karbon karbonil menyerap pada 180 ppm dalam spektrum 13C.
Selain itu, sinyal dalam spektrum 13C adalah garis vertikal, yaitu tidak ada pemisahan spin-spin. Hal ini karena hanya 1% atom karbon yang memasuki resonansi, dan oleh karena itu ada kemungkinan yang sangat kecil bahwa inti 13C berdekatan dengan inti 13C lainnya.
Tabel nilai perkiraan pergeseran kimia dalam spektrum resonansi magnetik nuklir 13C diberikan di bawah ini:
Referensi yang disarankan untuk memperluas pencarian:
1. Spektroskopi Emisi Aga Fano SA. (Diakses 10 September 2007). http://hiq.aga.com.co/International/Web/LG/CO/likelgspgco.nsf/DocByAlias/anal_icp .
2. Alonso, P. et al. kimia Cou..Ed. McGraw-Hill. 1990.
3. Álvarez Jiménez, MD dan Gómez del Río, Panduan Didaktik MI Kimia Analitik II. UNED. 1999.
4. Kedatangan Jimeno Siro; Burriel Barcelo Fernando; Hernandez Mendez Yesus; Lucena Hitung Felipe. Kimia Analitik Kualitatif. ISBN: 8497321405. ISBN. 2006.
5. Ayres, Gilbert H. Analisis Kimia Kuantitatif. Edisi Kastil, edisi ke-4 . ISBN: 8421902806. 1981.
6. Bermejo Barrera. M del Pilar. Kimia analitik umum, kuantitatif dan instrumental. Editorial Paraninfo. Edisi ke-7. ISBN: 8428318093. 1990.
7. Blanco, M., Cerdá, V. dan Sanz Medel, A., Spektroskopi Atom Analitik, Publikasi Universitas Otonomi Barcelona. 1990.
8. Brod. RW, Spektroskopi Kimia, New York 1952.
9. Burriel, MF, Lucena, CF. Kimia Analitik Kuantitatif. Edisi revolusioner. Havana.1978.
10. Burriel, F. Kimia Analitik Kualitatif. Editorial Paraninfo. ISBN: 8497321405. hlm. 1072. , 2003.