organocatalisi asimmetrica
introduzione
Nonostante l'importanza della chiralità, l'ottenimento di molecole chirali in forma enantiomericamente pura è rimasto estremamente limitato fino a tempi molto recenti. Dalla fine del 19° secolo, la sintesi di molecole chirali in modo stereoselettivo è stata una sfida sintetica di grande portata a cui i chimici organici hanno risposto con grande ingegnosità e brillantezza.
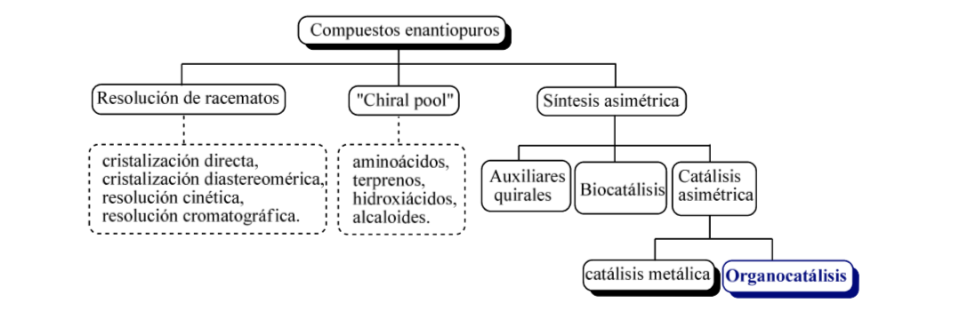
A grandi linee, si possono considerare tre strategie di base per ottenere composti enantiomericamente puri, come ad esempio
a) la risoluzione dei racemi,
b) l'uso di molecole naturali otticamente attive
c) sintesi asimmetrica.
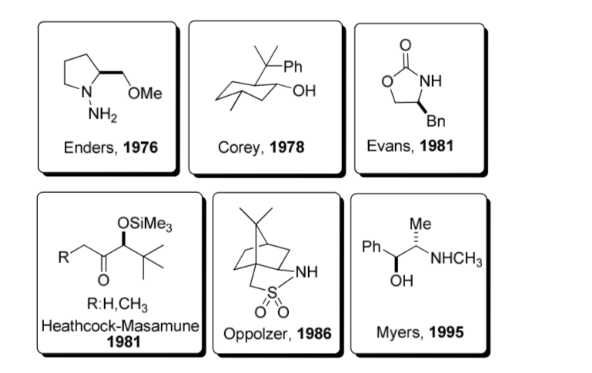
Uso di ausiliari chirali:
Un ausiliario chirale è un composto chimico o un'unità che viene temporaneamente incorporata in una sintesi organica in modo che possa essere eseguita in modo asimmetrico, con la formazione selettiva di uno dei due enantiomeri.
Questa strategia ha guadagnato una notevole popolarità negli anni '80 e oggi un'ampia gamma di ausiliari è nota per un gran numero di reazioni. In figura sono mostrati alcuni degli ausiliari più rappresentativi
Cos'è l'organocatalisi asimmetrica?
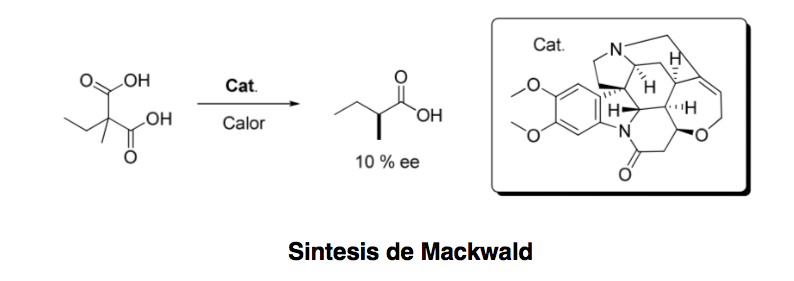
L'organocatalisi asimmetrica o catalisi asimmetrica può essere definita come "l'accelerazione di reazioni chimiche con una quantità substechiometrica di un composto organico, che non contiene atomi di metallo utilizzando molecole organiche di natura chirale". risalendo al 1904, quando Mackwald effettuò la decarbossilazione di un derivato acido in presenza di brucina, solo pochi anni fa questo campo ha conosciuto una rinascita spettacolare.
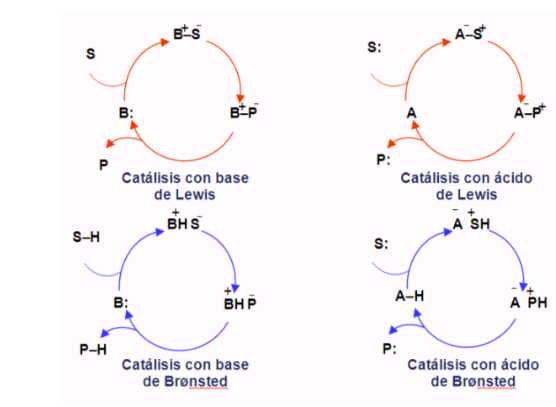
Cicli organocatalitici
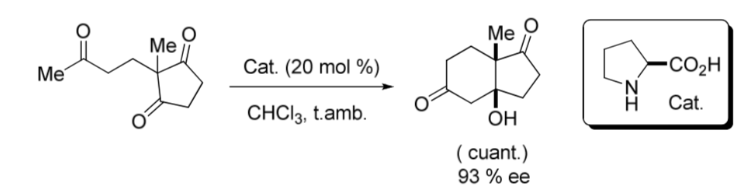
Un'importante pietra miliare nell'area dell'organocatalisi asimmetrica è stata la reazione aldolica intramolecolare catalizzata da L -Proline pubblicata alla fine degli anni '60 e all'inizio degli anni '70 dai gruppi Hajos e Parrish; e da un altro Ender, Wiechert e Sauer a prescindere, come mostrato nel seguente Immagine:
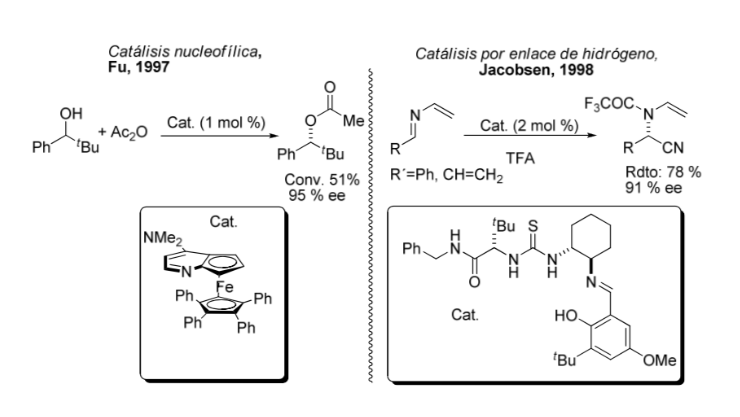
Confronto tra catalisi organometallica e asimmetrica:
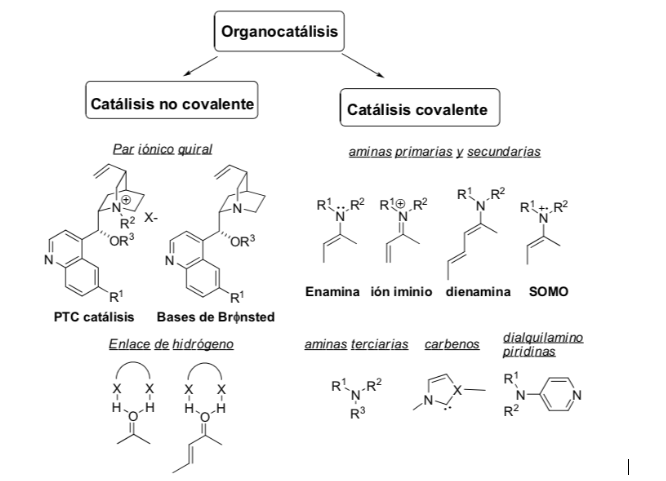
Metodo di attivazione:
Fonti per ampliare la ricerca:
Berkessel, A. e Groeger, H. Organocatalisi asimmetrica: dai concetti biomimetici alle applicazioni nella sintesi asimmetrica ” , Wiley-VCH: Weinheim, 2005.
Bui, T., Syed, S. e Barbas, CF, aggiunte altamente enantio- e diastereoselettive catalizzate da tiourea di ossindoli alle nitroolefine: applicazione alla sintesi formale di (+) - fisostigmina, J. Am. Chem. Soc . 131 , 8758-8759, 2009.
Hernández-Rodríguez, M. e Juaristi, E., tiouree chirali strutturalmente semplici come agenti solvatanti chirali nell'enantiodiscriminazione degli acidi carbossilici, Tetrahedron 63 , 7673-7678, 2007.
Juaristi, E. Premio Nobel per la Chimica 2001: L'importanza della sintesi asimmetrica, Educ. quím . 13 , 6-7, 2002. .
Juaristi, E. Sintesi asimmetrica di amminoacidi preziosi, in contributi scientifici e umanistici messicani nel XX secolo , Paredes, O. e Estrada, S., Eds., Fondo de Cultura Económica: México, 2008, p. 440-446.
Juaristi, E. Sintesi enantioselettiva di â -amminoacidi , Wiley-VCH: New York, 1997.
Juaristi, E. e Soloshonok, VA (a cura di) Seconda edizione della sintesi enantioselettiva di â -aminoacidi , Wiley: New York, 2005. Liu, Y., Melgar, R. e Juaristi, E. amminazione enantioselettiva di
á-fenil á-cianoacetato catalizzato da ammine chirali che incorporano l'ausiliario á-feniletile, J. Org. Chem.72 , 1522-1525 , 2007.
MacMillan, DWC, L'avvento e lo sviluppo dell'organo-catalisi, Nature 455 , 304-308, 2008.
Marigo, M., Juhl, K. e Jorgensen, KA, amminazione catalitica, altamente enantioselettiva, diretta di beta-chetoesteri, Angew. Chem., Int. Ed. 42 , 1367-1369, 2003.
Mukherjee, S.; Yang, JW; Hoffmann, S.; List, B., Asymmetric enamine catalysis, Chem. Rev. 107 , 5471-5569, 2007.
Olivares-Romero, JL e Juaristi, E., Sintesi di due nuove diammine chirali derivate da ( S )-prolina e loro valutazione come precursori delle diazaborolidine per la riduzione enantioselettiva mediata dal borano catalitico dei chetoni prochirali, Tetraedro 64, 9992-9998, 2008.
Seayad, J. e List, B., organocatalisi asimmetrica, Org. Biomol. Chem.3 , 719-724 , 2005.
Simon, L. e Goodman, JL, MechanismofBINOL−Phosphoric Acid-Catalyzed Strecker Reaction of Benzyl Imines, J. Am. Chem. Soc. 131 , 4070-4077, 2009.
Tanaka, K., Mori, A. e Inoue, S., Il dipeptide ciclico ciclo[( S )-fenilalanil-( S )-istidile] come catalizzatore per l'aggiunta asimmetrica di acido cianidrico alle aldeidi, J. Org. Chem.55 , 181-185 , 1990.