clic di chimica
"Click chemistry" è un termine introdotto da KB Sharpless nel 2001 per descrivere reazioni ad alto rendimento, di ampio respiro, che creano solo sottoprodotti che possono essere rimossi senza cromatografia, sono stereospecifiche, facili da eseguire e possono essere eseguita in modi facili da rimuovere. . o solventi benigni.Questo concetto si è sviluppato in parallelo con l'interesse all'interno dell'industria farmaceutica, dei materiali e di altro tipo per la capacità di generare grandi librerie di composti per la ricerca nella ricerca sulla scoperta.Sono stati sviluppati diversi tipi di reazione identificati che soddisfano questi criteri reazioni termodinamicamente favorite che portano specificamente a un prodotto, come reazioni di apertura dell'anello nucleofilo di epossidi e aziridine, reazioni carboniliche di tipo non aldolico, come formazione di idrazone ed eterociclo, aggiunte a legami multipli carbonio-carbonio, come la formazione ossidativa di epossidi e addizioni di Michael e reazioni di cicloaddizione.
Ad esempio, la cicloaddizione azide-alchino mostra che soddisfa molti dei prerequisiti. Molti degli alchini e delle azidi organiche monosostituiti di partenza sono disponibili in commercio, molti altri possono essere facilmente sintetizzati con un'ampia gamma di gruppi funzionali e la loro reazione di cicloaddizione fornisce selettivamente 1,2,3-triazoli.
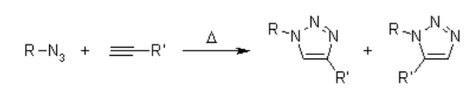
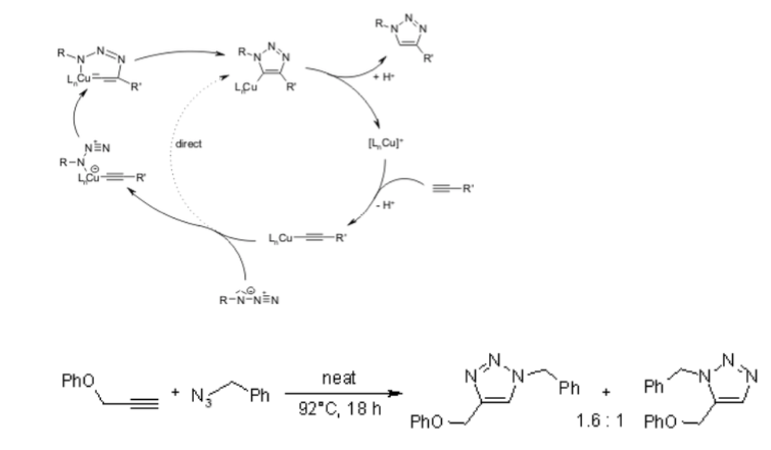
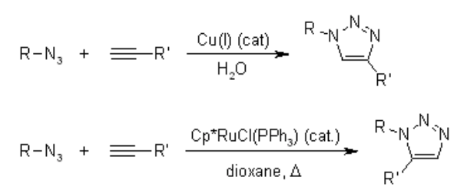
Sfortunatamente, la cicloaddizione huisgen 1,3-dipolare di alchini ad azidi richiede temperature elevate e spesso produce miscele dei due regioisomeri quando si usano alchini asimmetrici. In questo senso, la classica cicloaddizione 1,3-dipolare fallisce come una vera reazione di clic. Una variante catalizzata dal rame che segue un meccanismo diverso può essere eseguita in condizioni acquose, anche a temperatura ambiente. Inoltre, mentre la classica cicloaddizione di Huisgen 1,3-dipolare spesso fornisce miscele di regioisomeri, la reazione catalizzata dal rame consente la sintesi specifica dei regioisomeri 1,4-disostituiti. Al contrario, una reazione catalizzata dal rutenio sviluppata successivamente conferisce la regioselettività opposta alla formazione di triazoli 1,5-disostituiti. Pertanto, queste reazioni catalizzate soddisfano pienamente la definizione di chimica del clic e si sono concentrate sulla cicloaddizione azide-alchino come reazione di clic prototipo.
Meccanismo della cicloaddizione 1,3-dipolare Huisgen Azide-Alkyne:
Per conoscere il meccanismo si dovrebbe leggere della cicloaddizione 1,3-dipolare presente anche in molte ozonolisi. Questa reazione è altamente esotermica, ma l'elevata barriera di attivazione è responsabile di una velocità di reazione molto bassa, anche a temperature elevate. Un altro inconveniente è la formazione di regioisomeri, poiché le due possibili interazioni HOMO-LUMO dei substrati sono strettamente correlate in termini di energia. Pertanto, la reazione termica spesso fornisce miscele approssimativamente 1: 1 di entrambi i regioisomeri 1,4 e 1,5 sostituiti.