CHE COS'È LA SINTESI ASIMMETRICA?
La sintesi asimmetrica o detta anche sintesi chirale o enantioselettiva, è quella che introduce o favorisce una voluta chiralità. Questo ramo della sintesi organica è di vitale importanza per la produzione di medicinali poiché questi nel corpo attraverso vari meccanismi metabolici funzionano solo a una specifica chiralità degli enzimi presenti nel processo.
CONCETTI BASE IN SINTESI ASIMMETRICA:
PROCESSO REGIOSELETTIVO:
Una reazione è detta regioselettiva quando si verifica in modo predominante uno dei possibili isomeri strutturali:
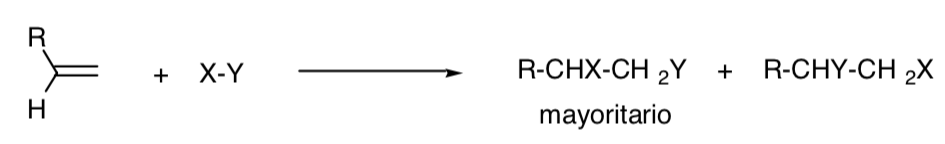
PROCESSO REGIOSPECIFICO:
Una reazione è detta regiospecifica quando si forma solo uno dei possibili isomeri strutturali:
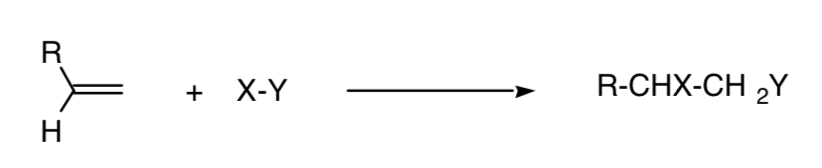
Questo concetto può essere esteso ad altri processi, come i processi di cicloaddizione 4+2:
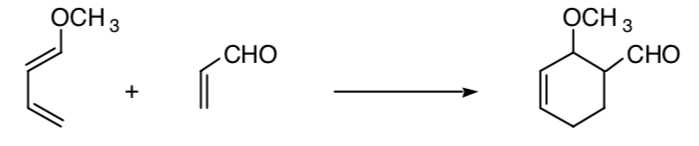
SINTESI STEREOSELETTIVA:
Una sintesi è detta stereoselettiva quando uno stereoisomero di una certa struttura ha origine in una proporzione notevolmente maggiore rispetto al resto degli altri stereoisomeri della stessa struttura.
Si parla di processo enantioselettivo quando uno degli enantiomeri è in maggioranza e di processo diastereoselettivo quando si forma in maggioranza un diastereomero o racemo diastereomerico.
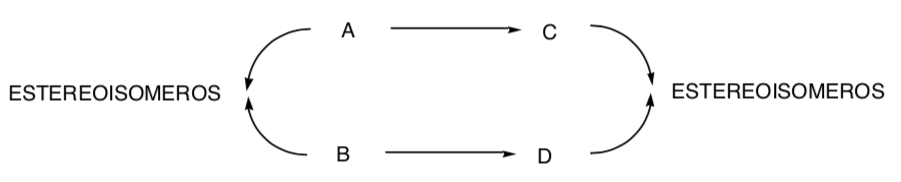
SINTESI STEREOSPECIFICA:
È uno in cui diversi stereoisomeri del substrato di partenza danno origine a prodotti stereoisomericamente diversi:
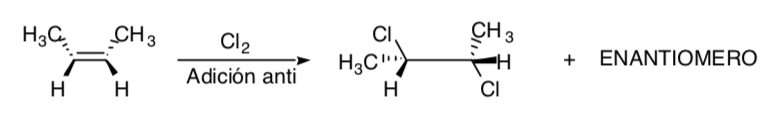
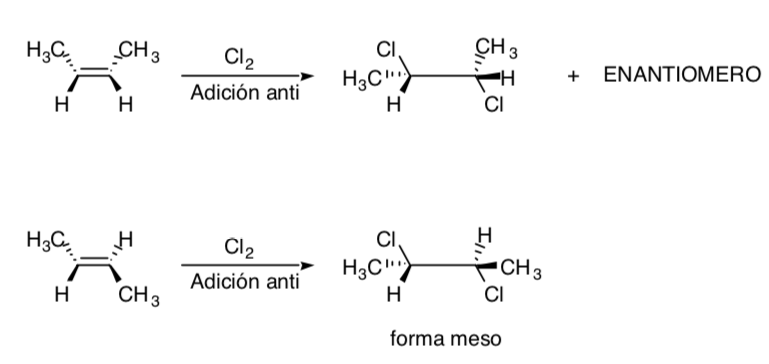
La clorurazione degli alcheni è un esempio di processo stereospecifico:
CONTROLLO STEREOSELETTIVO DI UNA SINTESI :
La necessità di un controllo stereoselettivo nella creazione di nuovi centri di chiralità è evidente nella successiva riduzione di uno dei gruppi carbonilici e del doppio legame presente nel chetone di Wieland-Miescher. Se il processo non è stereoselettivo, si otterranno quattro stereoisomeri del prodotto finale:
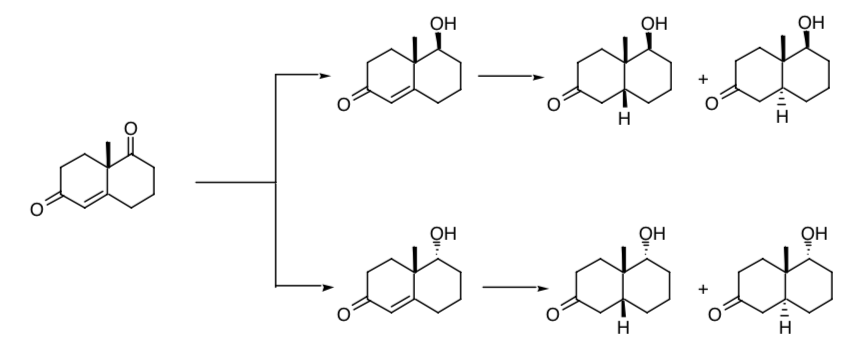
Se partiamo dal racemo di detto chetone otterremo, dal processo di riduzione, otto possibili stereoisomeri.
CONSIDERAZIONI STEREOCHIMICHE:
Una semplificazione del problema stereochimico può consistere nell'eliminare tutti i centri chirali e progettare una sintesi nel modo più stereoselettivo possibile, per la quale si deve tener conto non solo della configurazione di ciascun centro chirale, ma anche dell'influenza di alcuni centri chirali sulla altri. Se questa influenza non esiste (perché sono distanti), il problema può essere semplificato partendo da unità strutturali che includano i centri chirali con opportuna configurazione.
A volte è possibile utilizzare gruppi funzionali remoti come sintoni di controllo, come nel caso della ciclopropanazione di Simmons-Smith in cui un gruppo idrossilico consente di effettuare la ciclopropanazione in modo stereoselettivo coordinando il gruppo idrossilico con la specie carbenoide:
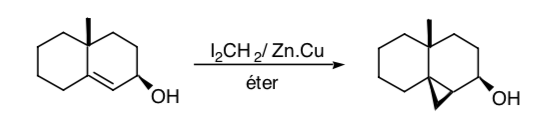
CONSIDERAZIONI SULLA SIMMETRIA:
Il riconoscimento di una simmetria nella molecola può essere molto utile, come nel caso dello squalene:
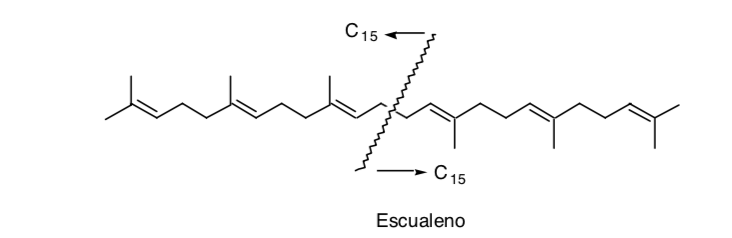
Anche se in realtà la sua sintesi non è stata effettuata per dimerizzazione (C15 + C15) ma aggiungendo due unità C11 a un'unità C8 centrale (C11 + C8 + C11).
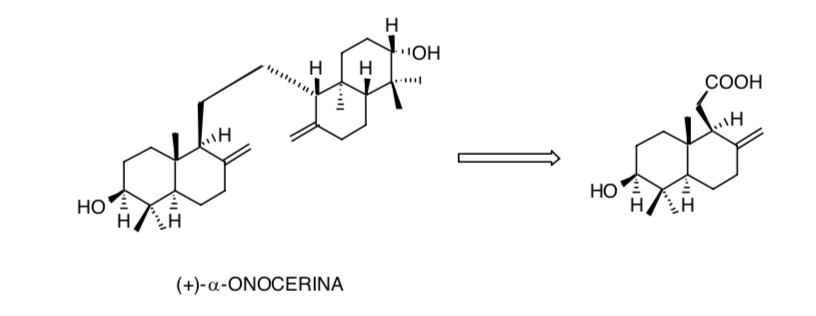
La considerazione della simmetria nella molecola (+) -α-onocerina riduce il problema della creazione di otto centri chirali a soli quattro:
Fonti consigliate per ulteriori informazioni:
1) Guo-Qiang Lin, Yue-Ming Li, Albert SC Chan. Principi e applicazioni della sintesi asimmetrica. Ed. Wiley-Interscience. Gran Bretagna, 2001.
2) Mark Rizzacasa e Michael Perkins. Sintesi stechiometrica asimmetrica. Ed. Stampa accademica di Sheffield. USA e Canada. 2000.
3) Jonathan MJ Williams. Catalisi in sintesi asimmetrica. Ed. Stampa accademica di Sheffield. USA e Canada. 1999.
4) RA Aitken e SN Kulényi. Sintesi asimmetrica. Ed. Blackie accademico e professionale. Gran Bretagna, 1992.
5) Grossman RB L'arte di scrivere meccanismi di reazione organici ragionevoli. Springer, New York. 2003
6) ROC normanna; Coxon JM Principi di sintesi organica. CRC Press, Boca Raton. 1993