ЧТО ТАКОЕ АСИММЕТРИЧНЫЙ СИНТЕЗ?
Асимметричный синтез, также называемый хиральным или энантиоселективным синтезом, представляет собой синтез, который вводит или способствует желаемой хиральности. Эта ветвь органического синтеза имеет жизненно важное значение для производства лекарств, так как они в организме через различные метаболические механизмы работают только при определенной хиральности ферментов, присутствующих в процессе.
ОСНОВНЫЕ ПОНЯТИЯ АСИММЕТРИЧНОГО СИНТЕЗА:
РЕГИОСЕЛЕКТИВНЫЙ ПРОЦЕСС:
Реакция называется региоселективной, если преобладает один из возможных структурных изомеров:
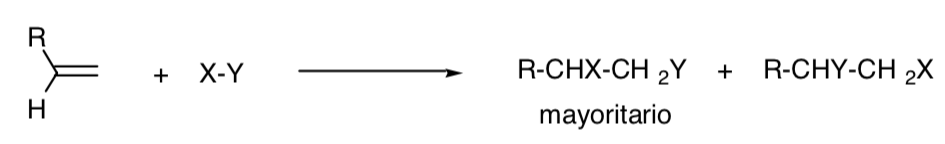
РЕГИОНАЛЬНЫЙ ПРОЦЕСС:
Реакция называется региоспецифической, если образуется только один из возможных структурных изомеров:
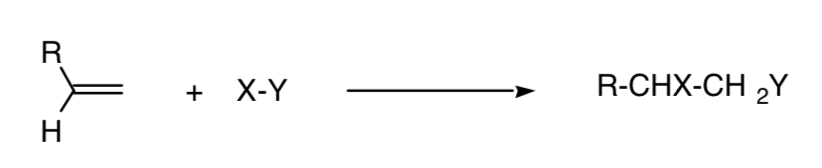
Эта концепция может быть распространена на другие процессы, такие как процессы циклоприсоединения 4+2:
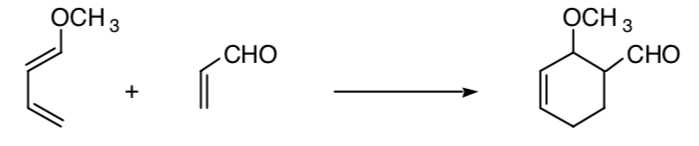
СТЕРЕОСЕЛЕКТИВНЫЙ СИНТЕЗ:
Синтез называется стереоселективным, когда стереоизомер определенной структуры образуется в значительно большей пропорции, чем остальные стереоизомеры той же структуры.
Мы говорим об энантиоселективном процессе, когда один из энантиомеров составляет большинство, и о диастереоселективном процессе, когда в большинстве случаев образуется диастереомер или диастереомерный рацемат.
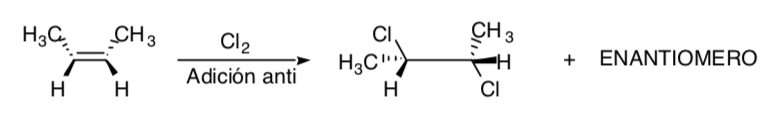
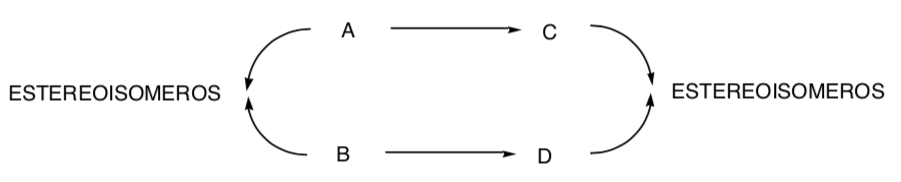
СТЕРЕОСПЕЦИФИЧЕСКИЙ СИНТЕЗ:
Это тот, в котором разные стереоизомеры исходного субстрата дают стереоизомерно разные продукты:
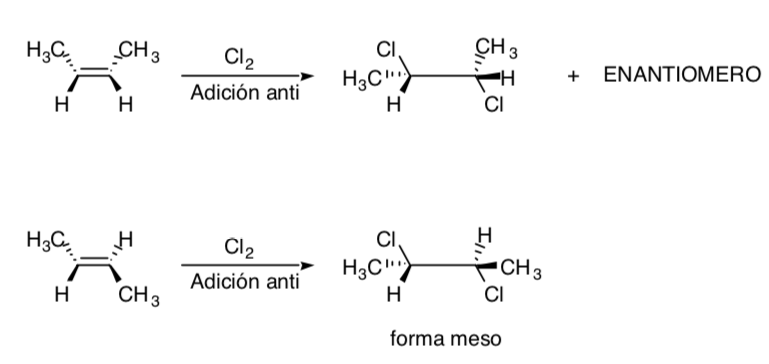
Хлорирование алкенов является примером стереоспецифического процесса:
СТЕРЕОСЕЛЕКТИВНЫЙ КОНТРОЛЬ СИНТЕЗА:
Необходимость стереоселективного контроля при создании новых центров хиральности проявляется в последовательном восстановлении одной из карбонильных групп и двойной связи, присутствующих в кетоне Виланда-Мишера. Если процесс не является стереоселективным, будут получены четыре стереоизомера конечного продукта:
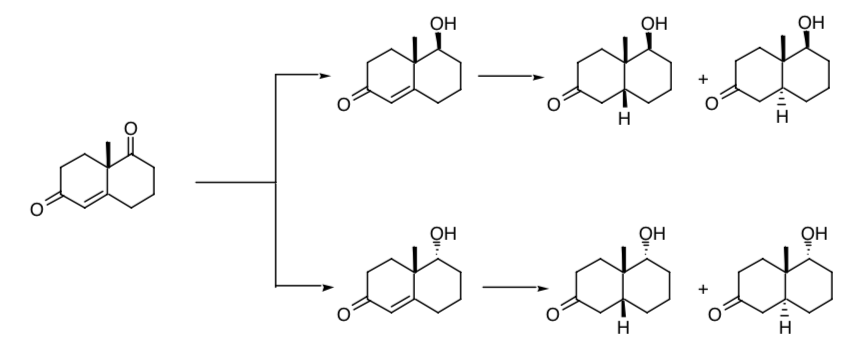
Если мы начнем с рацемата указанного кетона, мы получим в процессе восстановления восемь возможных стереоизомеров.
СТЕРЕОХИМИЧЕСКИЕ СООБРАЖЕНИЯ:
Упрощение стереохимической задачи может заключаться в исключении всех центров хиральности и планировании синтеза максимально стереоселективным способом, для чего необходимо учитывать не только конфигурацию каждого хирального центра, но и влияние некоторых хиральных центров на другие. Если этого влияния нет (поскольку они удалены), задачу можно упростить, исходя из структурных единиц, включающих в себя хиральные центры соответствующей конфигурации.
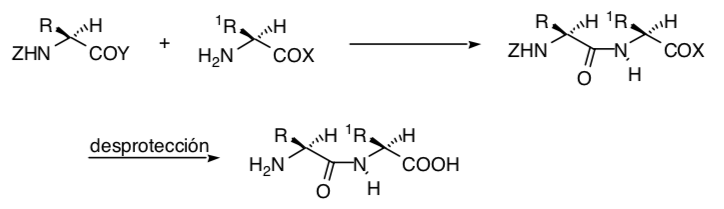
Иногда можно использовать удаленные функциональные группы в качестве контрольных синтонов, как в случае циклопропанирования Симмонса-Смита, в котором гидроксильная группа позволяет проводить циклопропанирование стереоселективно за счет координации гидроксильной группы с карбеноидными частицами:
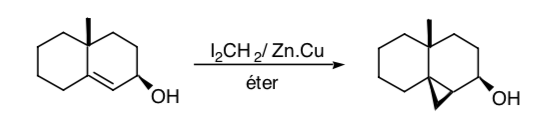
СООБРАЖЕНИЯ О СИММЕТРИИ:
Распознавание симметрии в молекуле может быть очень полезным, как в случае со скваленом:
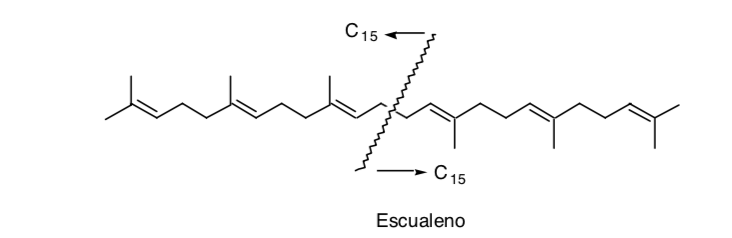
Хотя в действительности его синтез осуществлялся не путем димеризации (С15 + С15), а путем присоединения двух звеньев С11 к центральному звену С8 (С11 + С8 + С11).
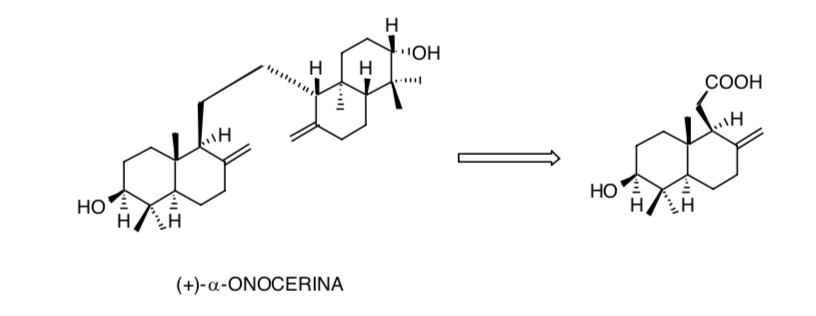
Учет симметрии в молекуле (+)-α-оноцерина сводит проблему создания восьми хиральных центров только к четырем:
Рекомендуемые источники для получения дополнительной информации:
1) Го-Цян Линь, Юэ-Мин Ли, Альберт С.К. Чан. Принципы и приложения асимметричного синтеза. Эд Wiley-Interscience. Великобритания, 2001 год.
2) Марк Риццакаса и Майкл Перкинс. Стехиометрический асимметричный синтез. Эд Шеффилд Академик Пресс. США и Канада. 2000.
3) Джонатан М.Дж. Уильямс. Катализ в асимметричном синтезе. Эд Шеффилд Академик Пресс. США и Канада. 1999.
4) Р.А. Айткен и С.Н. Кулени. Асимметричный синтез. Эд Блэки Академический и профессиональный. Великобритания, 1992 год.
5) Гроссман Р.Б. Искусство написания разумных механизмов органических реакций. Спрингер, Нью-Йорк. 2003 г.
6) нормандская РПЦ; Коксон Дж. М. Принципы органического синтеза. CRC Press, Бока-Ратон. 1993 г.