QU'EST-CE QUE LA SYNTHÈSE ASYMÉTRIQUE ?
La synthèse asymétrique ou encore appelée synthèse chirale ou énantiosélective, est celle qui introduit ou favorise une chiralité recherchée. Cette branche de la synthèse organique est d'une importance vitale pour la fabrication de médicaments puisque ceux-ci dans le corps à travers divers mécanismes métaboliques ne fonctionnent qu'à une chiralité spécifique des enzymes présentes dans le processus.
CONCEPTS DE BASE EN SYNTHESE ASYMETRIQUE :
PROCESSUS REGIOSELECTIF :
Une réaction est dite régiosélective lorsque l'un des isomères structuraux possibles se produit principalement :
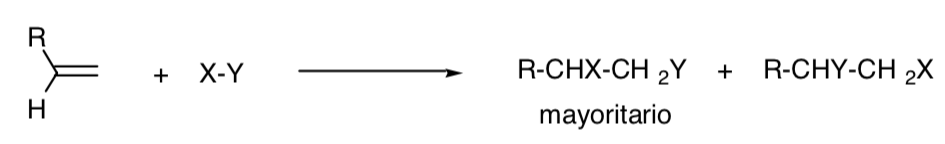
PROCESSUS RÉGIOSPÉCIFIQUE :
Une réaction est dite régiospécifique lorsqu'un seul des isomères structuraux possibles est formé :
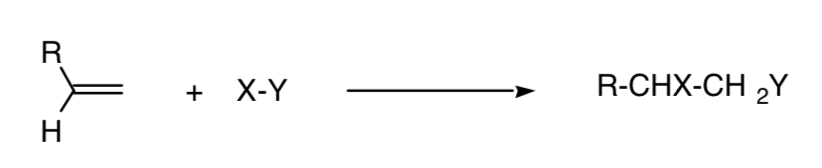
Ce concept peut être étendu à d'autres procédés, comme les procédés de cycloaddition 4+2 :
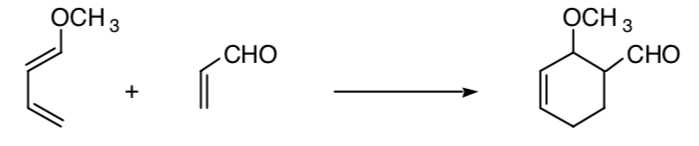
SYNTHÈSE STÉRÉOSÉLECTIVE :
Une synthèse est dite stéréosélective lorsqu'un stéréoisomère d'une certaine structure provient d'une proportion considérablement plus élevée que le reste des autres stéréoisomères de la même structure.
On parle de processus énantiosélectif lorsque l'un des énantiomères est majoritaire et de processus diastéréosélectif lorsqu'un diastéréoisomère ou un racémate diastéréomérique se forme majoritairement.
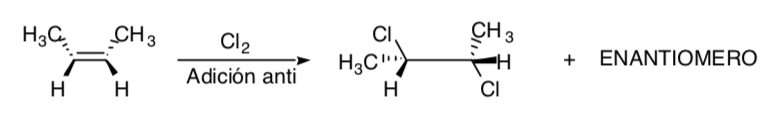
SYNTHESE STÉRÉOSPÉCIFIQUE :
C'est celui dans lequel différents stéréoisomères du substrat de départ donnent lieu à des produits stéréoisomèrement différents :
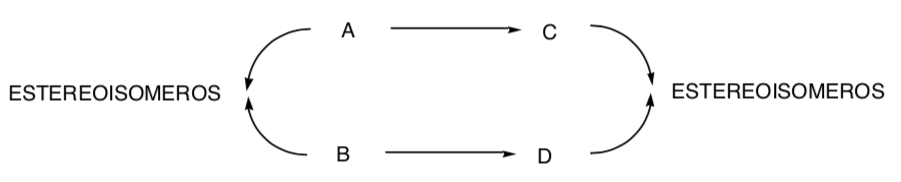
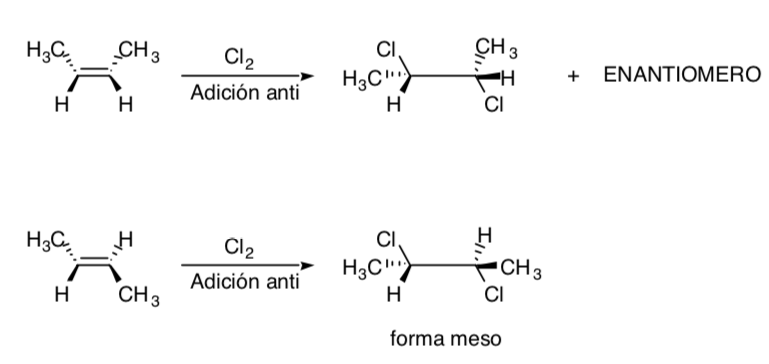
La chloration des alcènes est un exemple de processus stéréospécifique :
CONTRÔLE STÉRÉOSÉLECTIF D'UNE SYNTHÈSE :
La nécessité d'un contrôle stéréosélectif dans la création de nouveaux centres de chiralité est évidente dans la réduction successive de l'un des groupes carbonyle et de la double liaison présente dans la cétone Wieland-Miescher. Si le procédé n'est pas stéréosélectif, quatre stéréoisomères du produit final seront obtenus :
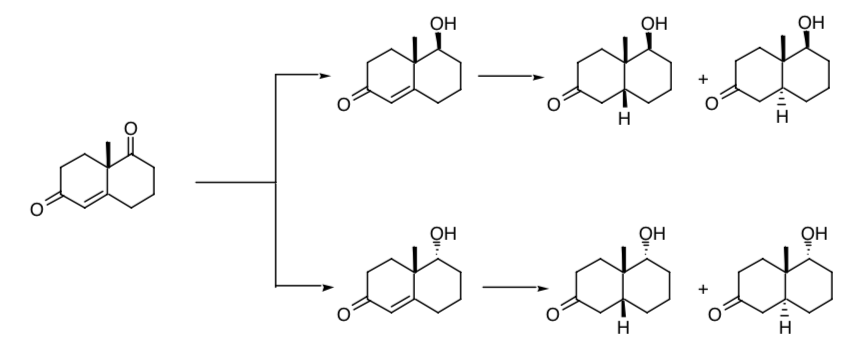
Si nous partons du racémate de ladite cétone, nous obtiendrons, à partir du processus de réduction, huit stéréoisomères possibles.
CONSIDÉRATIONS STÉRÉOCHIMIQUES :
Une simplification du problème stéréochimique peut consister à éliminer tous les centres de chiralité et à prévoir une synthèse la plus stéréosélective possible, pour laquelle non seulement la configuration de chaque centre chiral doit être prise en compte, mais aussi l'influence de certains centres chiraux sur autres. Si cette influence n'existe pas (parce qu'ils sont éloignés), le problème peut être simplifié à partir d'unités structurales qui incluent les centres chiraux avec la configuration appropriée.
Il est parfois possible d'utiliser des groupements fonctionnels distants comme synthons témoins, comme c'est le cas de la cyclopropanation de Simmons-Smith dans laquelle un groupement hydroxyle permet de réaliser la cyclopropanation de manière stéréosélective par coordination du groupement hydroxy avec l'espèce carbénoïde :
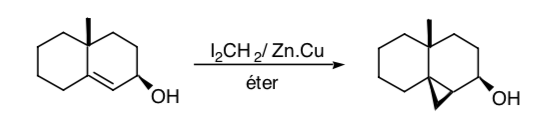
CONSIDÉRATIONS DE SYMÉTRIE :
La reconnaissance d'une symétrie dans la molécule peut être très utile, comme c'est le cas du squalène :
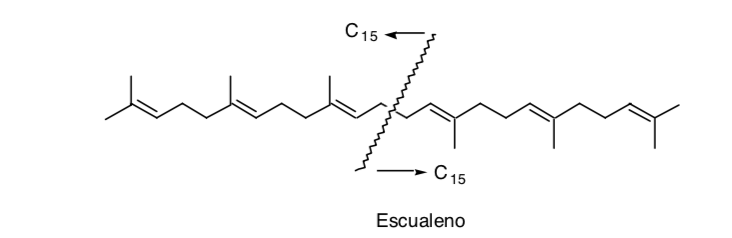
Bien qu'en réalité sa synthèse n'ait pas été réalisée par dimérisation (C15 + C15) mais en ajoutant deux unités C11 à une unité centrale C8 (C11 + C8 + C11).
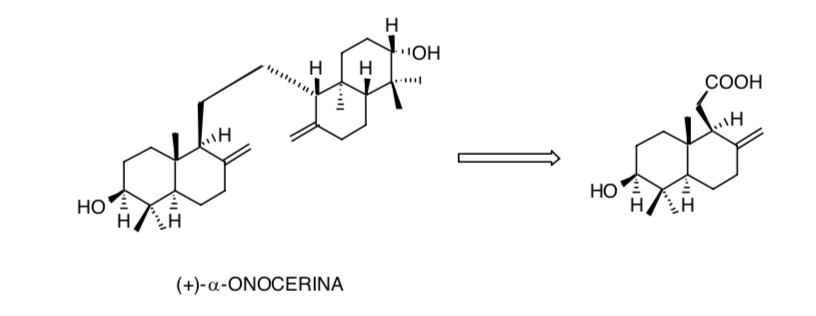
La prise en compte de la symétrie dans la molécule (+)-α-onocérine réduit le problème de la création de huit centres chiraux à seulement quatre :
Sources recommandées pour plus d'informations :
1) Guo-Qiang Lin, Yue-Ming Li, Albert SC Chan. Principes et applications de la synthèse asymétrique. Ed. Wiley-Interscience. Grande-Bretagne, 2001.
2) Mark Rizzacasa et Michael Perkins. Synthèse asymétrique stoechiométrique. Ed. Sheffield Academic Press. États-Unis et Canada. 2000.
3) Jonathan MJ Williams. Catalyse en synthèse asymétrique. Ed. Sheffield Academic Press. États-Unis et Canada. 1999.
4) RA Aitken et SN Kulényi. Synthèse asymétrique. Ed. Blackie Académique et Professionnel. Grande-Bretagne, 1992.
5) Grossman RB L'art d'écrire des mécanismes de réaction organique raisonnable. Springer, New York. 2003
6) Norman ROC; Coxon JM Principes de synthèse organique. CRC Press, Boca Raton. 1993