O QUE É SÍNTESE ASSIMÉTRICA?
A síntese assimétrica ou também chamada de síntese quiral ou enantiosseletiva, é aquela que introduz ou favorece uma quiralidade desejada. Este ramo da síntese orgânica é de vital importância para a fabricação de medicamentos já que estes no organismo através de diversos mecanismos metabólicos só atuam em uma quiralidade específica das enzimas presentes no processo.
CONCEITOS BÁSICOS EM SÍNTESE ASSIMÉTRICA:
PROCESSO REGIOSELETIVO:
Uma reação é chamada regiosseletiva quando um dos possíveis isômeros estruturais ocorre predominantemente:
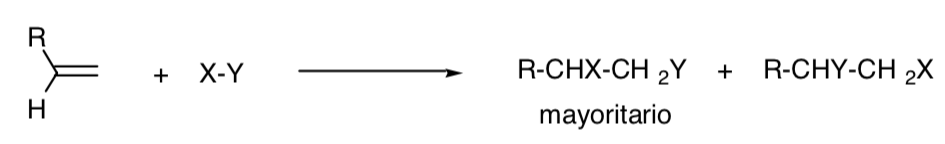
PROCESSO REGIOESPECÍFICO:
Uma reação é chamada de regioespecífica quando apenas um dos possíveis isômeros estruturais é formado:
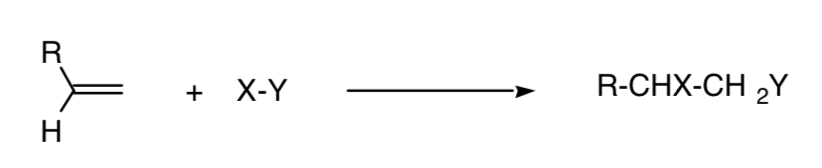
Este conceito pode ser estendido a outros processos, como processos de cicloadição 4+2:
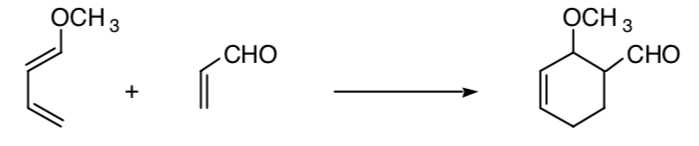
SÍNTESE ESTEREOSELECTIVA:
Uma síntese é chamada estereosseletiva quando um estereoisômero de uma determinada estrutura se origina em uma proporção consideravelmente maior do que o resto dos outros estereoisômeros da mesma estrutura.
Falamos de um processo enantiosseletivo quando um dos enantiômeros está em maioria e de um processo diastereosseletivo quando um diastereômero ou racemato diastereomérico é formado em maioria.
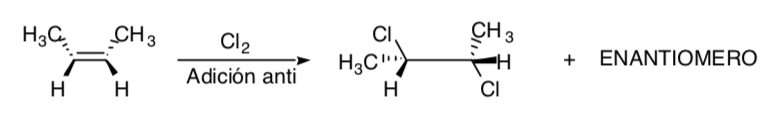
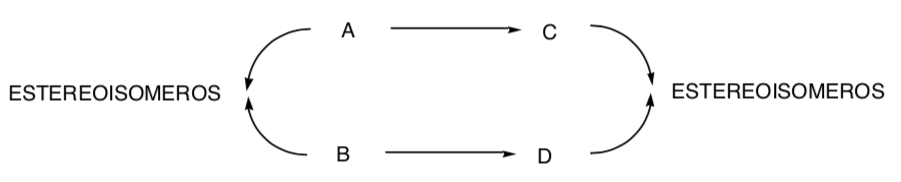
SÍNTESE ESTEREOESPECÍFICA:
É aquele em que diferentes estereoisômeros do substrato inicial dão origem a produtos estereoisomericamente diferentes:
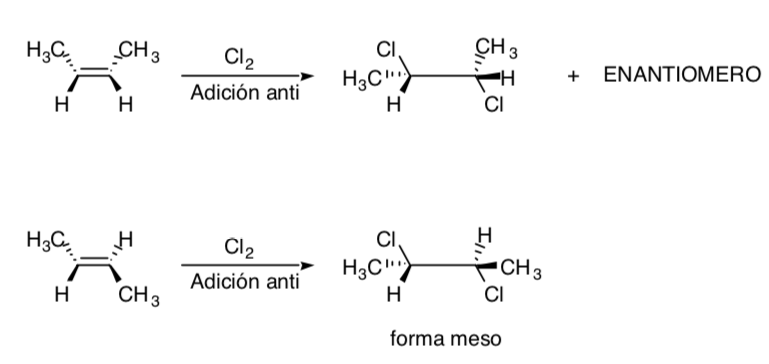
A cloração de alcenos é um exemplo de um processo estereoespecífico:
CONTROLE ESTEREOSELECTIVO DE UMA SÍNTESE:
A necessidade de controle estereosseletivo na criação de novos centros de quiralidade fica evidente na redução sucessiva de um dos grupos carbonila e da dupla ligação presente na cetona de Wieland-Miescher. Se o processo não for estereosseletivo, serão obtidos quatro estereoisômeros do produto final:
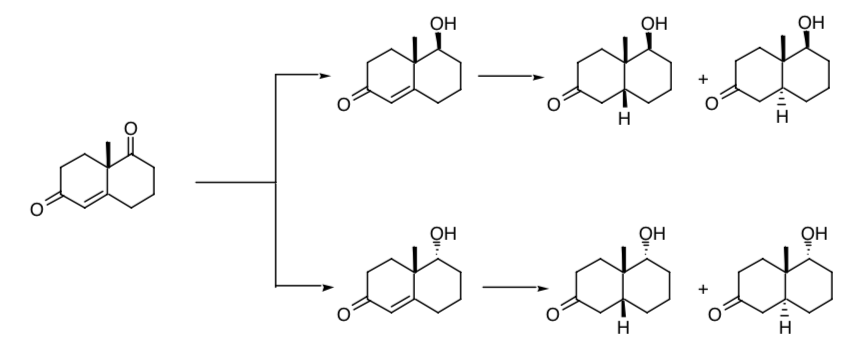
Se partirmos do racemato da referida cetona obteremos, do processo de redução, oito possíveis estereoisômeros.
CONSIDERAÇÕES ESTEREOQUÍMICAS:
Uma simplificação do problema estereoquímico pode consistir em eliminar todos os centros quirais e planejar uma síntese da forma mais estereosseletiva possível, para a qual deve-se levar em consideração não apenas a configuração de cada centro quiral, mas também a influência de alguns centros quirais sobre outros. Caso essa influência não exista (porque estão distantes), o problema pode ser simplificado a partir de unidades estruturais que incluam os centros quirais com a configuração adequada.
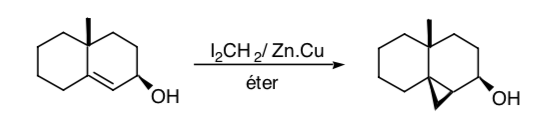
Às vezes é possível usar grupos funcionais remotos como síntons de controle, como é o caso da ciclopropanação de Simmons-Smith em que um grupo hidroxila permite que a ciclopropanação seja realizada estereosseletivamente pela coordenação do grupo hidroxi com as espécies carbenoides:
CONSIDERAÇÕES DE SIMETRIA:
O reconhecimento de uma simetria na molécula pode ser muito útil, como é o caso do esqualeno:
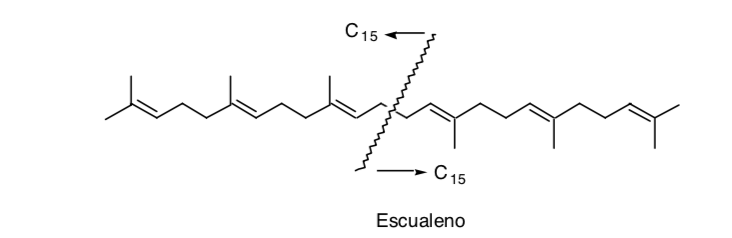
Embora, na realidade, sua síntese não tenha sido realizada por dimerização (C15 + C15), mas pela adição de duas unidades C11 a uma unidade central C8 (C11 + C8 + C11).
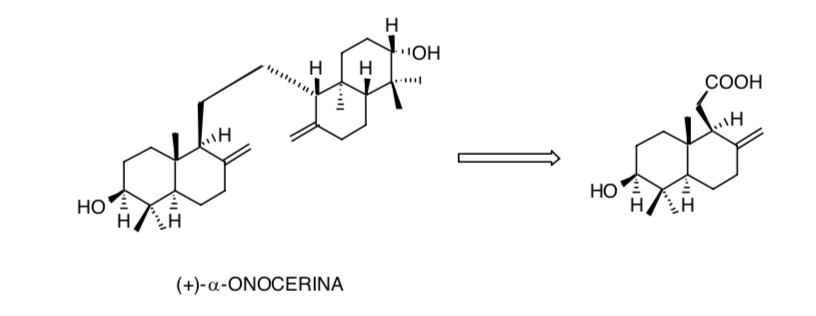
A consideração da simetria na molécula de (+)-α-onocerina reduz o problema de criar oito centros quirais para apenas quatro:
Fontes recomendadas para mais informações:
1) Guo-Qiang Lin, Yue-Ming Li, Albert SC Chan. Princípios e Aplicações da Síntese Assimétrica. Ed. Wiley-Interscience. Grã-Bretanha, 2001.
2) Mark Rizzacasa e Michael Perkins. Síntese Assimétrica Estequiométrica. Ed. Sheffield Academic Press. EUA e Canadá. 2000.
3) Jonathan MJ Williams. Catálise em Síntese Assimétrica. Ed. Sheffield Academic Press. EUA e Canadá. 1999.
4) RA Aitken e SN Kulényi. Síntese Assimétrica. Ed. Blackie Acadêmico e Profissional. Grã-Bretanha, 1992.
5) Grossman RB A Arte de Escrever Mecanismos de Reação Orgânica Razoáveis. Springer, Nova York. 2003
6) Norman ROC; Coxon JM Princípios de Síntese Orgânica. CRC Press, Boca Raton. 1993