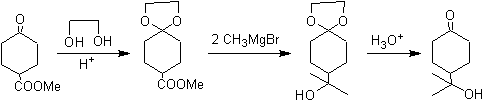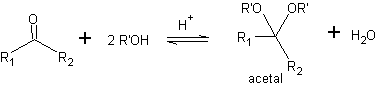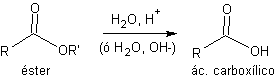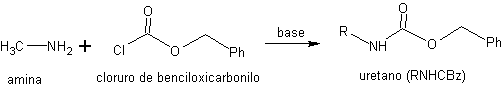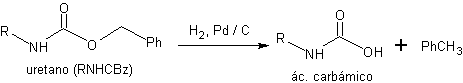Dans la conception de synthèse d'une molécule à plusieurs groupes fonctionnels, il est très courant qu'un réactif qui produit une transformation sur un groupe fonctionnel affecte également un autre groupe présent dans une autre partie de la molécule. Dans les cas où une chimiosélectivité adéquate ne peut pas être obtenue sur le groupe fonctionnel à transformer, le groupe qui doit rester inchangé est
protégé en le convertissant temporairement en fonctionnalité inerte aux conditions de réaction.
L'opération de protection nécessite la procédure suivante :
· Protéger le(s) groupe(s) fonctionnel(s) le(s) plus réactif(s) de manière sélective et dans des conditions douces.
· Effectuer la réaction sur le groupe fonctionnel requis sans affecter le groupe protégé
· Groupe fonctionnel non protégé, soumis à la protection
La l'action de protection doit satisfaire aux exigences de base suivantes :
· La réaction doit bien fonctionner et être chimiosélective.
· Le nouveau groupe fonctionnel doit être stable dans les conditions réactionnelles du groupe qui va réagir.
· La fonctionnalité introduite ne doit pas ajouter de centres chiraux à la molécule pouvant générer des diastéromères
· Le groupe fonctionnel d'origine doit pouvoir être régénéré avec un bon rendement et sans affecter le reste de la molécule.
L'utilisation de protecteurs doit être réduite au strict minimum et leur choix doit être tel qu'ils n'aient pas besoin d'être remplacés tout au long de la synthèse, car les étapes d'introduction et d'élimination (déprotection) ajoutent du coût et du travail à la synthèse et diminuent le rendement. Exemple.
Le groupe cétonique de la molécule a été protégé en le transformant en un cétal cyclique, avec un éthanediol en milieu légèrement acide, ensuite cette molécule a été mise à réagir avec deux moles de bromure de phénylmagnésium, qui agit sur le groupe ester, pour le transformer en un alcool tertiaire, avec deux substituants méthyle apportés par le Grignard. Enfin, le cétal cyclique est hydrolysé pour régénérer la cétone.
En pratique, il n'y a pas de groupe de protection parfait pour chaque fonctionnalité, mais on peut affirmer qu'il existe une grande batterie de protecteurs possibles, chacun remplissant les conditions ci-dessus dans certaines circonstances. Une courte liste de protection des groupes les plus courants est incluse dans les sections suivantes :
PROTECTION CONTRE LES ALDÉHYDES ET CÉTONES
Une façon de protéger les cétones et les aldéhydes est leur conversion en acétals. Les acétals peuvent être déprotégés dans des conditions douces par des réactions d'hydrolyse acide.
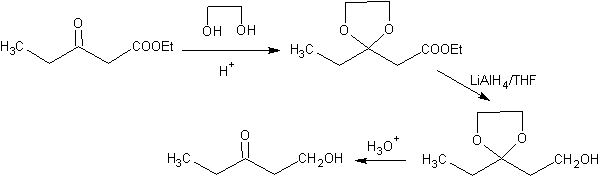
Dans la réduction d'un cétoester en cétoalcool. La protection de la cétone sous la forme d'un acétal est très pratique car l'acétal résiste aux conditions réductrices dans lesquelles il sera utilisé dans la conversion du groupe ester en groupe hydroxyle.
Le schéma suivant montre la séquence de synthèse complète qui permet de réaliser la réduction de l'ester sans affecter la cétone :
Dans la première étape, la cétone est convertie en acétal cyclique par réaction avec l'éthylène glycol en présence d'un catalyseur acide. Dans la deuxième étape, l'ester est réduit avec LiAlH 4 . Ce réactif n'attaque pas l'acétal. Enfin, dans la troisième étape, l'alcool-acétal est traité en milieu aqueux acide. Dans ces conditions, l'acétal est hydrolysé, régénérant le groupe carbonyle cétonique. Chacune des trois étapes est chimiosélective puisque dans chacune d'elles la réaction préférée d'un groupe fonctionnel est réalisée. en présence d'un autre.
PROTECTION CONTRE LES ACIDES CARBOXYLIQUES
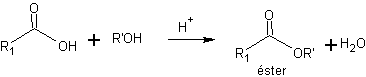
a) les esters éthyliques et méthyliques. La forme la plus courante de protection des acides carboxyliques est leur conversion en esters.
Les esters les plus utilisés sont ceux d'éthyle et de méthyle qui peuvent être facilement obtenus au moyen de la réaction d'estérification de Fischer. La déprotection est réalisée par hydrolyse acide ou basique (saponification) du groupement ester.
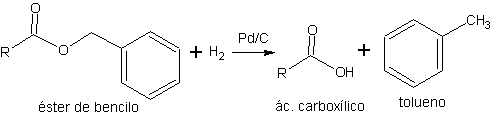
b) Esters benzyliques La déprotection des esters éthyliques ou méthyliques peut être problématique dans les systèmes polyfonctionnels en raison de l'acidité ou de la basicité élevée qui doit être employée dans le procédé d'hydrolyse. Pour cette raison, on utilise d'autres types d'esters qui permettent de réaliser l'étape de déprotection dans des conditions neutres ou de faible acidité.
Les esters benzyliques peuvent être déprotégés par hydrogénolyse (clivage brisé par H 2 ) de la liaison CO, à température ambiante et dans des conditions neutres.
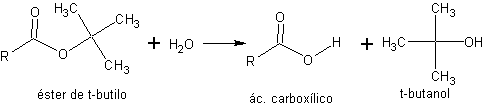
c) les esters de t-butyle. Les esters de t-butyle peuvent être facilement hydrolysés en acides carboxyliques correspondants, dans des conditions légèrement acides et à température ambiante, en raison de la formation facile du carbocation de t-butyle.
PROTECTION CONTRE L'ALCOOL
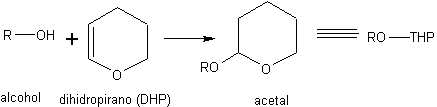
pour) Comme les acétals. Le DHP (dihydropyrane) est utilisé pour la conversion d'alcools en acétals mixtes. Lorsque l'alcool est converti en acétal, la déprotection est effectuée par hydrolyse acide.
b) Sous forme d'éthers benzyliques. Puisque les éthers sont l'un des groupes fonctionnels les moins réactifs, il n'est pas surprenant que beaucoup d'entre eux soient utilisés comme groupes protecteurs. Cependant, l'inertie chimique des éthers est un inconvénient lors de leur utilisation comme groupements protecteurs car l'étape de déprotection nécessite, dans de nombreux cas, l'utilisation de conditions réactionnelles très drastiques.
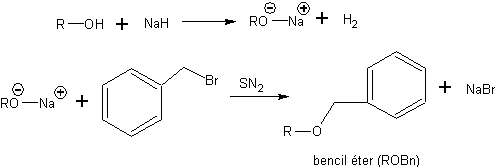
C'est pourquoi, en pratique, le nombre de types d'éthers utilisés comme protecteurs de l'alcool est considérablement réduit. L'un des éthers les plus largement utilisés dans le procédé de protection contre l'alcool est l'éther benzylique (ROBn). L'étape de protection est réalisée par ionisation préalable de l'alcool, par exemple avec NaH, suivie d'une attaque SN2 de l'alcoolate généré sur le bromure ou le chlorure de benzyle.
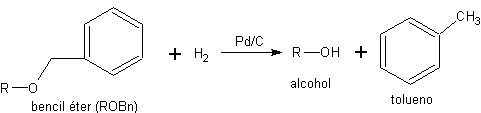
Les éthers benzyliques sont très appréciés des chimistes organiques de synthèse car ils allient une grande facilité d'introduction, une grande inertie chimique et une grande chimiosélectivité dans l'étape de déprotection. La déprotection est effectuée dans des conditions neutres et à température ambiante, au moyen d'une réaction d'hydrogénolyse.
b) Sous forme d'éthers trityliques. Les éthers trityliques, ou éthers triphénylméthane, sont utilisés pour la protection chimiosélective des hydroxyles primaires. Les groupes hydroxyles secondaires et tertiaires, étant plus stériquement encombrés que les primaires, ne forment pas d'éthers trityliques car le chlorure de triphénylméthyle (chlorure de trityle) est un réactif très volumineux.
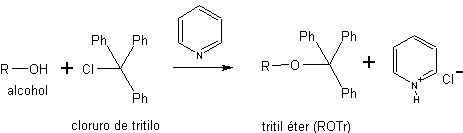
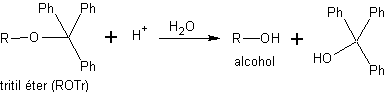
Les éthers de triphénylméthane (éthers trityliques) sont obtenus par réaction d'alcools primaires avec du chlorure de trityle en présence d'une base azotée tertiaire non nucléophile, telle que la pyridine. La mission de la base est de neutraliser le HCl généré lors de la réaction. La déprotection de ce type d'éthers est réalisée par hydrolyse acide douce. Les produits sont deux alcools
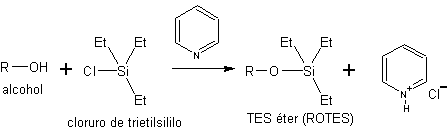
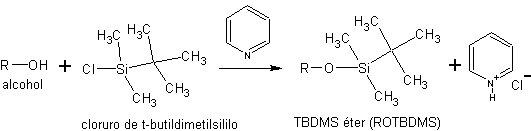
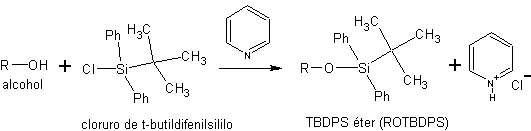
c) sous forme d'éthers silyliques. Les éthers silyliques sont obtenus en faisant réagir des alcools avec des chlorures de silyle. Tels que le chlorure de triéthylsilyle (Et 3 SiCl), le chlorure de t-butyldiméthylsilyle (t-BuMe 2 SiCl) ou le chlorure de t-butyldiphénylsilyle (t-BuPh 2 SiCl).
La synthèse de ces éthers est réalisée en présence d'une base non nucléophile pour neutraliser l'HCl qui génère la réaction
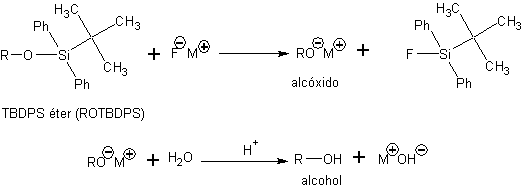
Les éthers silyliques peuvent être hautement chimiosélectivement déprotégés par réaction avec des sels contenant l'anion fluorure. Cette déprotection est basée sur la force de la liaison Si-F, l'une des liaisons covalentes les plus fortes qui existent, qui conduit la réaction vers la formation du fluorosilane correspondant.
L'autre produit de cette réaction est un sel de l'anion alcoxyde (RO - M + ). Pour obtenir l'alcool, une étape d'hydrolyse est réalisée pour provoquer la protonation de l'anion alcoxyde.
La taille des trois réactifs de silylation augmente dans l'ordre suivant :
Et3SiCl < t-Bu(CH 3 ) 2 SuCl < t-Bu( Ph2 )SiCl
Augmente la taille du réactif de silylation
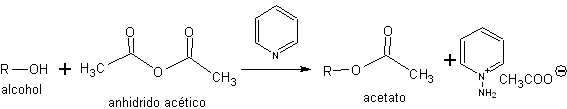
d) protection sous forme d'esters. Les alcools peuvent également être protégés en les convertissant en esters.
L'un des esters les plus courants dans la stratégie de protection-déprotection de l'alcool est l'ester d'acide acétique (acétates).
PROTECTION DES AMINES
La paire électronique libre située sur l'atome d'azote des amines est responsable de leur nucléophilie et de leur basicité. Le moyen évident de masquer les propriétés basiques et nucléophiles des amines est leur conversion en composés dans lesquels la paire d'électrons de l'azote est conjuguée à un groupe électroattracteur.
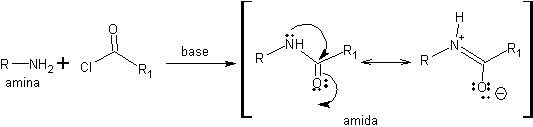
La conversion des amines en amides peut être une bonne solution pour la protection des groupements aminés car la délocalisation de la densité électronique associée à l'atome d'azote diminue la basicité et la nucléophilie de cette paire électronique.
Cette protection présente un inconvénient : l'étape de déprotection. Les amides sont peu réactifs et l'hydrolyse du groupe amide doit être réalisée dans des conditions de basicité (ou d'acidité) et de température élevées qui peuvent affecter d'autres groupes fonctionnels présents dans la structure. Par conséquent, les amines sont généralement protégées sous la forme d'uréthanes et non d'amides.
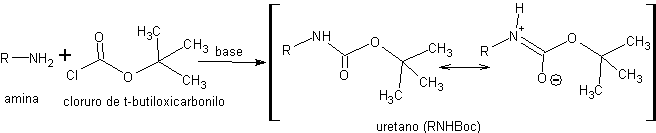
Dans les uréthanes, la densité électronique de l'atome d'azote est également diminuée par conjugaison avec un groupe carbonyle. L'avantage de ces protecteurs est qu'ils peuvent être éliminés dans des conditions douces et hautement chimiosélectives. L'un des réactifs utilisés dans la protection des amines sous forme d'uréthanes est le chlorure de t-butyloxycarbonyle. Les uréthanes obtenus avec ce réactif sont abrégés en RNHBoc
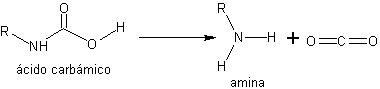
La réaction du RNHBoc avec des acides aqueux, dans des conditions douces d'acidité et de température, génère un acide carbamique instable et décarboxylé in situ. donnant naissance à l'amine libre. Un autre type d'uréthanes utilisés dans la protection des amines sont ceux obtenus dans la réaction avec le chlorure de benzyloxycarbonyle.
Les amines (RNH 2 ) protégées sous forme de benzyloxycarbonyl uréthanes sont abrégées en RNHCBz
Ces uréthanes sont déprotégés en conditions neutres par une réaction d'hydrogénolyse.
caisse de Dérivés N-CBz :
1er. Génération d'acide carbamique par hydrogénolyse
2ème. Décarboxylation spontanée de l'acide carbamique