Expliquez pourquoi, lorsqu'une solution de (S)-3-phényl-2-butanone dans de l'éthanol aqueux est traitée avec des acides ou des bases, elle perd progressivement son activité optique. (b) Pourquoi la racémisation du composé de la section précédente en milieu acide se produit-elle à la même vitesse que l'halogénation en milieu acide ? (c) Pourquoi l'iodation dudit composé en milieu acide se produit-elle à la même vitesse que la bromation catalysée par un acide ?
SOLUTION:
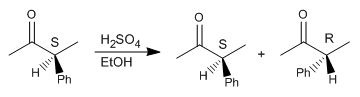
Étape 1. Protonation du carbonyle
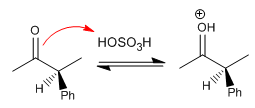
Étape 2. Formation de l'énol (étape lente)
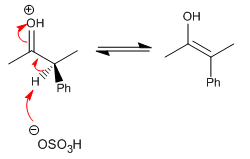
Étape 3. Protonation de l'énol avec formation du racémate
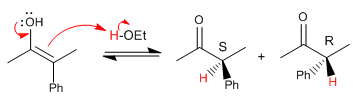
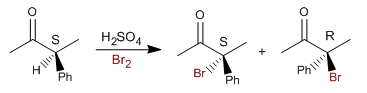
Voyons maintenant le mécanisme d'halogénation avec le brome ou l'iode de la position alpha de ce carbonyle.
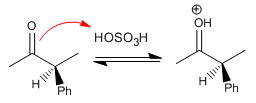
Étape 1. Protonation du carbonyle
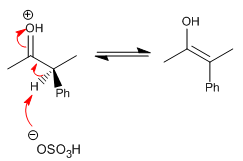
Étape 2. Formation de l'énol (étape lente)
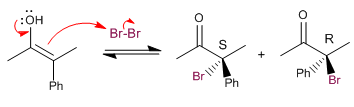
Stade 3. Attaque nucléophile de l'énol sur le brome
La racémisation et l'halogénation présentent la même étape lente (formation d'énol), se déroulant à la même vitesse.