Les aldéhydes et les cétones réagissent avec les halogènes en milieu acide ou basique, produisant la substitution des hydrogènes aux halogènes.
Halogénation de la propanone en milieu acide : 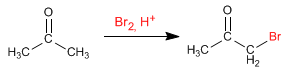
Le mécanisme d'halogénation en milieu acide comporte les étapes suivantes :
Étape 1. Formation de l'énol 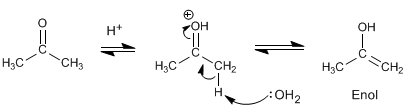
Etape 2. Attaque nucléophile de l'énol sur l'halogène aidée par le transfert d'oxygène para. 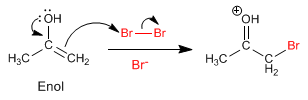
Étape 3. Déprotonation 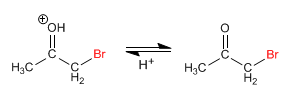
En travaillant avec un équivalent de réactif, l'halogénation s'arrête dans un premier ajout et les polyalogénations ne se produisent pas. L'étape clé du mécanisme est la formation de l'énol et cette étape nécessite la protonation de l'oxygène du carbonyle. Une fois halogénée, la position de l'oxygène devient moins basique, en raison de l'effet électronégatif du brome, protonant moins bien.
Halogénation de la propanone en milieu basique : 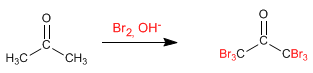
L'halogénation en milieu basique a le mécanisme suivant :
Étape 1. Formation de l'énolate 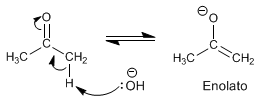
Stade 2. Attaque nucléophile de l'énolate sur l'halogène favorisée par le transfert d'oxygène par. 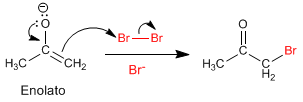
Ce mécanisme est répété encore 5 fois, remplaçant tous les hydrogènes par des halogènes. Dans ce cas la réaction ne s'arrête pas car le produit halogéné est plus réactif que la propanone de départ. La base élimine mieux les hydrogènes du produit halogéné (ils sont plus acides), rendant impossible l'arrêt de la réaction.