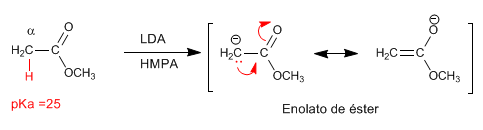
Les esters ont des hydrogènes acides avec pKa = 25 dans leur position, qui peuvent être soustraits à l'aide de bases. La base conjuguée est un ester énolate, une espèce hautement nucléophile qui attaque un nombre varié d'électrophiles.
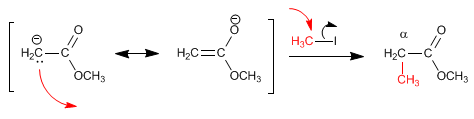
Réaction d'énolates d'ester avec des haloalcanes primaires
L'ester d'énolate agit comme un nucléophile, réagissant avec les haloalcanes primaires via le mécanisme S N 2. Les haloalcanes secondaires et tertiaires donnent principalement des éliminations, en raison de la basicité importante de l'énolate.
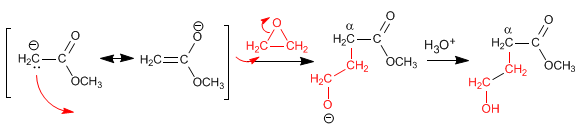
Réaction d'énolates d'ester avec des oxacyclopropanes (époxydes)
L'ester énolate attaque et ouvre l'oxacyclopropane. L'oxacyclopropane contribue au carbone a de l'énolate une chaîne à deux carbones, qui contient un -OH sur le deuxième carbone.
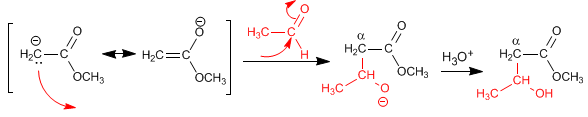
Réaction d'énolates d'ester avec des aldéhydes et des cétones
Le produit final dans des conditions appropriées peut se cycliser pour former une lactone.