Déconnexion des composés 1,2-dioxygénés
1.- Composés a
-hydroxycarbonyle
Les composés α-hydroxycarbonyle sont déconnectés au niveau de la liaison CC qui relie les deux fonctions. Cette opération conduit à un synthon naturel ou logique (le synthon cationique) et à un synthon non naturel ou illogique (le synthon anionique). Les équivalents synthétiques peuvent être respectivement des aldéhydes et des ions acétylures.
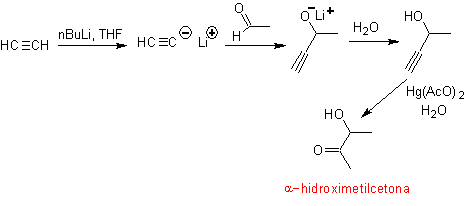
Le groupement acétylène terminal avec les sels mercuriques en milieu acide forme une méthylcétone. Cette réaction est également utile si le groupe acétylène est interne et également symétrique.
Un cas particulier d'α-hydroxycétones sont les benzoïnes ou les diarylhydroxycétones , où les deux groupes R sont aromatiques ou hétérocycles. Les benjoins sont le résultat de l'auto-condensation du benzaldéhyde catalysée par les ions cyanures.
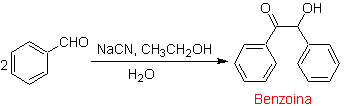
Les benzoïnes peuvent ne pas être symétriques, par exemple l'un des aldéhydes peut être un pyridine aldéhyde. L'ion cyanure ne catalyse pas les aldéhydes aliphatiques, qui subissent le même couplage en présence de sels de thiazolium.
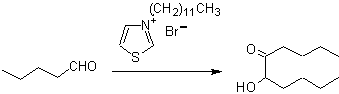
Les α-hydroxycétones aliphatiques peuvent être formées à partir de la condensation d'esters carboxyliques avec du sodium métallique dans un solvant inerte et sous reflux. Ces hydroxycétones sont appelées acyloïnes et des réactions de condensation peuvent se produire de manière intramoléculaire et intermoléculaire.
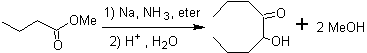

Les composés regroupés sous le nom d' acides oxocarboxyliques , qui comprennent les acides aldéhydo et les cétoacides, sont d'une grande importance dans la série aliphatique et à la fois en raison de leur relation biochimique avec les oxacides, et en raison des réactions de synthèse qui peuvent se produire à partir de ceux-ci ou Ses dérivés constituent un groupe important de composés organiques, sur lequel des travaux intenses ont été menés ces derniers temps.
2.- Composés 1,2-Diols
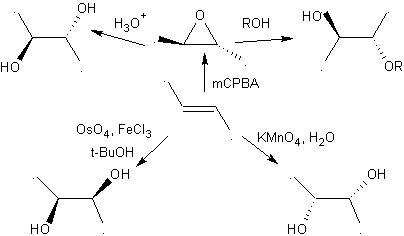
Les 1,2-diols possèdent dans les oléfines les meilleurs précurseurs pour leur préparation, il ne dépendra que de la stéréochimie du diol en question, de recourir à l'une des réactions spécifiques résumées dans le tableau ci-joint.
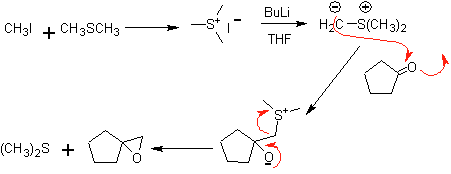
3.- électrophiles "illogiques"
Les molécules 1,2-dioxygénées peuvent également être construites à l'aide d'électrophiles illogiques; Les réactifs les plus importants de ce type sont les composés carbonyle alpha-halogénés obtenus par halogénation de la forme énol d'un composé carbonyle.
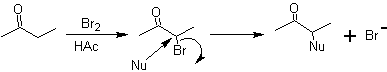
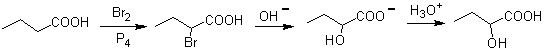
4.- Composés 1,2 difonctionnalisés par reconnexions
Une autre méthode qui produit des composés 1,2-difonctionnalisés consiste en la coupure oxydative des doubles liaisons par l'ozone pour générer deux carbonyles, qui varieront en fonction des conditions de réaction.
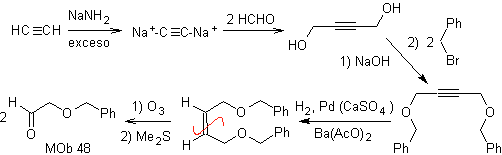
| Groupe 48 :
|
Analyse rétrosynthétique. la mafia 48 est un éther oléfinique dissymétrique et avec le groupe aldéhyde à une extrémité, c'est pourquoi on peut supposer qu'il est le résultat de l'ouverture d'une double liaison par ozonolyse suivie de la réaction avec Me 2 S. La double liaison du précurseur est fonctionnalisée en un alcyne interne éthéré symétrique.
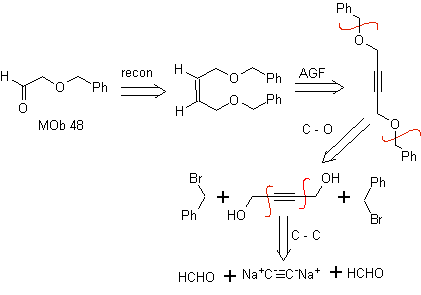
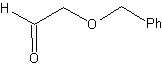
Les éthers sont le résultat de l'application de la synthèse de Williamson et du diol de la réaction diacétylure sur des aldéhydes, comme matière première.
synthèse . Le diacétylure se fait avec un excès de sodamide, qui agit sans formaldéhyde, pour donner l'alcool, qui est éthérifié par Williamson. L'alcyne est réduit en un alcène qui est ouvert par ozonolyse, suivie d'une réaction avec Me 2 S pour former l'aldéhyde.
synthèse . Le diacétylure se fait avec un excès de sodamide, qui agit sans formaldéhyde, pour donner l'alcool, qui est éthérifié par Williamson. L'alcyne est réduit en un alcène qui est ouvert par ozonolyse, suivie d'une réaction avec Me 2 S pour former l'aldéhyde.