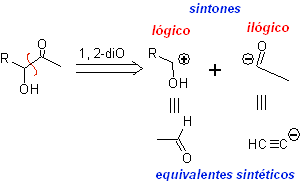
α-Гидроксикарбонильные соединения разъединены по связи CC, которая соединяет две функции. Эта операция приводит к естественному или логичному синтону (катионному синтону) и к неестественному или нелогичному синтону (анионному синтону). Синтетические эквиваленты могут представлять собой альдегиды и ацетилид-ион соответственно.
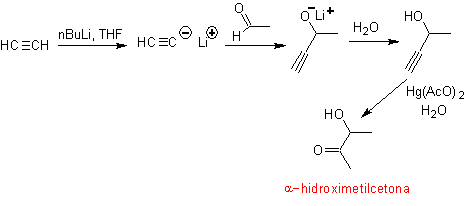
Концевая ацетиленовая группа с солями ртути в кислой среде образует метилкетон. Эта реакция также полезна, если ацетиленовая группа является внутренней и также симметричной.
Особым случаем α-гидроксикетонов являются бензоины или диарилгидроксикетоны , где две группы R являются ароматическими или гетероциклами. Бензоины являются результатом самоконденсации бензальдегида, катализируемой ионами цианида.
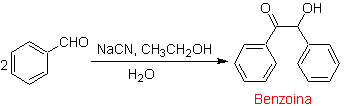
Бензоины могут быть несимметричными, например, один из альдегидов может быть пиридиновым альдегидом. Ион цианида не катализирует алифатические альдегиды, которые подвергаются такому же сочетанию в присутствии солей тиазолия.
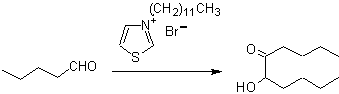
Алифатические α-гидроксикетоны могут быть образованы конденсацией эфиров карбоновых кислот с металлическим натрием в инертном растворителе и при кипячении. Эти гидроксикетоны называются ацилоинами , и реакции конденсации могут протекать внутримолекулярно и межмолекулярно.
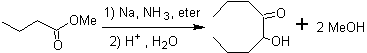

Соединения, сгруппированные под названием оксокарбоновые кислоты , к которым относятся альдегидокислоты и кетокислоты, имеют большое значение в алифатическом ряду и как из-за их биохимического родства с оксокислотами, так и из-за реакций синтеза, которые могут протекать из них или из них Его производные составляют важную группу органических соединений, над которыми в последнее время ведется интенсивная работа.
2.- Соединения 1,2-диолы 1,2-диолы имеют в составе олефинов лучшие предшественники для их получения, только от стереохимии рассматриваемого диола будет зависеть прибегнуть к одной из конкретных реакций, кратко изложенных в прилагаемой таблице.
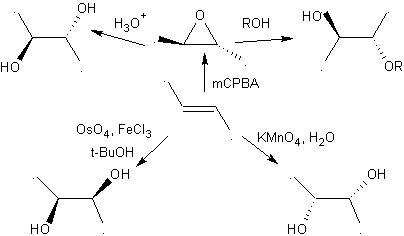
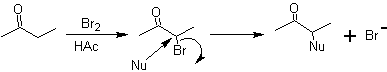
1,2-диоксигенированные молекулы также могут быть построены с использованием нелогичных электрофилов; Наиболее важными реагентами этого типа являются альфа-галогенированные карбонильные соединения, полученные галогенированием енольной формы карбонильного соединения.
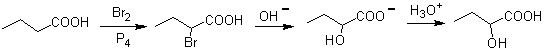
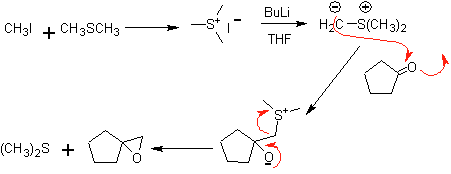
Другой метод получения 1,2-дифункционализированных соединений состоит в окислительном расщеплении двойных связей озоном с образованием двух карбонилов, которые будут варьироваться в зависимости от условий реакции.
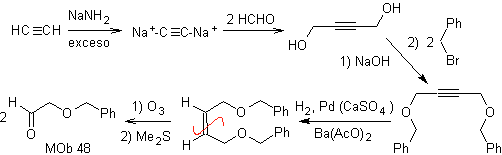
| Моб 48:
|
Ретросинтетический анализ. толпа 48 представляет собой несимметричный олефиновый эфир и с группой альдегида на одном конце, поэтому можно предположить, что он является результатом раскрытия двойной связи путем озонолиза с последующей реакцией с Me 2 S. Двойная связь предшественника функционализирована до симметричного эфирного внутреннего алкина.
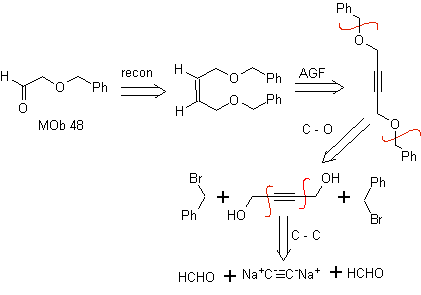
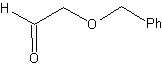
Эфиры являются результатом применения синтеза Вильямсона и диола реакции диацетилида на альдегидах в качестве исходного материала.
синтез . Диацетилид производится с избытком содамида, который действует без формальдегида, с получением спирта, который этерифицируется Уильямсоном. Алкин восстанавливается до алкена, который открывается озонолизом с последующей реакцией с Me 2 S с образованием альдегида.
синтез . Диацетилид производится с избытком содамида, который действует без формальдегида, с получением спирта, который этерифицируется Уильямсоном. Алкин восстанавливается до алкена, который открывается озонолизом с последующей реакцией с Me 2 S с образованием альдегида.