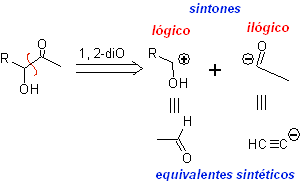
α-Hydroxycarbonylverbindungen werden an der CC-Bindung getrennt, die die beiden Funktionen verbindet. Diese Operation führt zu einem natürlichen oder logischen Synthon (dem kationischen Synthon) und zu einem unnatürlichen oder unlogischen Synthon (dem anionischen Synthon). Die synthetischen Äquivalente können Aldehyde bzw. Acetylidionen sein.
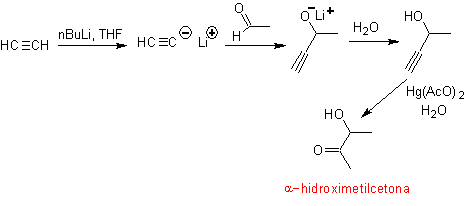
Die endständige Acetylengruppe bildet mit Quecksilbersalzen im sauren Medium ein Methylketon. Diese Reaktion ist auch nützlich, wenn die Acetylengruppe intern und auch symmetrisch ist.
Ein Sonderfall von α-Hydroxyketonen sind Benzoine oder Diarylhydroxyketone , bei denen die beiden R-Gruppen aromatisch oder heterocyclisch sind. Benzoine sind das Ergebnis der durch Cyanidionen katalysierten Selbstkondensation von Benzaldehyd.
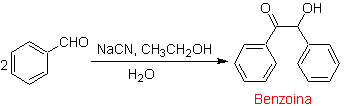
Die Benzoine müssen nicht symmetrisch sein, beispielsweise kann einer der Aldehyde ein Pyridinaldehyd sein. Das Cyanidion katalysiert keine aliphatischen Aldehyde, die die gleiche Kupplung in Gegenwart von Thiazoliumsalzen eingehen.
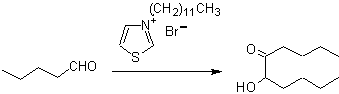
Aliphatische α-Hydroxyketone können durch Kondensation von Carbonsäureestern mit metallischem Natrium in einem inerten Lösungsmittel und unter Rückfluss gebildet werden. Diese Hydroxyketone werden Acyloine genannt, und Kondensationsreaktionen können intramolekular und intermolekular auftreten.
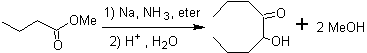

Die unter dem Namen Oxocarbonsäuren zusammengefaßten Verbindungen, zu denen Aldehydosäuren und Ketosäuren gehören, sind in der aliphatischen Reihe sowohl wegen ihrer biochemischen Verwandtschaft mit den Oxsäuren als auch wegen der aus ihnen bzw ihre Derivate stellen eine wichtige Gruppe organischer Verbindungen dar, an denen in letzter Zeit intensiv gearbeitet wird.
2.- Verbindungen 1,2-Diole Die 1,2-Diole haben in den Olefinen die besten Vorläufer für ihre Herstellung, es hängt nur von der Stereochemie des fraglichen Diols ab, auf eine der in der beigefügten Tabelle zusammengefassten spezifischen Reaktionen zurückzugreifen.
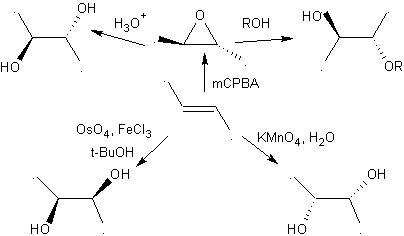
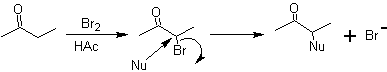
1,2-dioxygenierte Moleküle können auch unter Verwendung unlogischer Elektrophile aufgebaut werden; Die wichtigsten Reagenzien dieses Typs sind die alpha-halogenierten Carbonylverbindungen, die durch Halogenierung der Enolform einer Carbonylverbindung erhalten werden.
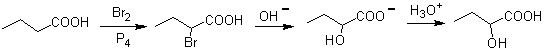
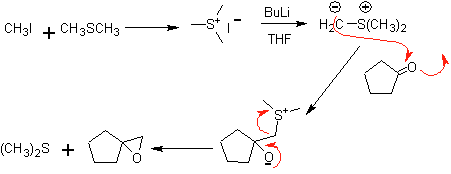
Ein weiteres Verfahren, das 1,2-difunktionalisierte Verbindungen herstellt, besteht aus der oxidativen Spaltung von Doppelbindungen durch Ozon, um zwei Carbonyle zu erzeugen, die je nach Reaktionsbedingungen variieren.
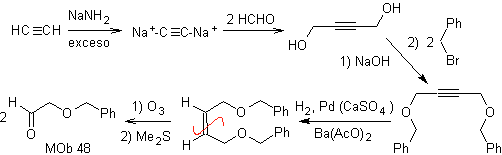
| Mob 48:
|
Retrosynthetische Analyse. der Mob 48 ist ein unsymmetrischer olefinischer Ether und mit der Gruppe Aldehyd an einem Ende, weshalb davon ausgegangen werden kann, dass es sich um das Ergebnis einer Doppelbindungsöffnung durch Ozonolyse mit anschließender Reaktion mit handelt Me 2 S. Die Doppelbindung der Vorstufe ist zu einem symmetrischen, etherischen, internen Alkin funktionalisiert.
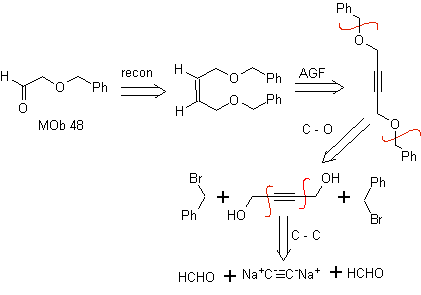
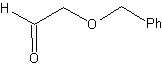
Die Ether sind das Ergebnis der Anwendung der Williamson-Synthese und des Diols der Diacetylidreaktion auf Aldehyde als Ausgangsmaterial.
Synthese . Das Diacetylid wird mit einem Überschuss an Natriumamid, das ohne Formaldehyd wirkt, zum Alkohol hergestellt, der von Williamson verethert wird. Das Alkin wird zu einem Alken reduziert, das durch Ozonolyse geöffnet wird, gefolgt von einer Reaktion mit Me 2 S, um den Aldehyd zu bilden.
Synthese . Das Diacetylid wird mit einem Überschuss an Natriumamid, das ohne Formaldehyd wirkt, zum Alkohol hergestellt, der von Williamson verethert wird. Das Alkin wird zu einem Alken reduziert, das durch Ozonolyse geöffnet wird, gefolgt von einer Reaktion mit Me 2 S, um den Aldehyd zu bilden.