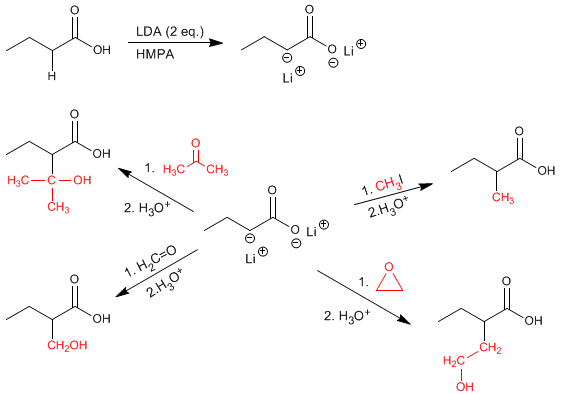
Les a -hydrogènes des acides carboxyliques sont acides et peuvent être éliminés à l'aide de bases fortes telles que le LDA.
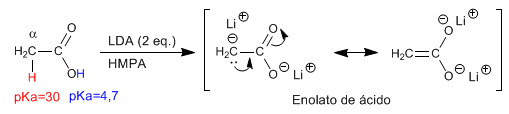
Le premier équivalent de LDA élimine l'hydrogène du groupe hydroxyle (pKa = 4,7), formant le carboxylate. Le deuxième équivalent de LDA déprotone le carbone a , formant l'énolate acide.
Un solvant hautement polaire (HMPA) est utilisé pour stabiliser l'énolate.
Les énolates acides sont de bons nucléophiles et attaquent par le carbone une importante variété d'électrophiles (haloalcanes primaires, époxydes, aldéhydes, cétones...)
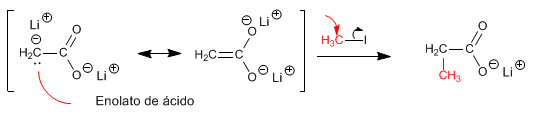
Autres exemples sur la réactivité des énolates acides