espectroscopia de infravermelho
A espectrometria infravermelha é extremamente útil para determinações qualitativas de compostos orgânicos e para deduzir estruturas moleculares de seus grupos funcionais de compostos orgânicos e inorgânicos.
Na análise qualitativa, a espectroscopia de infravermelho pode ser usada para a identificação de substâncias puras ou para a absorção, localização e identificação de impurezas.
Para localizar uma impureza em uma substância, é feita uma comparação entre o espectro da substância em estudo e uma amostra da substância pura. As impurezas fazem com que bandas de absorção adicionais apareçam no espectro.
No IR também estão encontrando uso crescente em análises quantitativas, o principal campo de aplicação desse tipo de análise é na quantificação de poluentes atmosféricos provenientes de processos industriais.
Uma parte do espectro eletromagnético que se estende de 0,8 a 1000μm (que corresponde ao número de onda entre 12800 e 10 cm-1), é considerada a região do infravermelho que é dividida em três regiões denominadas:
a).- IR próximo. b).- IR fundamental ou médio c).- IR distante
Cada tipo de ligação absorve a radiação infravermelha em uma frequência diferente, o que permite determinar que tipo de grupos funcionais a molécula em estudo possui. Espectrofotômetros infravermelhos trabalham no infravermelho médio e escaneiam de 4000 c m − 1 a 400 c m − 1
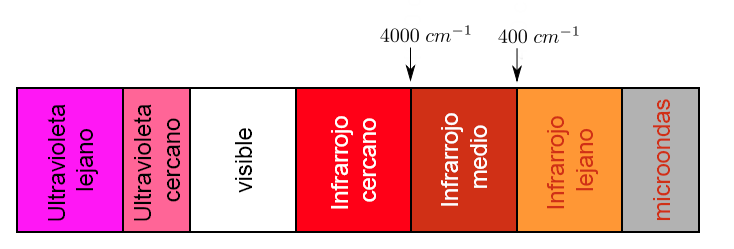
No entanto, a região de importância analítica é a região IR fundamental, pois a maioria dos instrumentos infravermelhos cobre essa região.
A maioria dos materiais orgânicos e inorgânicos demonstra absorção e o espectro é causado principalmente pelo alongamento e flexão vibracional dentro da molécula. O espectro infravermelho é uma das propriedades mais características de um composto, pois não existem dois espectros idênticos para dois compostos diferentes, é como uma impressão digital.
Dentro da região IR Fundamental existem duas regiões, uma delas é a chamada
os grupos funcionais de 4000 cm-1 a 1300 cm-1, e a região dos dedos de 1300 cm-1 a 670 cm-1.
Na região dos grupos funcionais, a posição do pico de absorção é maior ou menor dependendo apenas do grupo funcional onde chega a absorção e não da estrutura molecular completa. A posição dos picos na região do dedo depende da estrutura molecular completa.
Características que uma vibração deve ter para produzir uma banda de absorção:
A radiação incidente deve ter uma frequência igual à frequência da vibração que vai produzir.
Que a vibração resultante produza uma mudança no momento de dipolo, ou seja, a vibração não absorverá a radiação infravermelha, se não houver mudança no momento de dipolo é chamada de vibração inativa e eles estarão ativos quando houver essa mudança no dipolo momento.
Tradicionalmente, o eixo x do espectro infravermelho usa o número de ondas ( ν ¯ , leia-se "nu bar"') e é definido como o inverso do comprimento de onda em cm. ν ¯ = 1 λ . O eixo y representa a porcentagem de radiação transmitida (transmitância) que é representada por % T . A forma do espectro infravermelho do hexano é mostrada abaixo.
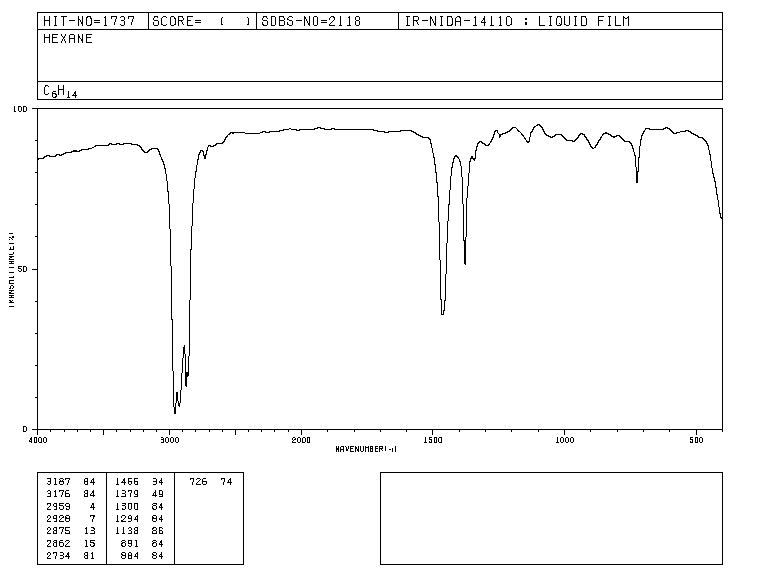
As bandas representam áreas onde as ligações da molécula absorvem a radiação infravermelha. Nas bandas a transmitância é pequena e a absorbância é grande.
tipos de vibração
Vibração de tensão (alongamento). Os átomos mantidos juntos por ligações simples, duplas ou triplas movem-se na direção da ligação, assim como duas massas ligadas a uma mola oscilam.
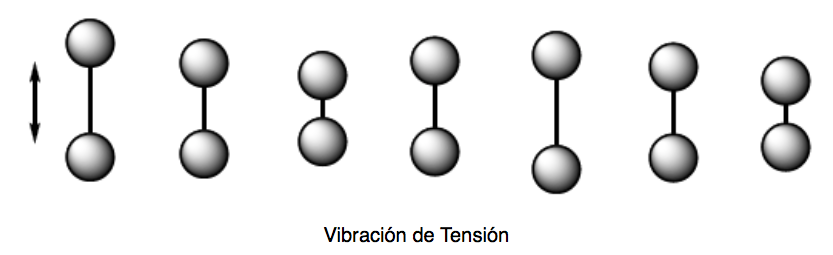
Existem dois modos de vibração de tensão: simétrica e assimétrica.
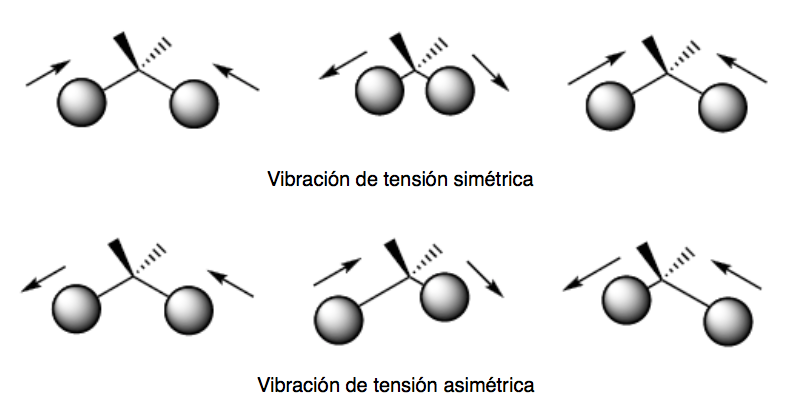
vibração de flexão. Os átomos vibram de modo que os ângulos variam, mas os comprimentos das ligações não. Existem quatro modos de vibração de flexão: tesoura, balanço, balanço e torção.
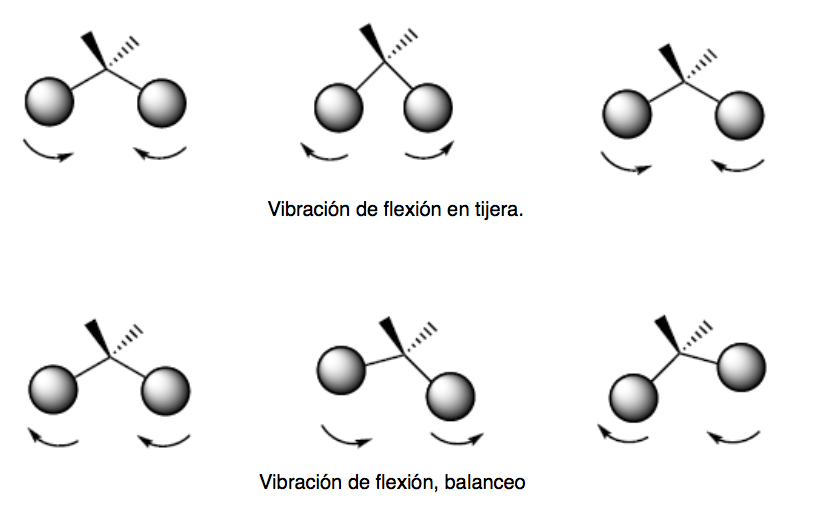
Esses dois modos de vibração ocorrem no plano que contém os três átomos que participam da vibração.
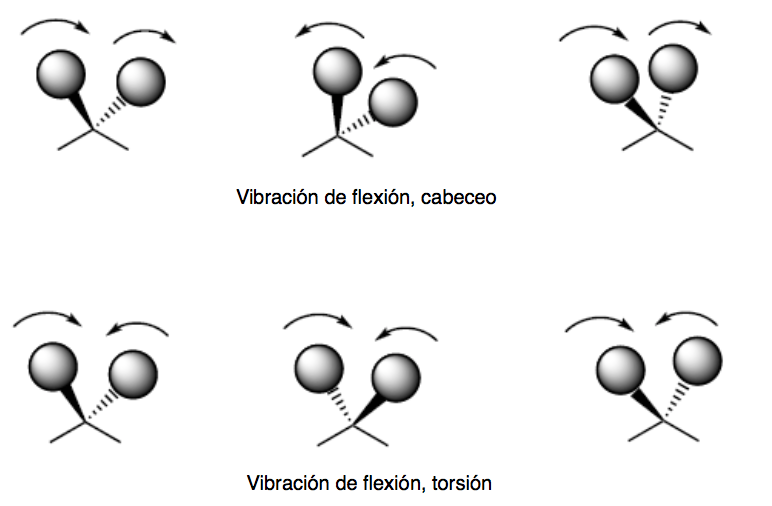
Os modos de vibração de passo e torção ocorrem fora do plano (Out of plane) e geralmente são representados por Oop.
oscilador harmônico quântico
As vibrações moleculares podem ser estudadas com o modelo do oscilador harmônico quântico. A energia é dada por:
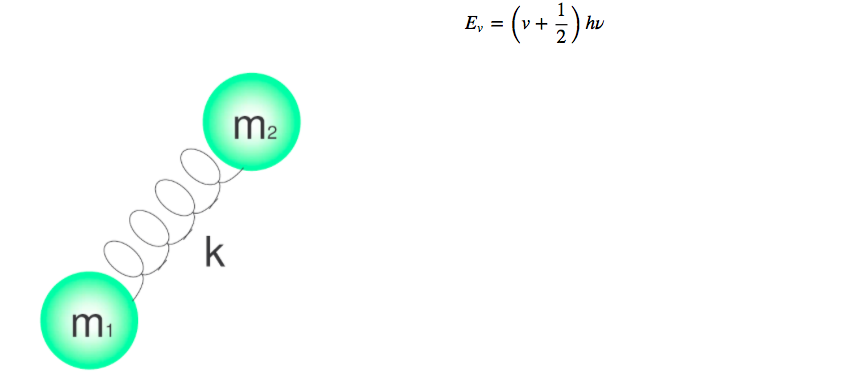
Os diferentes níveis de energia são dados pelo número quântico v, que assume valores 0.1.2.3.4.....
h é a constante de Planck e ν é a frequência do oscilador que é dada pela expressão:
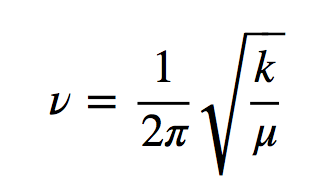
onde k é a constante de força da mola e μ a massa reduzida do sistema
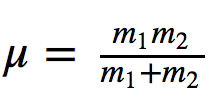
Dividindo a frequência pela velocidade da luz dá o número de ondas ν ¯
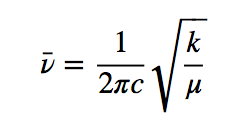
A equação acima indica que pequenas massas reduzidas (átomos de baixa massa) e altas constantes de força (ligações fortes) levam a altas frequências. Nessas condições, as bandas de absorção surgem em números de onda altos.
Como pode ser visto no gráfico, altas frequências dão origem a um maior espaçamento entre os níveis de energia.
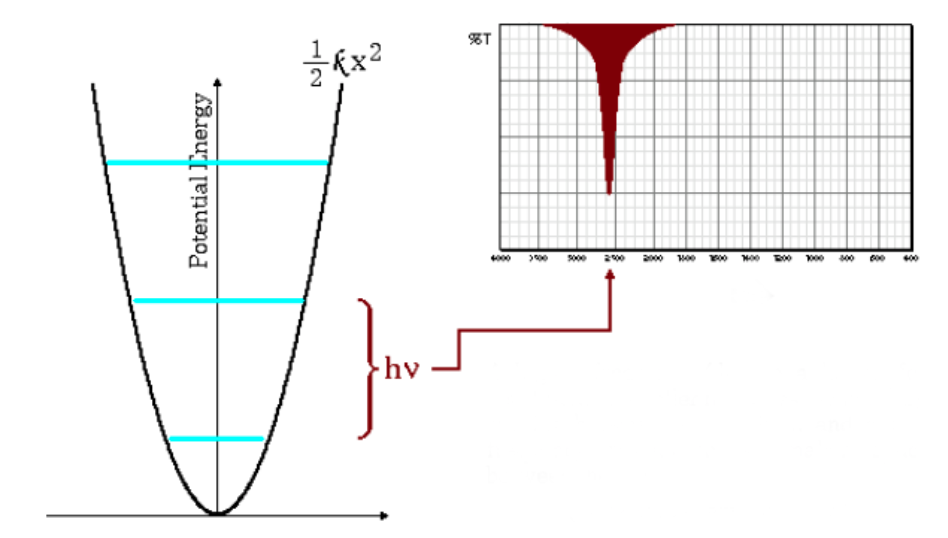
Frequências de baixa absorção
A equação acima também indica que grandes massas reduzidas e pequenas constantes de força (ligações fracas) levam a baixas frequências. Nessas condições, as bandas de absorção aparecem em números de onda baixos.
Como pode ser visto no gráfico, as baixas frequências dão origem a um menor espaçamento entre os níveis de energia.
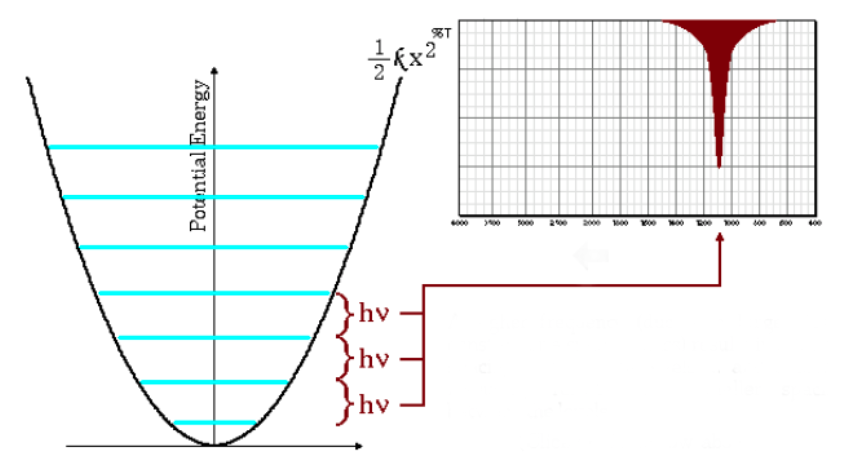
Principais vibrações moleculares
espectro IR
Em um espectro infravermelho, a frequência (em número de onda) é plotada em relação à porcentagem de luz transmitida (transmitância). A porcentagem de transmitância é definida como o quociente entre a intensidade da luz transmitida através da amostra, I M , e a intensidade da luz do feixe de referência I R multiplicado por 100.
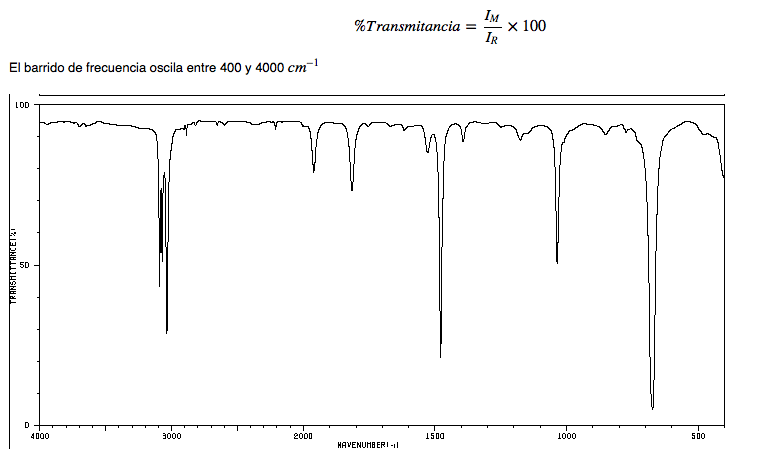
Espectro IR de alcanos
• Deformação CH: os alcanos exibem vibrações de deformação CH ligeiramente abaixo de 3000 c m − 1
• Flexão de CH: os CH 2 da cadeia apresentam vibrações de flexão (tesoura) em 1465 cm − 1 , enquanto os metils produzem uma banda em 1375 c m − 1 devido à vibração de flexão simétrica e outra em 1450 cm − 1 devido a vibração de flexão assimétrica. Todas as bandas de flexão são de média intensidade.
Observe que a banda de flexão assimétrica do metil se sobrepõe à banda de flexão em tesoura do CH 2 .
Espectro IR de hexano
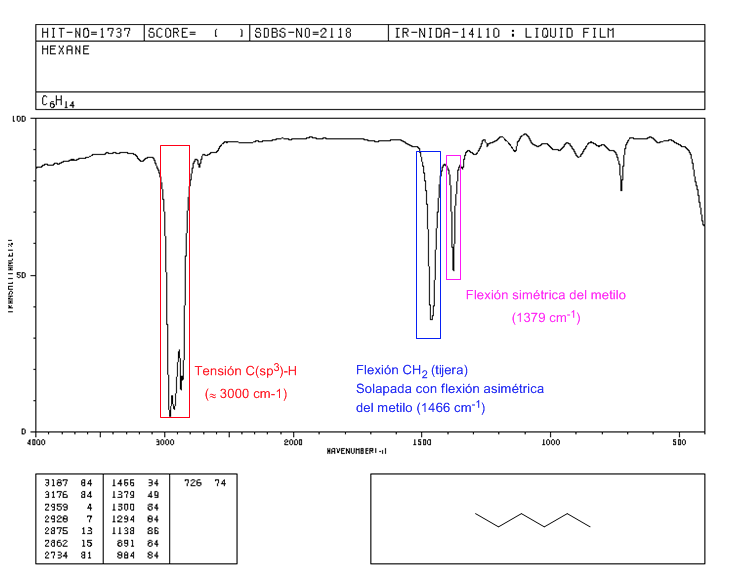
Espectro de 2,2-dimetilbutano
A presença do grupo terc-butila produz a divisão da banda de flexão simétrica em duas bandas em 1390 e 1370 c m − 1 . A banda em 1390 é metade da banda em 1370.
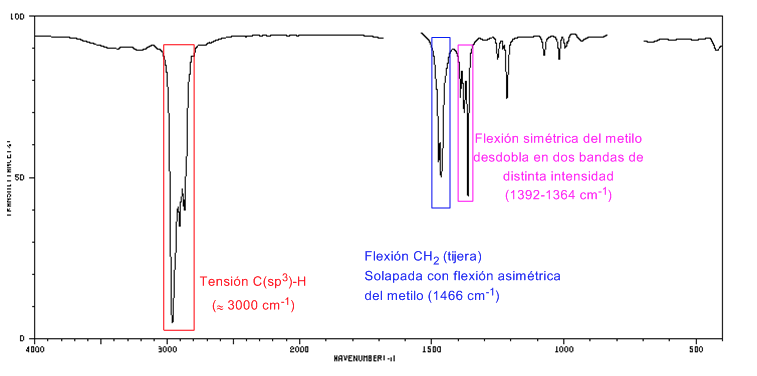
Espectro IR de cicloalcanos
Os cicloalcanos têm um espectro de IV muito semelhante aos alcanos com uma banda de estiramento CH ligeiramente abaixo de 3000 c m − 1 e uma banda de flexão CH em tesoura para CH 2 em 1465 c m − 1 . A principal diferença com os alcanos é a ausência da banda simétrica de metil. 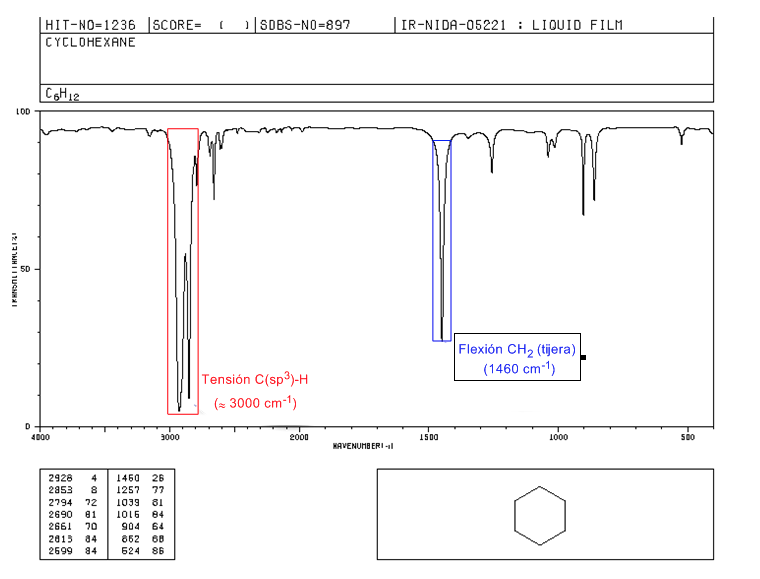
Observe a ausência da banda de flexão metil simétrica que os alcanos apresentam em 1375 c m − 1 .
Espectro IR de alcenos
• Tensão C(sp2)-H: 3100 -3000 cm-1
• Tensão C=C: 1600 cm-1
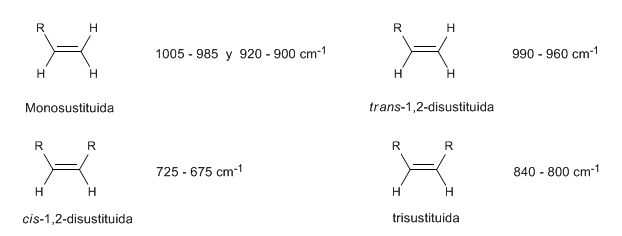
• Flexão fora do plano (oop) da ligação C=CH: 1000 - 650 cm-1. Este tipo de banda permite conhecer o grau de substituição do alceno.
Espectro de 1-penteno
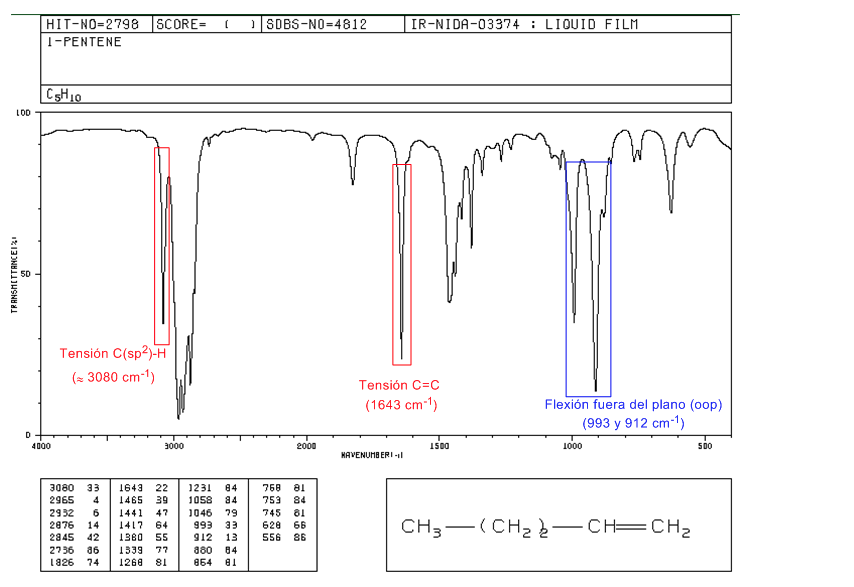
Em alcenos monossubstituídos, como o 1-penteno, as dobras CH fora do plano produzem duas bandas localizadas em 1005-985 e 920-900 c m − 1 .
Estereoquímica e espectroscopia de infravermelho de alcenos
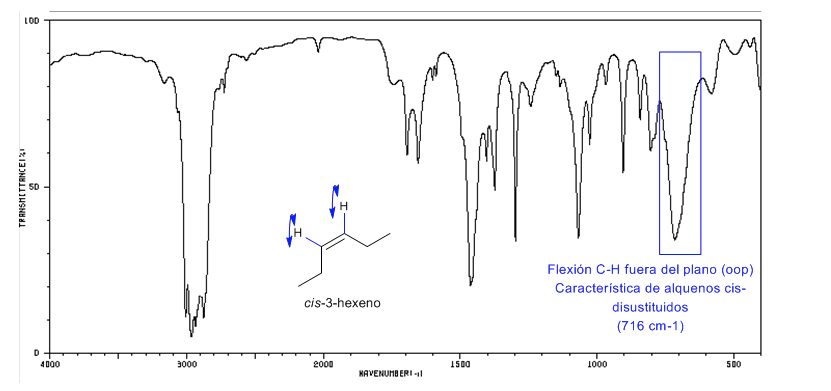
Os alcenos cis-dissubstituídos apresentam uma banda de flexão CH fora do plano que permite distingui-los. Esta banda aparece entre 725-675 c m − 1
Espectro de Cis-3-hexeno
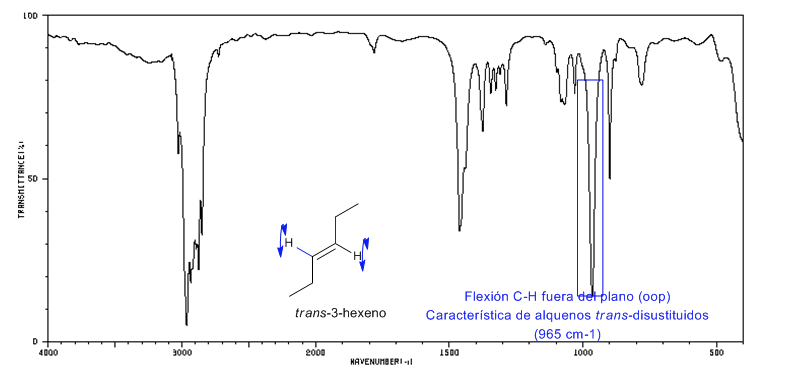
Espectro de Trans-3-hexeno
Os alcenos trans-dissubstituídos apresentam uma forte banda de absorção entre 980-965 c m − 1 que permite sua identificação. Observe a ausência total da banda de tensão C=C em 1600 c m − 1 devido à falta de polaridade.
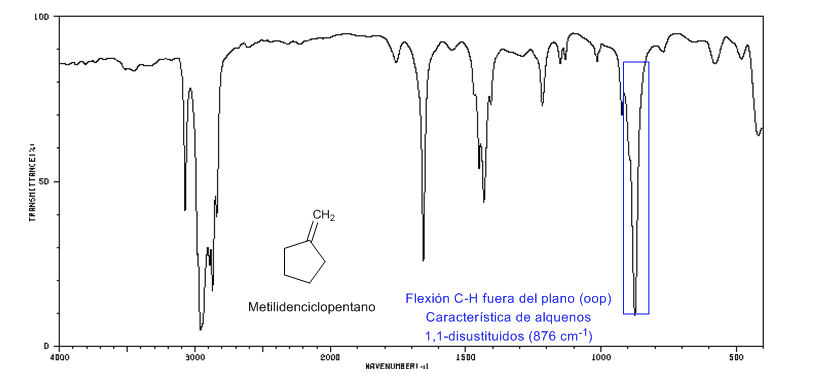
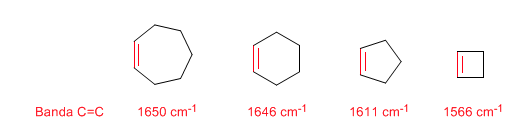
Cepa do Anel: Ligações Endocíclicas C=C
À medida que o tamanho do anel diminui, a banda de tensão das ligações C=C se move em direção a um número menor de ondas. A exceção do ciclopropeno é atribuída ao acoplamento entre as vibrações de tensão das ligações C=C e CC. Este acoplamento não ocorre no ciclobuteno porque as ligações C=C e CC são perpendiculares entre si.
 espectro IV do ciclopenteno
espectro IV do ciclopenteno 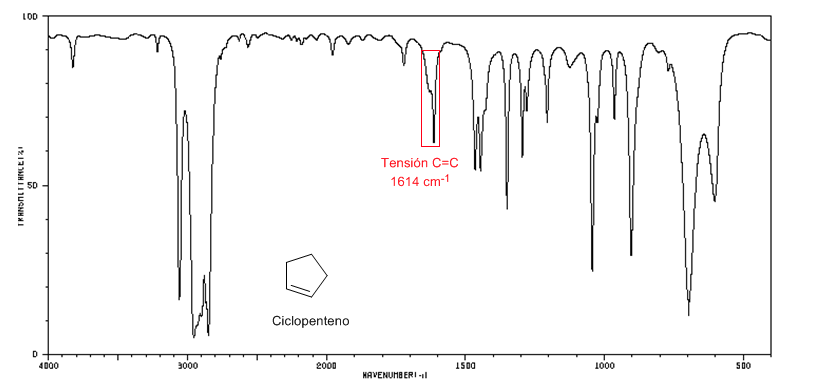
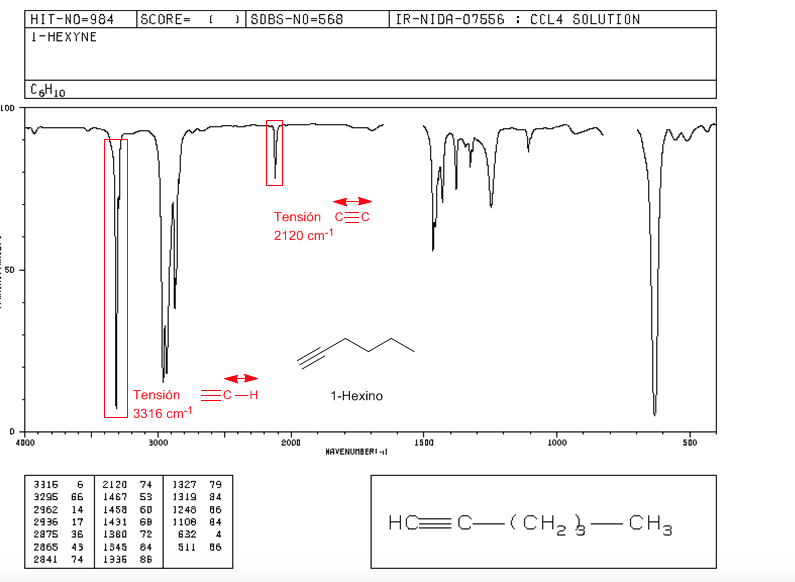
Tensão ≡ C − H : 3300 c m − 1
Tensão − C ≡ C − : 2150 c m − 1 . Alcinos simétricos não apresentam esta banda, sendo muito fracos nas internas. A conjugação reduz ligeiramente o valor.
espectro de 1-hexina
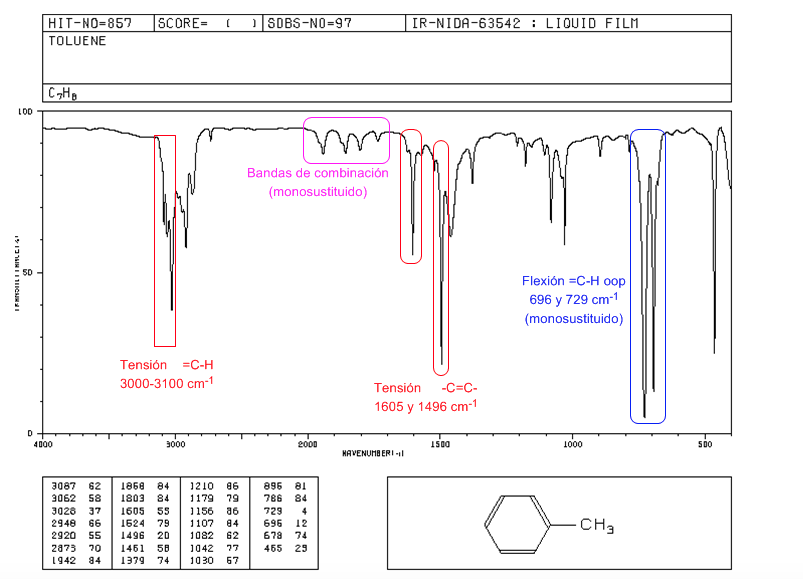
Espectro IR de aromáticos
Tensão =CH: 3100 cm-1
Tensão -C=C-: 1600 e 1475 cm-1
Flexão = CH fora do plano: 900-690 cm-1
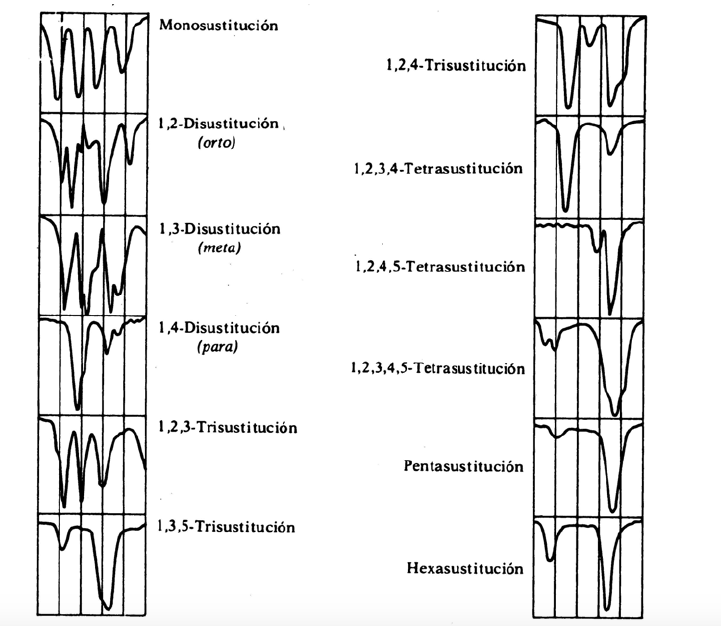
As vibrações oop juntamente com os harmônicos e bandas de combinação que aparecem entre 2000 e 1667 cm-1 permitem conhecer o grau de substituição do benzeno.
bandas de substituição
![]()
Espectros de álcoois e fenóis
Tensão OH: Banda larga de 3500 a 3200 cm-1. Na ausência de ligação de hidrogênio, aparece como um pico agudo em 3650-3600 cm-1.
Tensão de CO: Banda entre 1250-1000 cm-1. Permite distinguir entre álcoois primários (1050 cm-1), secundários (1100 cm-1), terciários (1150 cm-1) e fenóis (1220 cm-1).
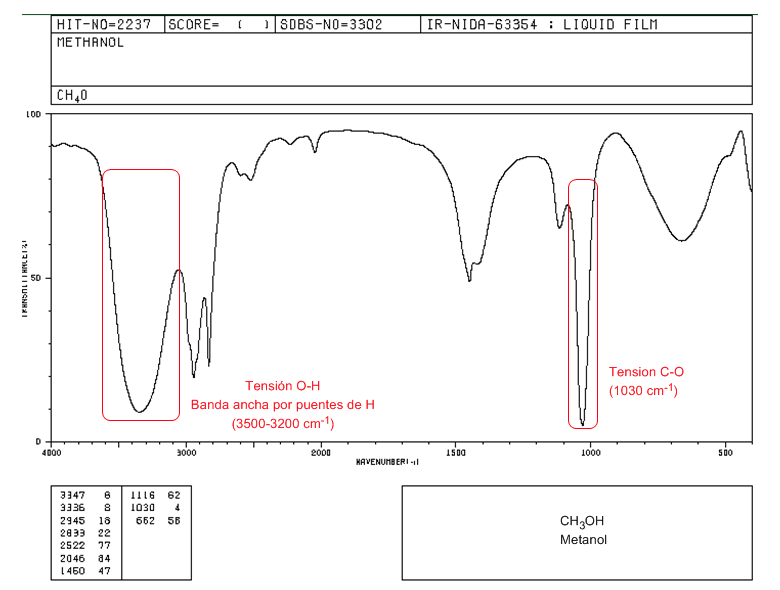
Espectro IV de um álcool primário (metanol)
No espectro do metanol podemos observar a banda de tensão OH muito larga, devido à formação de pontes de hidrogênio. A banda de tensão do CO sai com um número de onda baixo (1030) porque é um álcool sem substituintes.
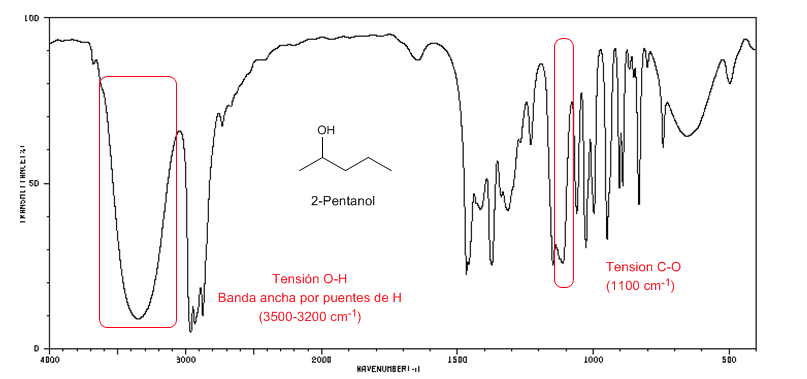
Espectro IV de álcoois secundários (2-pentanol)
Observe o deslocamento da banda do CO em direção a um maior número de ondas em relação ao metanol.
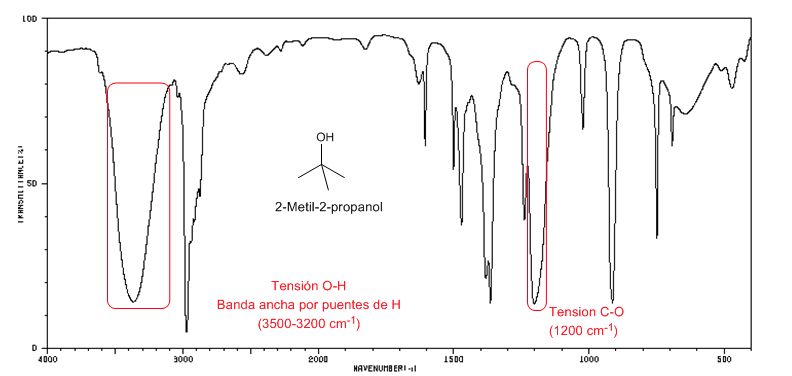
 Espectro IV de álcoois terciários (2-metil-2-propanol)
Espectro IV de álcoois terciários (2-metil-2-propanol)Os álcoois terciários têm a banda de CO deslocada para frequências mais altas do que os álcoois primários e secundários.
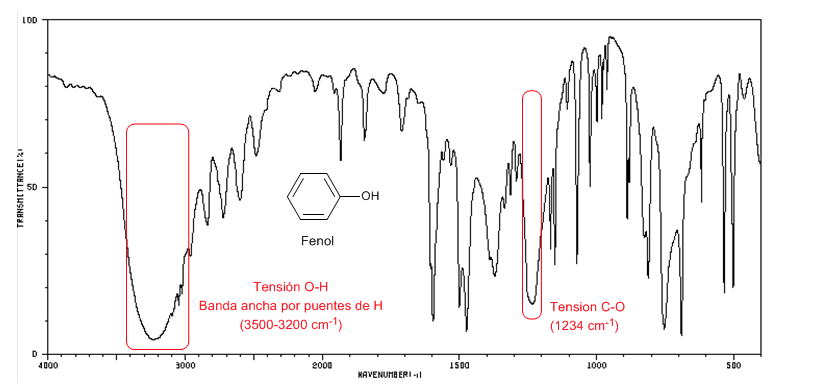
O fenol apresenta uma banda de absorção de CO acima de 1200 cm-1
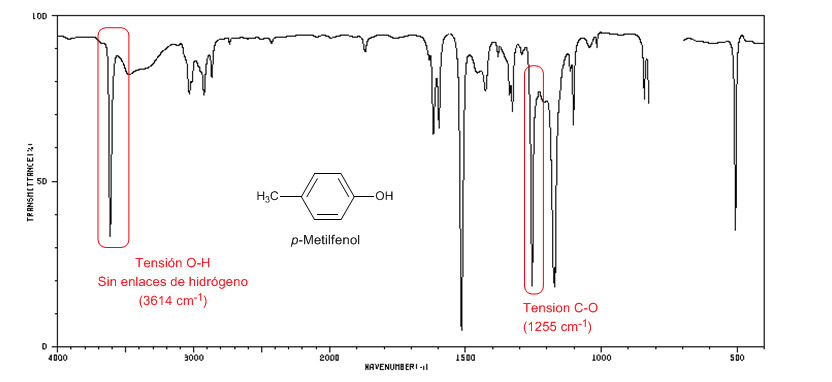
O espectro a seguir mostra a banda de estiramento OH na ausência de ligação de hidrogênio.
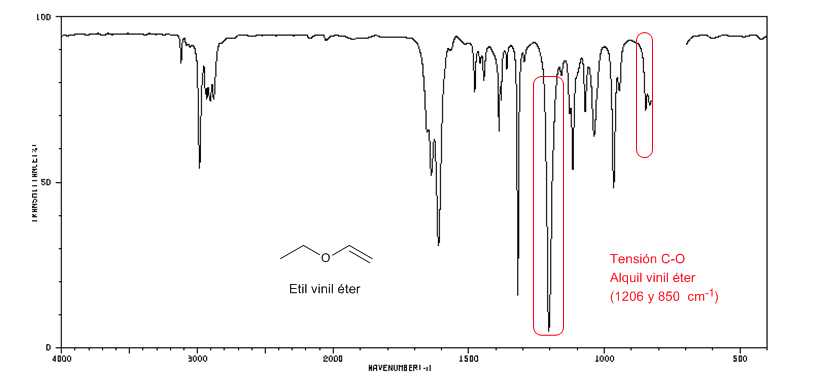
Os éteres alquil vinílicos (CH2=CH-OR) apresentam duas bandas em 1220 e 850 cm-1. Este último muito fraco.
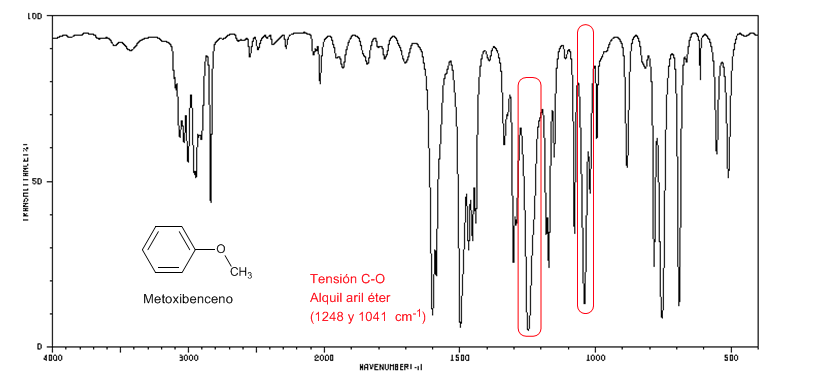
Os éteres aril alquílicos (Ar-OR) apresentam duas bandas em 1250 e 1040 cm-1
Espectro IV de 1-metoxihexano

O éter etilvinílico apresenta duas bandas em 1220 e 850 cm-1, sendo esta última muito fraca.
Metoxibenzeno apresenta duas bandas em 1250 e 1040 cm-1
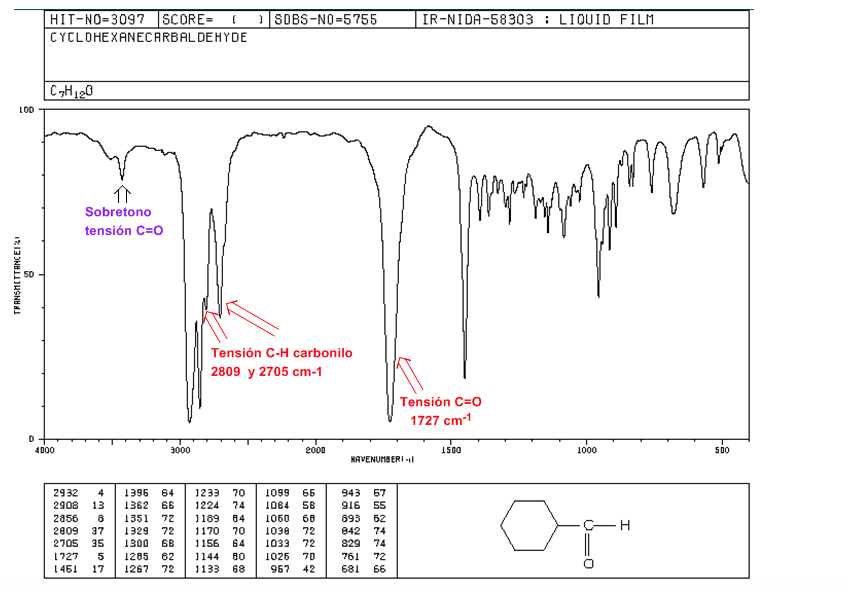
aldeídos
Tensão C=O: 1725 cm-1
Cepa carbonila CH: duas bandas fracas em 2850 e 2750 cm-1. A banda em 2850 tende a se sobrepor com a da tensão C(sp3)-H
C=O Sobretom de tensão acima de 3500 cm-1.
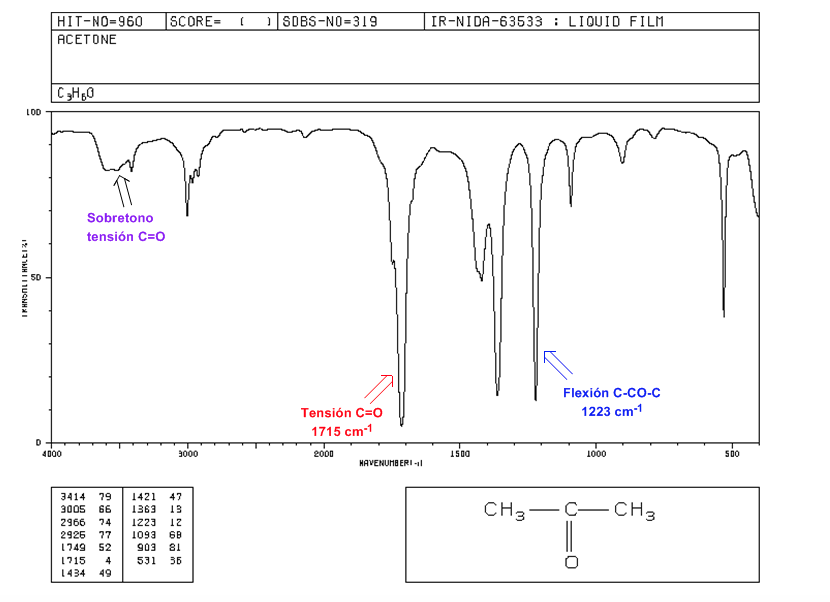
Tensão C=O: Banda intensa em 1715 cm-1.
Flexão C-CO-C: 1300 - 1100 cm-1.
Sobretom de tensão C=O: de 3500 a 3350 cm-1.
Efeito da conjugação na banda de tensão C=O
Espectro IV de ácidos carboxílicos e derivados
ácidos carboxílicos
Tensão OH: De 3400 a 2400 cm-1. Muito larga devido à formação de pontes de hidrogênio.
Tensão C=O: 1730-1700 cm-1
Tensão de CO: 1320-1200 cm-1
Flexão COH (oop): Banda em forma de sino a 900 cm-1
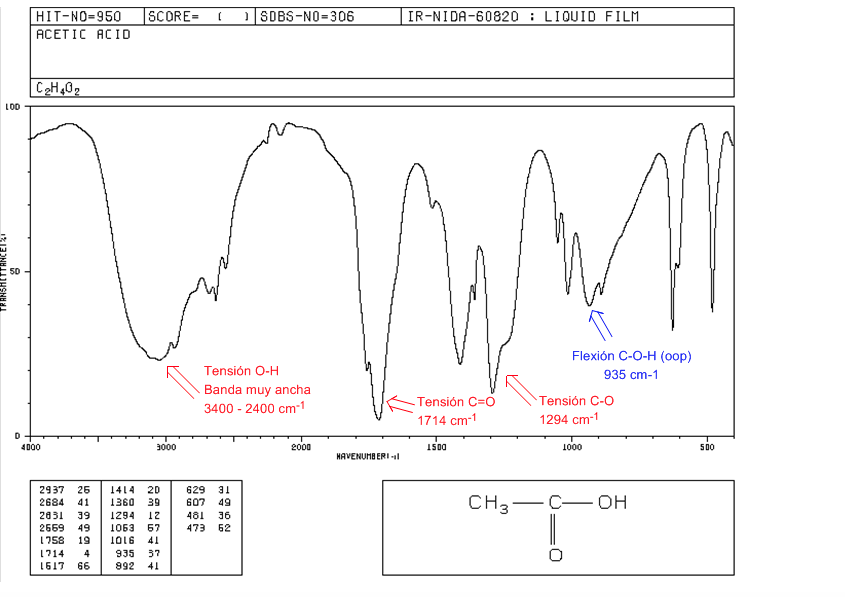
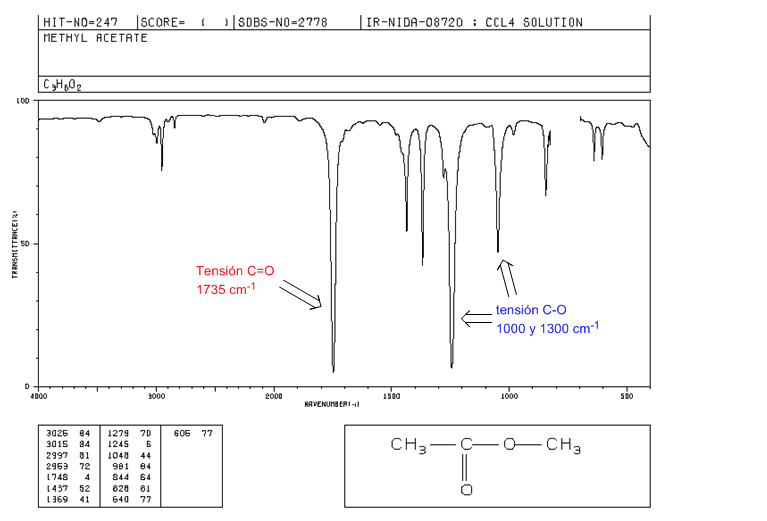
ésteres
Tensão C=O em 1735 cm-1. Se houver ligações duplas conjugadas com a carbonila, a banda muda para valores mais baixos. Quando a ligação dupla está no grupo alcoxi (-OR) do éster, observa-se um deslocamento para valores mais altos.
Tensão de CO: 2 bandas em 1300 e 1000 cm-1. Sendo mais amplo e intenso o observado em 1300.
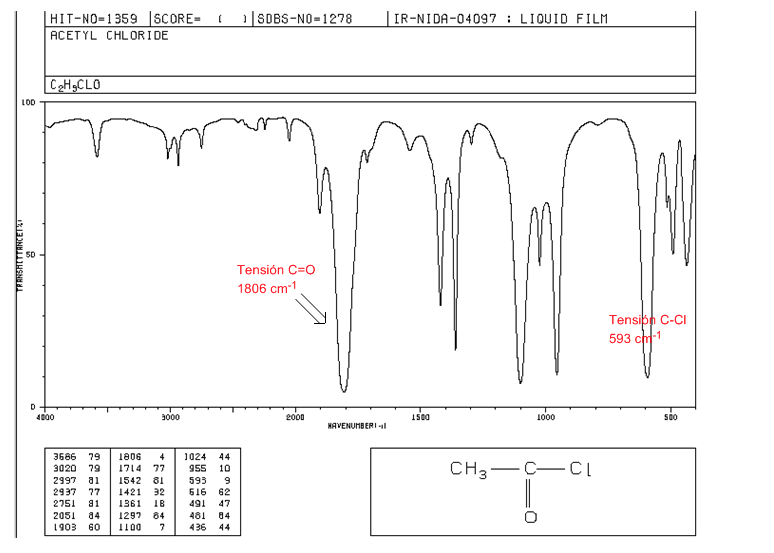
haletos ácidos
Tensão C=O: 1810 - 1775 cm-1
Tensão C-Cl: banda intensa 730 - 550 cm-1
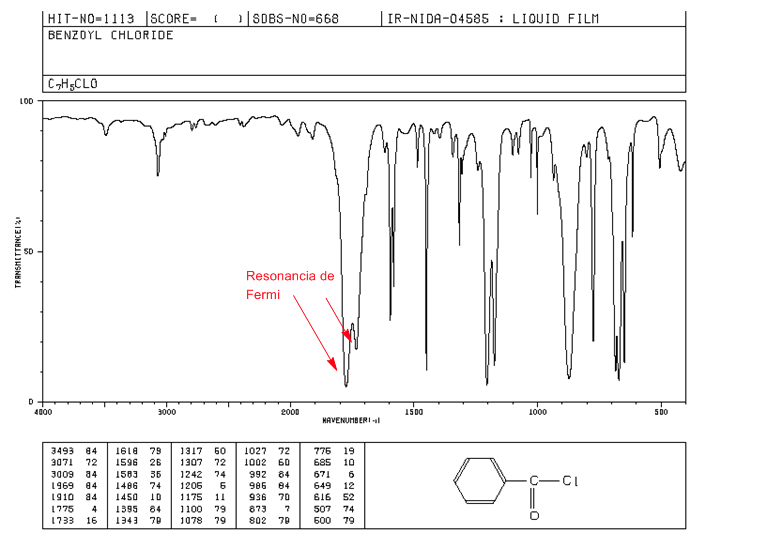
Ressonância de Fermi
Harmônicos são transições vibracionais do estado fundamental para estados excitados superiores. As frequências de absorção estão sendo a frequência da absorção fundamental. A ressonância de Fermi resulta do acoplamento de uma banda de absorção fundamental com um harmônico ou uma banda de combinação.
Haletos de alcanoíla aromáticos exibem duas bandas de tensão C=O por ressonância de Fermi.
 Nitrilos
Nitrilos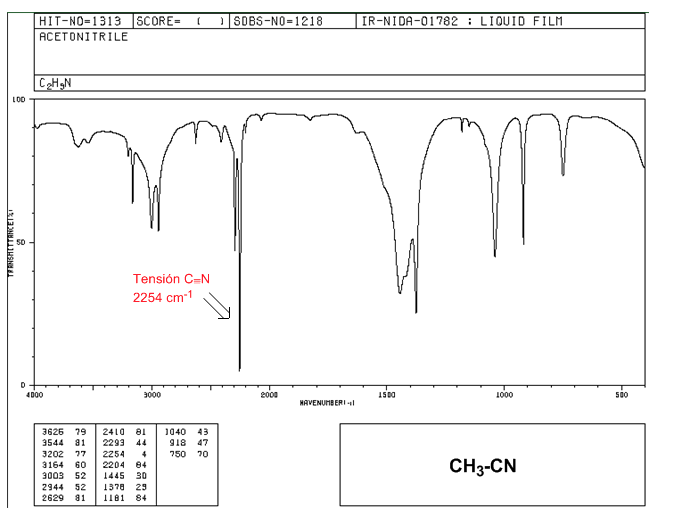
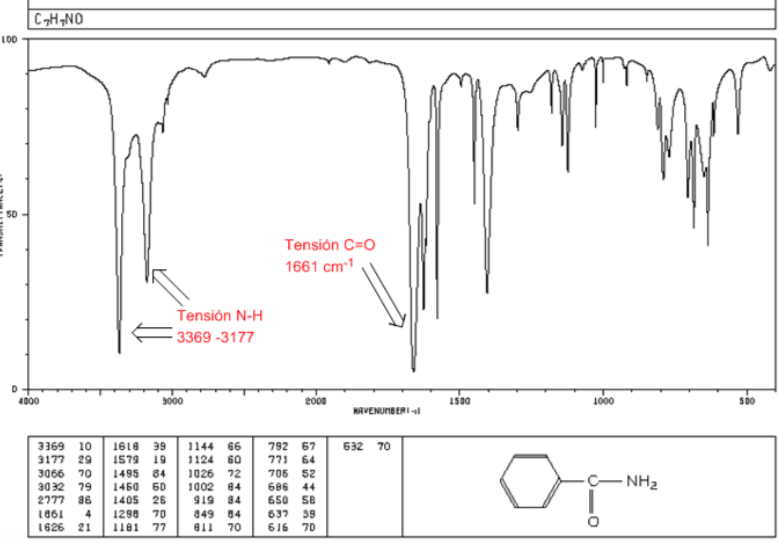
amidas
Tensão C=O: 1680 - 1630 cm-1
Tensão NH: Entre 3350 e 3180 cm-1. As amidas primárias têm duas bandas, enquanto as amidas secundárias têm apenas uma banda.
Flexão NH: 1640 - 1550 cm-1
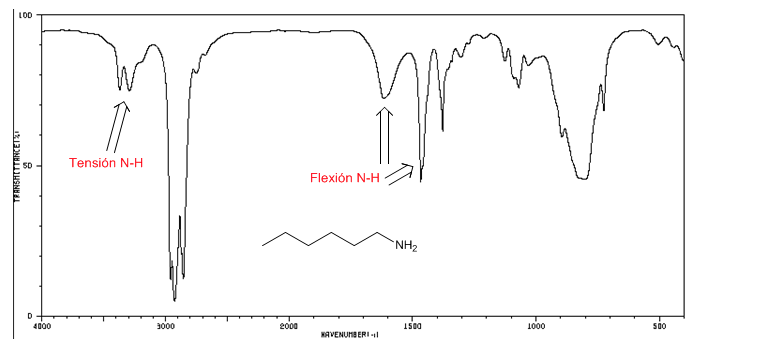
Espectro IR de aminas
Tensão NH: entre 3500 e 3300 cm-1. As aminas primárias apresentam duas bandas (simétricas e assimétricas), as secundárias apenas uma banda.
Flexão de NH: Aminas primárias duas bandas em 1640 e 1560 cm-1. Secundários uma banda em 1500 cm-1
Espectro IR de 1-hexano-amina
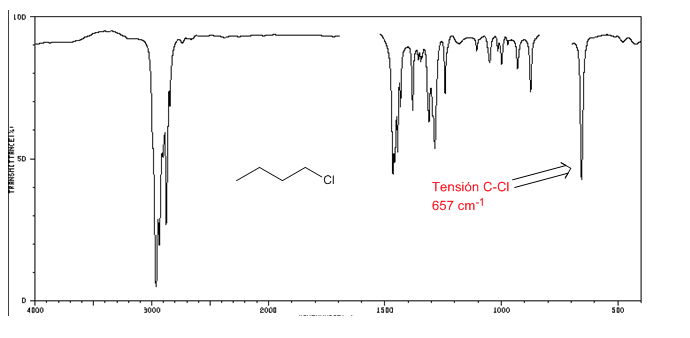
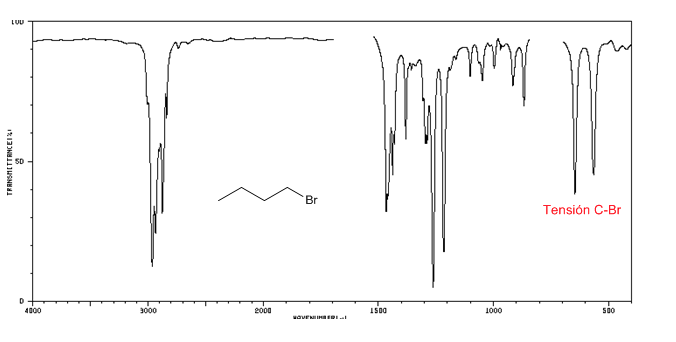
Espectro IV de haletos de alquila
Tensão C-Cl: 785 - 540 cm-1
Ension C-Br: 650 - 510 cm-1
 Fontes recomendadas para expandir a pesquisa:
Fontes recomendadas para expandir a pesquisa:
1. Aga Fano SA Espectroscopia de Emissão. (Acessado em 10 de setembro de 2007). http://hiq.aga.com.co/International/Web/LG/CO/likelgspgco.nsf/DocByAlias/anal_icp .
2. Alonso, P. et al. química Cou..Ed. McGraw-Hill. 1990.
3. Álvarez Jiménez, MD e Gómez del Río, MI Guia Didático Química Analítica II. UNED. 1999.
4. Chegadas Jimeno Siro; Burriel Barceló Fernando; Hernández Mendez Jesus; Lucena Conde Felipe. Química Analítica Qualitativa. ISBN: 8497321405. ISB. 2006.
5. Ayres, Gilbert H. Análise Química Quantitativa. Edições do Castelo, 4ª ed . ISBN: 8421902806. 1981. See More
6. Bermejo Barrera. M del Pilar. Química analítica geral, quantitativa e instrumental. Editorial Paraninfo. 7ª Edição. ISBN: 8428318093. 1990.
7. Blanco, M., Cerdá, V. e Sanz Medel, A., Espectroscopia Atômica Analítica, Publicações da Universidade Autônoma de Barcelona. 1990.
8. Brode. RW, espectroscopia química, Nova York 1952.
9. Burriel, MF, Lucena, CF. Química Analítica Quantitativa. Edição Revolucionária. Havana.1978.
10. Burriel, F. Química Analítica Qualitativa. Editorial Paraninfo. ISBN: 8497321405. pp 1072. , 2003.