Infrarot-Spektroskopie
Die Infrarotspektrometrie ist äußerst nützlich für die qualitative Bestimmung organischer Verbindungen und zum Ableiten von Molekülstrukturen aus ihren funktionellen Gruppen sowohl organischer als auch anorganischer Verbindungen.
In der qualitativen Analytik kann die Infrarotspektroskopie zur Identifizierung reiner Substanzen oder zur Absorption, Lokalisierung und Identifizierung von Verunreinigungen eingesetzt werden.
Um eine Verunreinigung in einem Stoff zu lokalisieren, wird ein Vergleich zwischen dem Spektrum des untersuchten Stoffes und einer Probe des reinen Stoffes durchgeführt. Verunreinigungen lassen zusätzliche Absorptionsbanden im Spektrum erscheinen.
Im IR finden sie auch zunehmend Anwendung in der quantitativen Analytik, das Hauptanwendungsgebiet dieser Art der Analytik liegt in der Quantifizierung von Luftschadstoffen, die aus industriellen Prozessen stammen.
Ein Teil des elektromagnetischen Spektrums, der sich von 0,8 bis 1000 μm erstreckt (was der Wellenzahl zwischen 12800 und 10 cm-1 entspricht), wird als Infrarotbereich betrachtet, der in drei Bereiche unterteilt ist:
a).- IR Nah. b).- Fundamentales oder mittleres IR c).- Fernes IR
Jede Art von Bindung absorbiert Infrarotstrahlung mit einer anderen Frequenz, wodurch bestimmt werden kann, welche Art von funktionellen Gruppen das untersuchte Molekül hat. Infrarot-Spektralphotometer arbeiten im mittleren Infrarot und scannen von 4000 cm − 1 bis 400 cm − 1
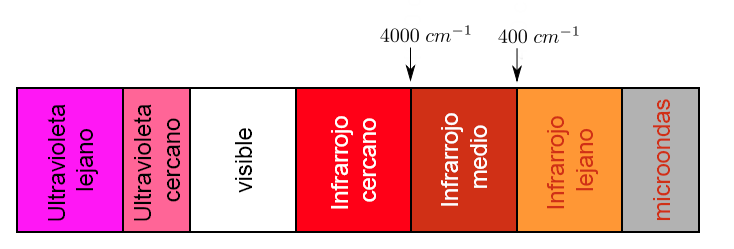
Der Bereich von analytischer Bedeutung ist jedoch der fundamentale IR-Bereich, da die meisten Infrarotinstrumente diesen Bereich abdecken.
Die meisten organischen und anorganischen Materialien zeigen Absorption und das Spektrum wird hauptsächlich durch Schwingungsdehnung und -biegung innerhalb des Moleküls verursacht. Das Infrarotspektrum ist eine der charakteristischsten Eigenschaften einer Verbindung, da es keine zwei identischen Spektren für zwei verschiedene Verbindungen gibt, es ist wie ein Fingerabdruck.
Innerhalb der fundamentalen IR-Region gibt es zwei Regionen, eine davon ist die sogenannte
die funktionellen Gruppen von 4000 cm –1 bis 1300 cm –1 und die Fingerregion von 1300 cm –1 bis 670 cm –1 .
Im Bereich der funktionellen Gruppen ist die Position des Absorptionspeaks höher oder niedriger, abhängig nur von der funktionellen Gruppe, an der die Absorption ankommt, und nicht von der gesamten Molekülstruktur. Die Lage der Peaks im Fingerbereich ist abhängig von der gesamten Molekülstruktur.
Eigenschaften, die eine Schwingung haben muss, um eine Absorptionsbande zu erzeugen:
Die einfallende Strahlung muss eine Frequenz haben, die gleich der Frequenz der Vibration ist, die sie erzeugen wird.
Dass die resultierende Schwingung eine Änderung des Dipolmoments erzeugt, dh die Schwingung absorbiert keine Infrarotstrahlung, wenn es keine Änderung des Dipolmoments gibt, wird dies als inaktive Schwingung bezeichnet, und sie sind aktiv, wenn die Änderung des Dipols auftritt Moment.
Traditionell verwendet die x-Achse von Infrarotspektren die Anzahl der Wellen ( ν ¯ , gelesen "nu bar"') und wird als Kehrwert der Wellenlänge in cm definiert. ν ¯ = 1 λ . Die y-Achse stellt den Prozentsatz der durchgelassenen Strahlung (Durchlässigkeit) dar, der durch % T dargestellt wird. Die Form des Infrarotspektrums von Hexan ist unten gezeigt.
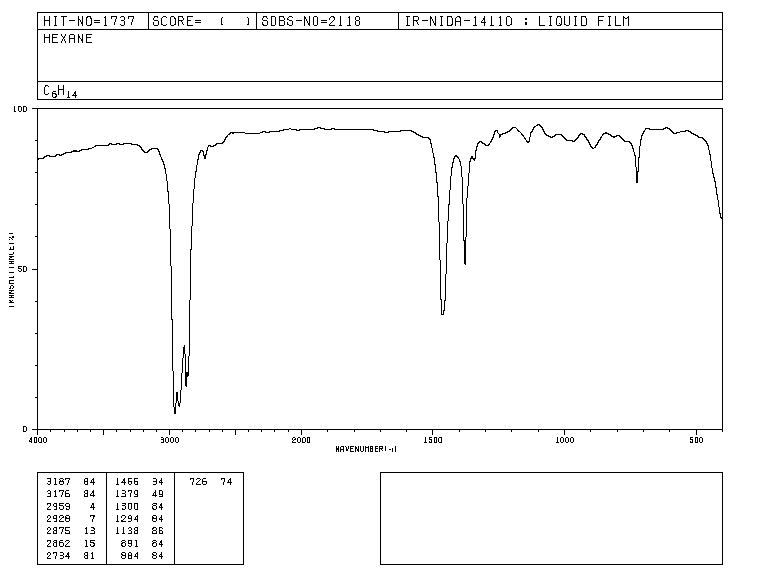
Die Bänder stellen Bereiche dar, in denen die Bindungen des Moleküls Infrarotstrahlung absorbieren. In den Bändern ist die Transmission klein und die Extinktion groß.
Arten von Schwingungen
Spannungsvibration (Dehnung). Atome, die durch Einfach-, Doppel- oder Dreifachbindungen zusammengehalten werden, bewegen sich in Richtung der Bindung hin und weg, genau wie zwei an einer Feder befestigte Massen schwingen.
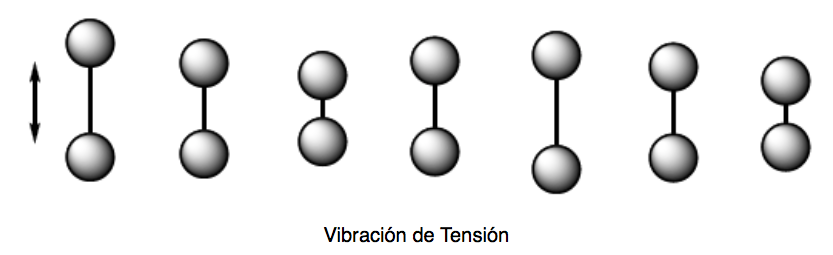
Es gibt zwei Modi der Spannungsschwingung: symmetrisch und asymmetrisch.
Biegeschwingung. Die Atome schwingen, sodass sich die Winkel ändern, nicht aber die Bindungslängen. Es gibt vier Arten von Biegeschwingungen: Scheren, Schaukeln, Wackeln und Verdrehen.
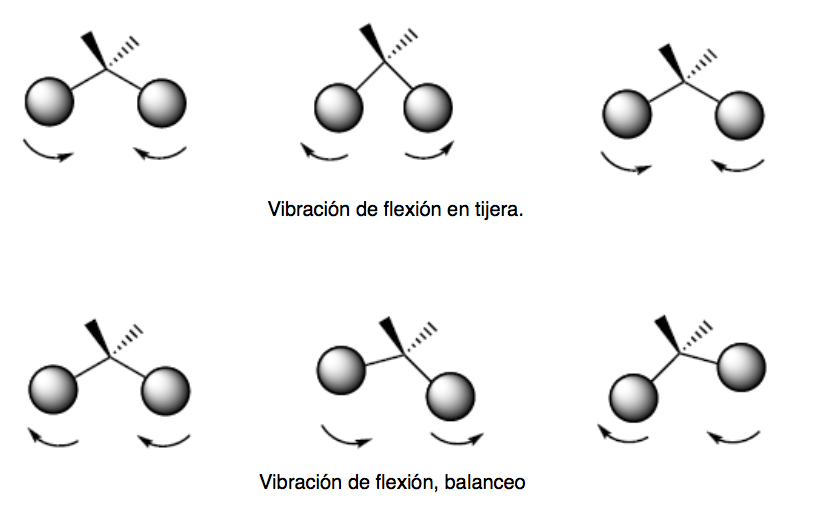
Diese beiden Schwingungsmodi finden in der Ebene statt, die die drei an der Schwingung beteiligten Atome enthält.
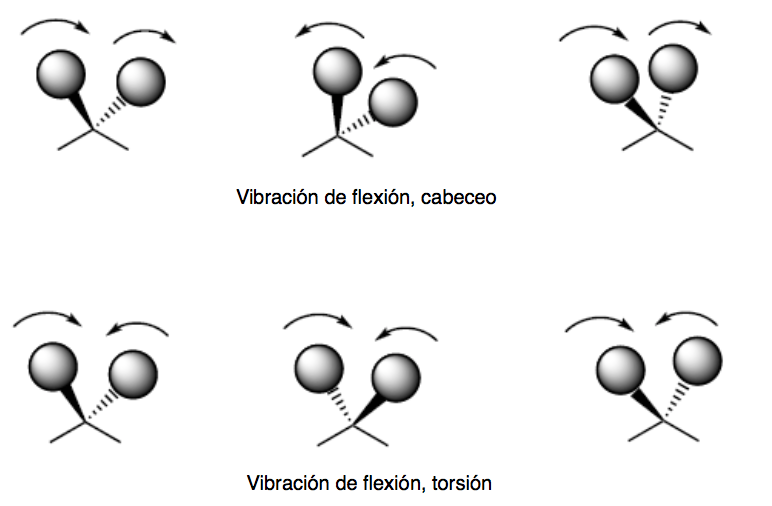
Die Tonhöhen- und Torsionsschwingungsmodi treten außerhalb der Ebene (Out of plane) auf und werden normalerweise durch Oop dargestellt.
harmonischer Quantenoszillator
Molekulare Schwingungen können mit dem Modell des harmonischen Quantenoszillators untersucht werden. Die Energie ergibt sich aus:
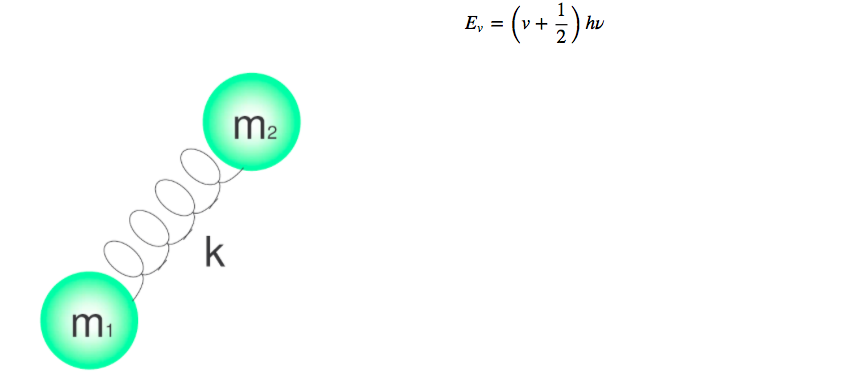
Die unterschiedlichen Energieniveaus sind durch die Quantenzahl v gegeben, die Werte von 0,1,2,3,4 annimmt.....
h ist die Plancksche Konstante und ν ist die Frequenz des Oszillators, die durch den Ausdruck gegeben ist:
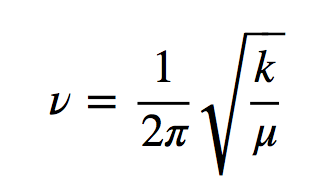
wobei k die Kraftkonstante der Feder und μ die reduzierte Masse des Systems ist
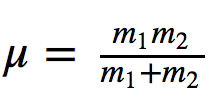
Teilt man die Frequenz durch die Lichtgeschwindigkeit, erhält man die Anzahl der Wellen ν ¯
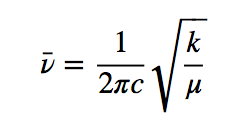
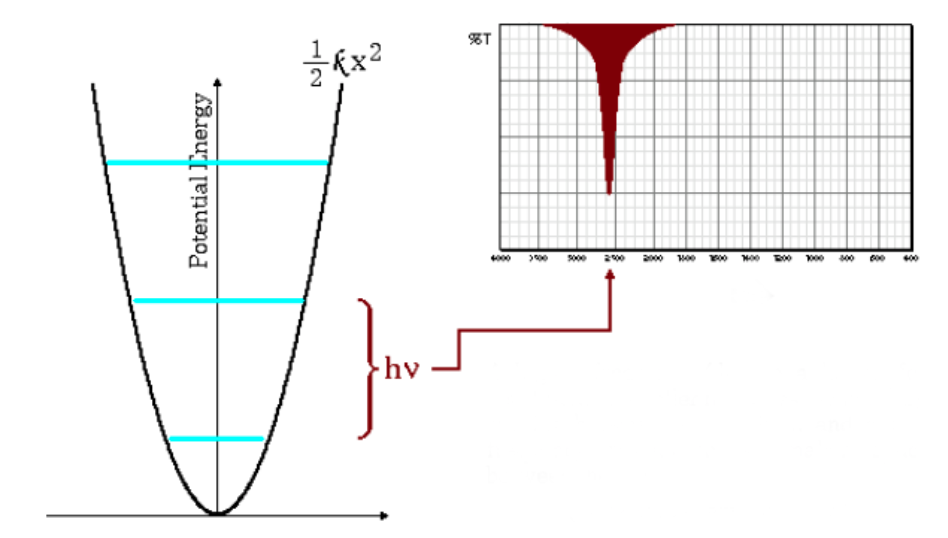
Die obige Gleichung zeigt an, dass kleine reduzierte Massen (atome mit geringer Masse) und hohe Kraftkonstanten (starke Bindungen) zu hohen Frequenzen führen. Unter diesen Bedingungen entstehen die Absorptionsbanden bei hohen Wellenzahlen.
Wie in der Grafik zu sehen ist, führen hohe Frequenzen zu einem größeren Abstand zwischen den Energieniveaus.
Niedrige Absorptionsfrequenzen
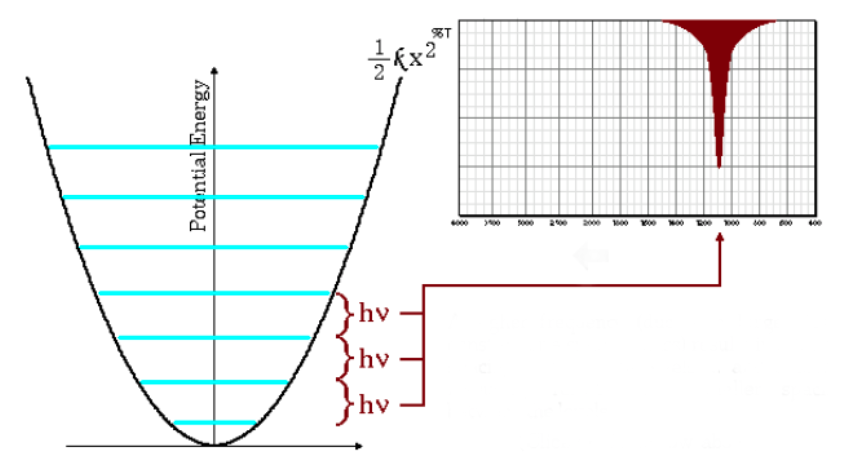
Die obige Gleichung auch zeigt an, dass große reduzierte Massen und kleine Kraftkonstanten (schwache Bindungen) zu niedrigen Frequenzen führen. Unter diesen Bedingungen treten die Absorptionsbanden bei niedrigen Wellenzahlen auf.
Wie in der Grafik zu sehen ist, führen niedrige Frequenzen zu einem geringeren Abstand zwischen den Energieniveaus.
Hauptmolekulare Schwingungen
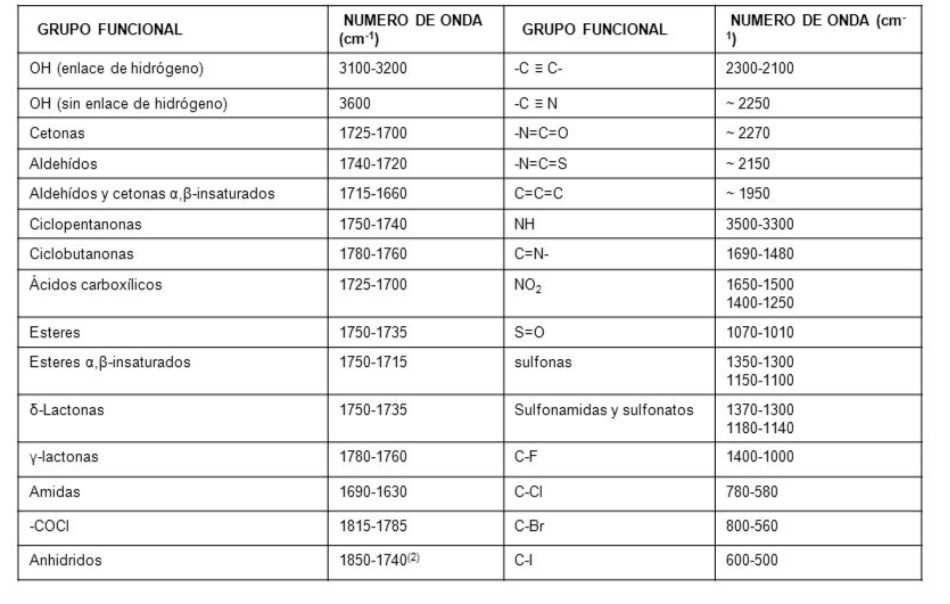
IR-Spektrum
In einem Infrarotspektrum wird die Frequenz (in Wellenzahl) gegen den Prozentsatz des durchgelassenen Lichts (Durchlässigkeit) aufgetragen. Der Transmissionsprozentsatz ist definiert als der Quotient zwischen der Intensität des durch die Probe transmittierten Lichts I M und der Intensität des Lichts des Referenzstrahls I R multipliziert mit 100.
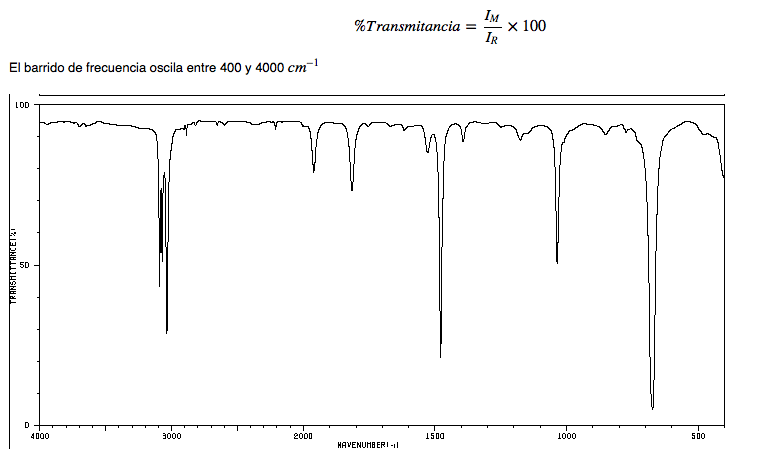
IR-Spektrum von Alkanen
• CH-Dehnung: Alkane zeigen CH-Dehnungsschwingungen knapp unter 3000 c m − 1
• CH-Biegung: Das CH 2 der Kette zeigt Biegeschwingungen (Scheren) bei 1465 c m − 1 , während die Methylgruppen eine Bande bei 1375 cm − 1 aufgrund symmetrischer Biegeschwingung und eine weitere bei 1450 cm − 1 aufgrund von erzeugen asymmetrische Biegeschwingung. Alle Liegestützbänder sind von mittlerer Intensität.
Beachten Sie, dass das asymmetrische Biegeband von Methyl mit dem Scheren-Biegeband von CH 2 überlappt.
IR-Spektrum von Hexan
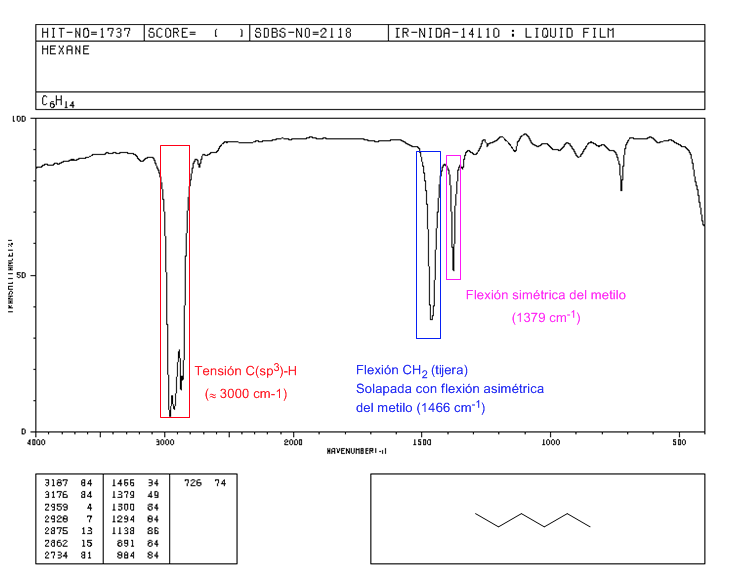
Spektrum von 2,2-Dimethylbutan
Das Vorhandensein der tert-Butylgruppe bewirkt die Aufspaltung der symmetrischen Biegebande in zwei Banden bei 1390 und 1370 c m − 1 . Das Band bei 1390 ist halb so stark wie das bei 1370.
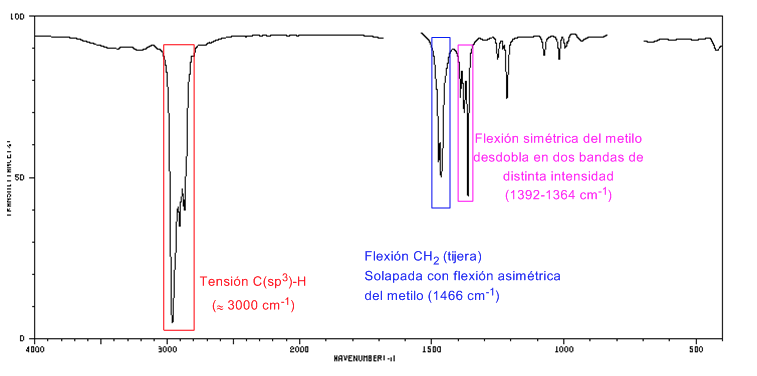
IR-Spektrum von Cycloalkanen
Cycloalkane haben ein IR-Spektrum, das Alkanen sehr ähnlich ist, mit einer CH-Streckbande etwas unter 3000 c m − 1 und einer CH-Biegebande in der Schere für CH 2 bei 1465 c m − 1 . Der Hauptunterschied zu Alkanen ist das Fehlen der symmetrischen Dehnungsbande von Methyl. 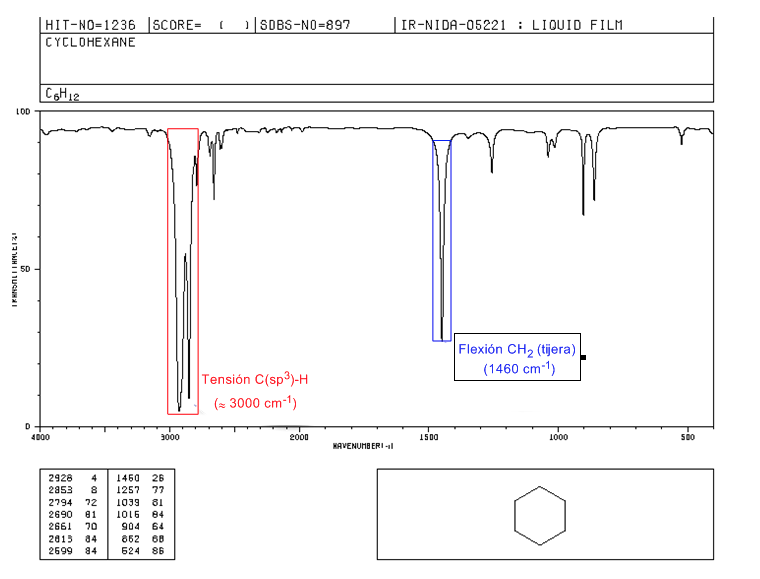
Beachten Sie das Fehlen der methylsymmetrischen Biegebande, die Alkane bei 1375 c m − 1 aufweisen.
IR-Spektrum von Alkenen
• Spannung C(sp2)-H: 3100 -3000 cm-1
• Spannung C=C: 1600 cm-1
• Biegung außerhalb der Ebene (oop) der C=CH-Bindung: 1000 - 650 cm-1. Diese Art von Band ermöglicht es, den Substitutionsgrad des Alkens zu kennen.
Spektrum von 1-Penten
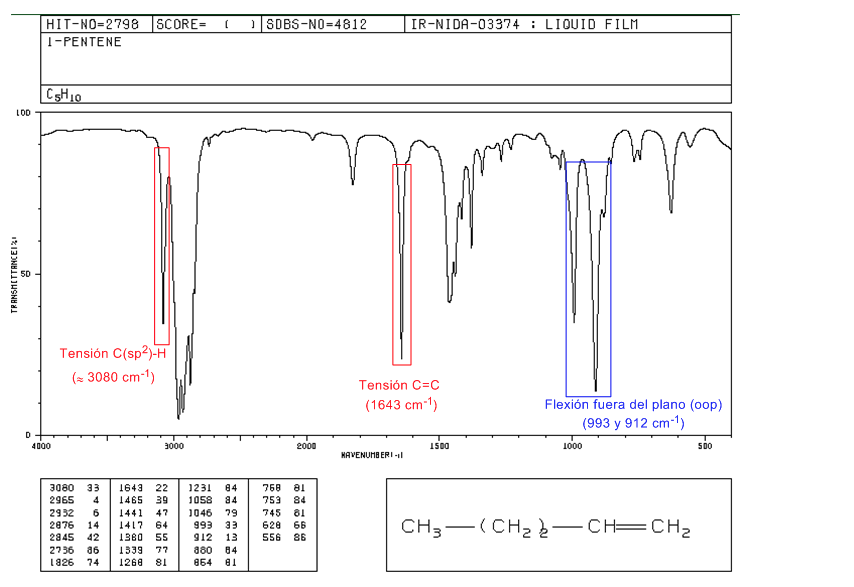
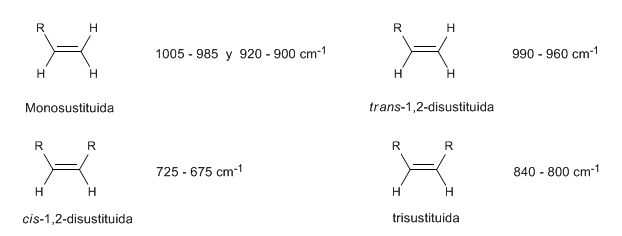
In monosubstituierten Alkenen wie 1-Penten erzeugen CH-Biegungen außerhalb der Ebene zwei Banden, die bei 1005–985 und 920–900 cm – 1 lokalisiert sind.
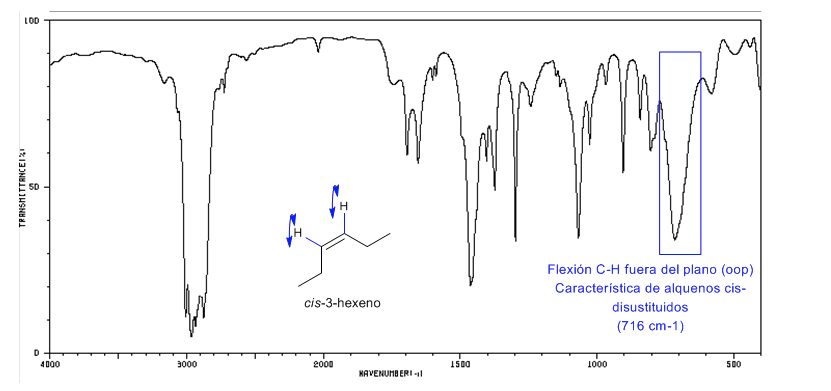
Stereochemie und IR-Spektroskopie von Alkenen
Cis-disubstituierte Alkene weisen eine CH-Biegebande außerhalb der Ebene auf, die ihre Unterscheidung ermöglicht. Diese Bande erscheint zwischen 725-675 cm − 1
Spektrum von Cis-3-Hexen
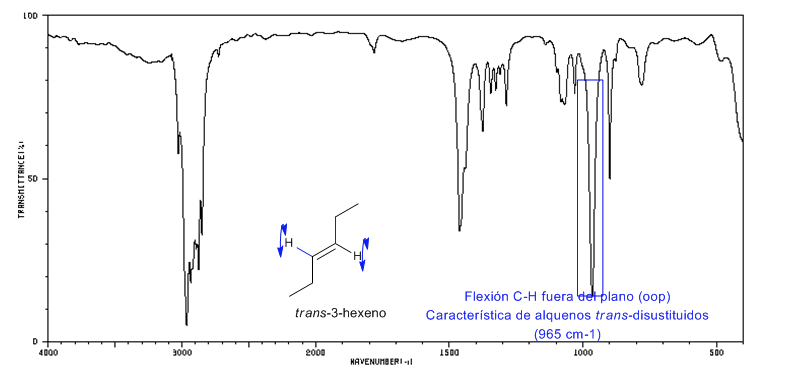
Spektrum von Trans-3-Hexen
Die trans-disubstituierten Alkene weisen eine starke Absorptionsbande zwischen 980–965 cm – 1 auf , die ihre Identifizierung ermöglicht. Beachten Sie das völlige Fehlen des C = C-Spannungsbandes bei 1600 cm − 1 aufgrund der fehlenden Polarität.
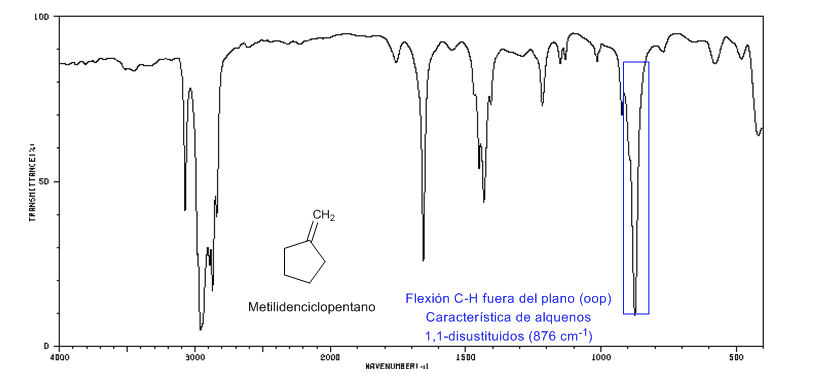
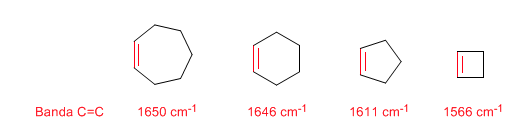
Ringstamm: Endocyclische C=C-Bindungen
Mit abnehmender Größe des Rings bewegt sich das Spannungsband der C=C-Bindungen in Richtung einer geringeren Anzahl von Wellen. Die Ausnahme von Cyclopropen wird der Kopplung zwischen den Spannungsschwingungen der C=C- und CC-Bindungen zugeschrieben. Diese Kupplung tritt in Cyclobuten nicht auf, da die C=C- und CC-Bindungen senkrecht zueinander stehen.
 IR-Spektrum von Cyclopenten
IR-Spektrum von Cyclopenten 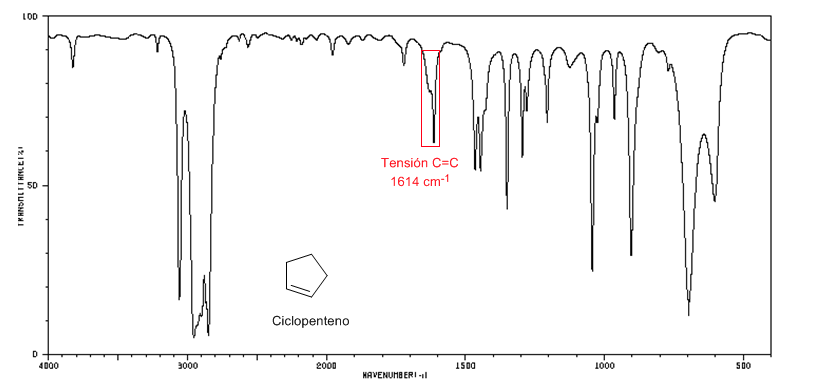
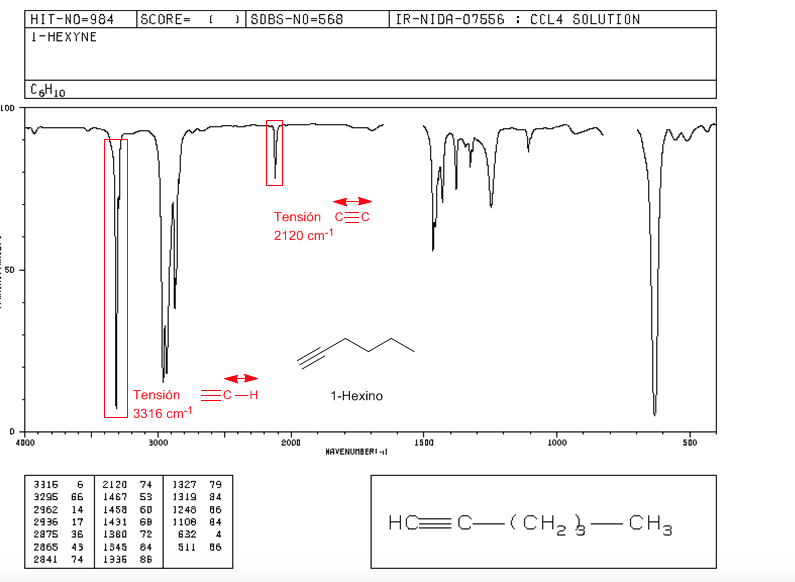
Spannung ≡ C − H : 3300 cm − 1
Spannung − C ≡ C − : 2150 cm − 1 . Symmetrische Alkine weisen diese Bande nicht auf, da sie in den inneren sehr schwach sind. Die Konjugation senkt den Wert leicht.
Spektrum von 1-Hexin
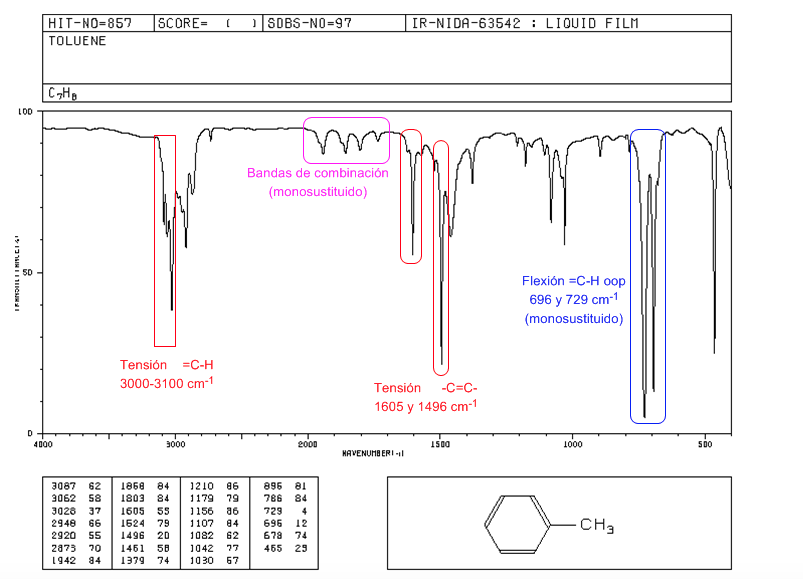
IR-Spektrum von Aromaten
Spannung =CH: 3100 cm-1
Spannung -C=C-: 1600 und 1475 cm-1
Flexion =CH aus der Ebene: 900-690 cm-1
Die oop-Schwingungen zusammen mit den Obertönen und Kombinationsbanden, die zwischen 2000 und 1667 cm-1 erscheinen, erlauben es uns, den Substitutionsgrad von Benzol zu kennen.
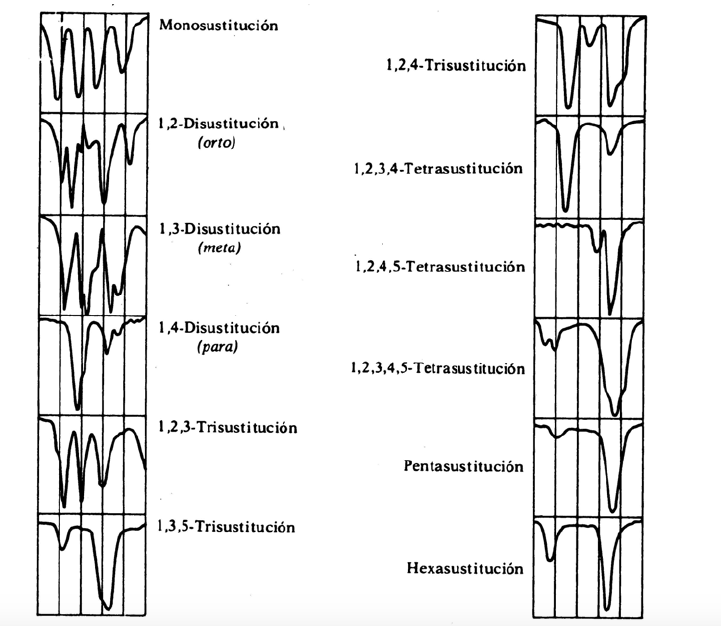
Ersatzbänder
![]()
Spektren von Alkoholen und Phenolen
OH-Spannung: Breitband von 3500 bis 3200 cm-1. In Abwesenheit von Wasserstoffbindungen erscheint es als scharfer Peak bei 3650–3600 cm –1 .
CO-Spannung: Band zwischen 1250-1000 cm-1. Es ermöglicht die Unterscheidung zwischen primären (1050 cm-1), sekundären (1100 cm-1), tertiären (1150 cm-1) und phenolischen (1220 cm-1) Alkoholen.
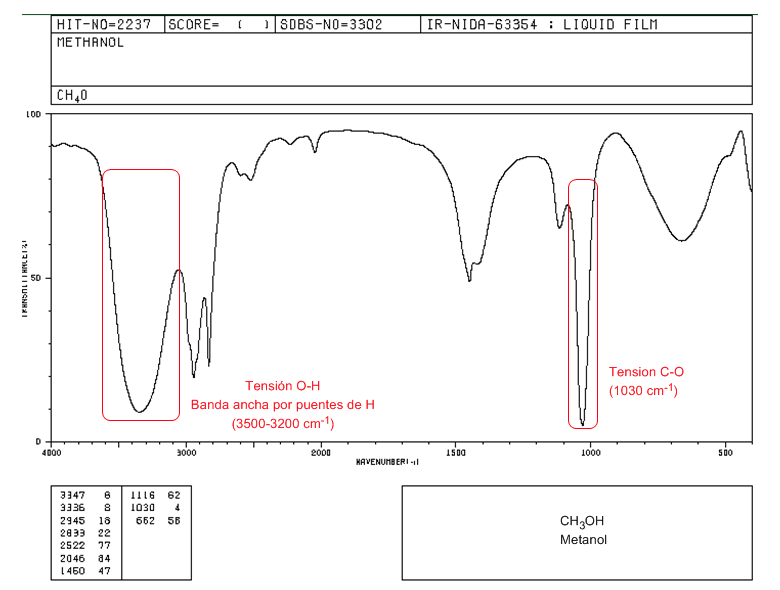
IR-Spektrum eines primären Alkohols (Methanol)
Im Spektrum von Methanol können wir aufgrund der Bildung von Wasserstoffbrückenbindungen das sehr breite OH-Spannungsband beobachten. Das CO-Spannungsband tritt bei einer niedrigen Wellenzahl (1030) auf, da es sich um einen Alkohol ohne Substituenten handelt.
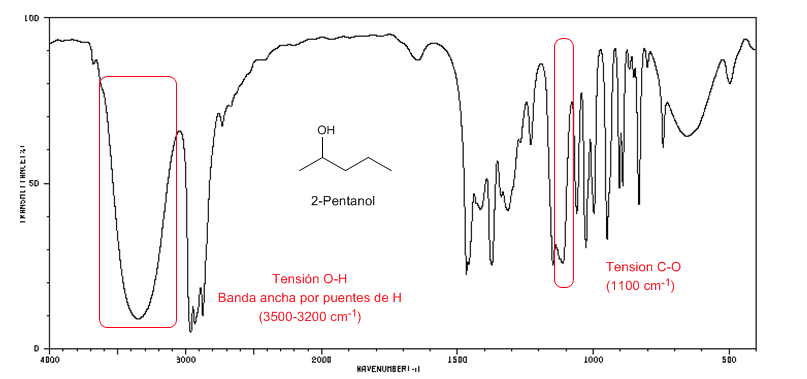
IR-Spektrum sekundärer Alkohole (2-Pentanol)
Beobachten Sie die Verschiebung der CO-Bande in Richtung einer größeren Anzahl von Wellen in Bezug auf Methanol.
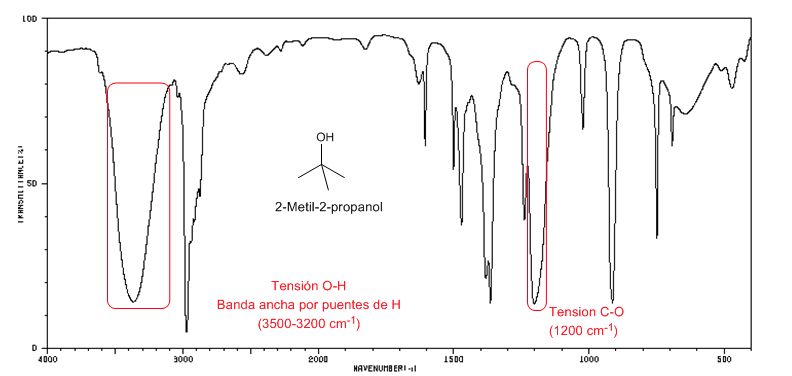
 IR-Spektrum von tertiären Alkoholen (2-Methyl-2-propanol)
IR-Spektrum von tertiären Alkoholen (2-Methyl-2-propanol)Bei tertiären Alkoholen ist die CO-Bande zu höheren Frequenzen verschoben als bei primären und sekundären Alkoholen.
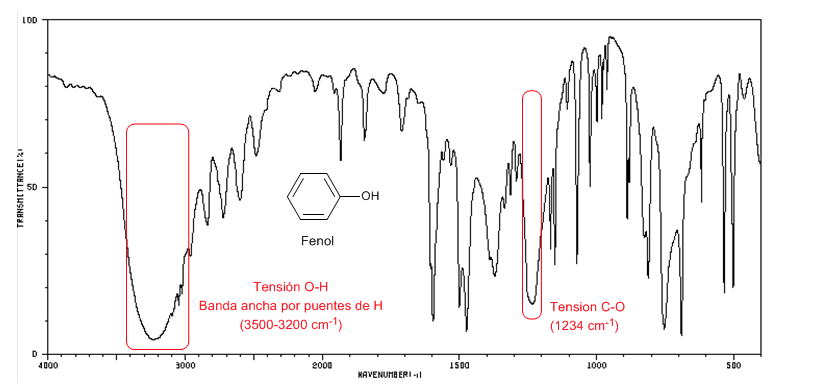
Phenol zeigt eine CO-Absorptionsbande über 1200 cm-1
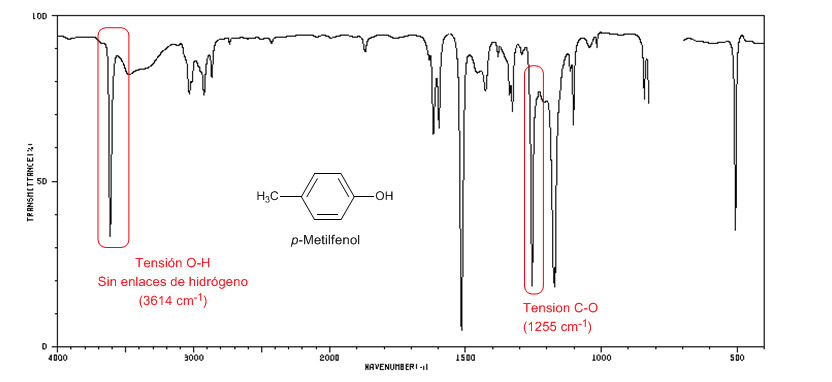
Das folgende Spektrum zeigt die OH-Streckbande ohne Wasserstoffbrückenbindung.
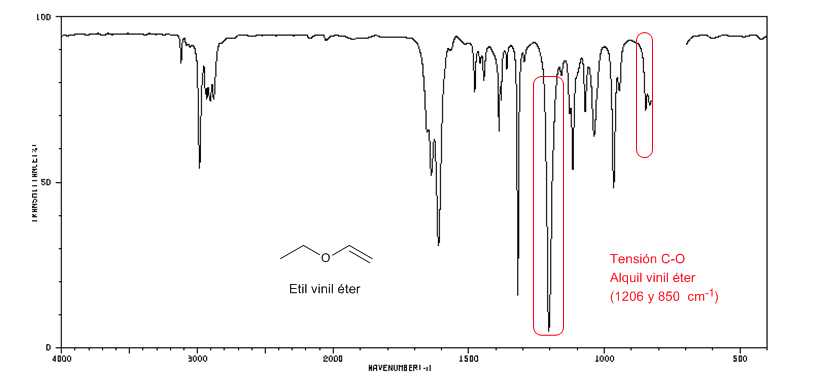
Die Alkylvinylether (CH2=CH-OR) zeigen zwei Banden bei 1220 und 850 cm-1. Letztere sehr schwach.
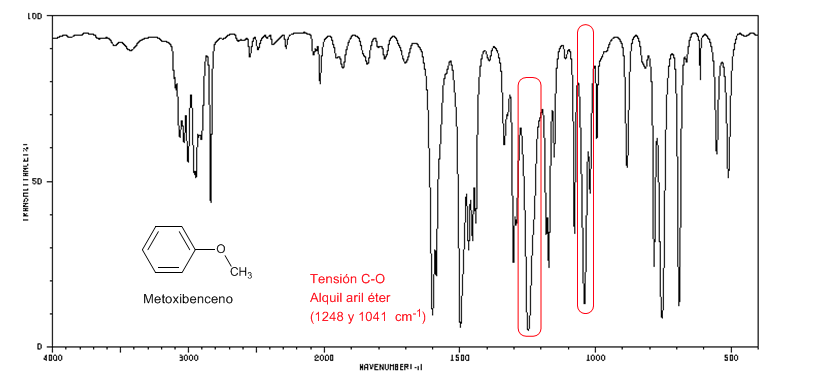
Die Arylalkylether (Ar-OR) zeigen zwei Banden bei 1250 und 1040 cm-1
IR-Spektrum von 1-Methoxyhexan

Ethylvinylether zeigt zwei Banden bei 1220 und 850 cm-1, letztere ist sehr schwach.
Methoxybenzol zeigt zwei Banden bei 1250 und 1040 cm-1
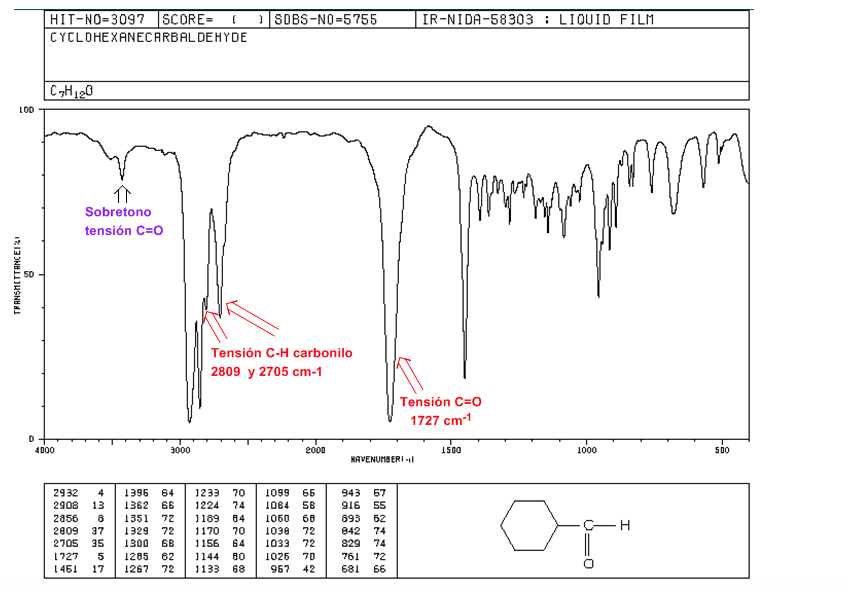
Aldehyde
C=O-Spannung: 1725 cm-1
CH-Carbonyl-Stamm: zwei schwache Banden bei 2850 und 2750 cm-1. Das Band bei 2850 neigt dazu, sich mit dem der Spannung C(sp3)-H zu überlappen
C=O-Spannungsoberton über 3500 cm-1.
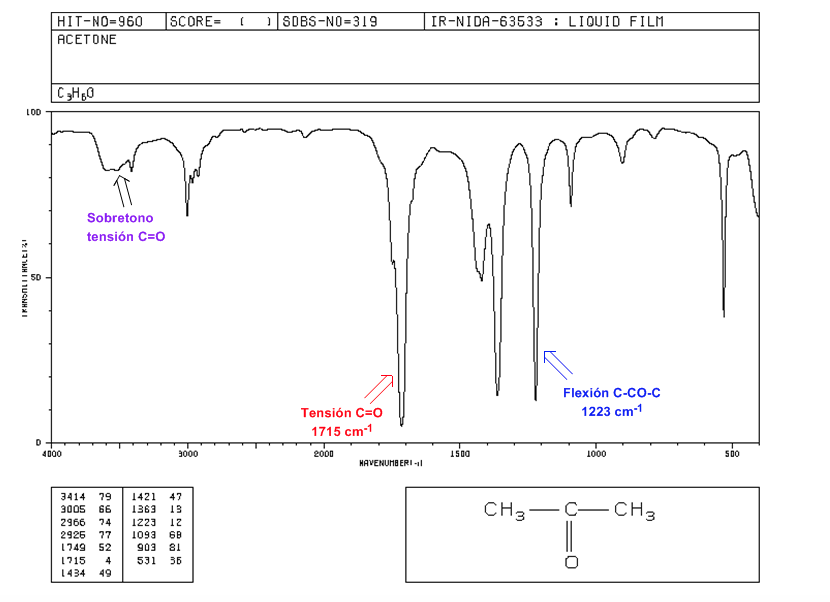
C=O Spannung: Intensives Band bei 1715 cm-1.
Flexion C-CO-C: 1300 - 1100 cm-1.
C=O-Spannungsoberton: von 3500 bis 3350 cm-1.
Auswirkung der Konjugation auf das C=O-Spannungsband
IR-Spektrum von Carbonsäuren und Derivaten
Carbonsäuren
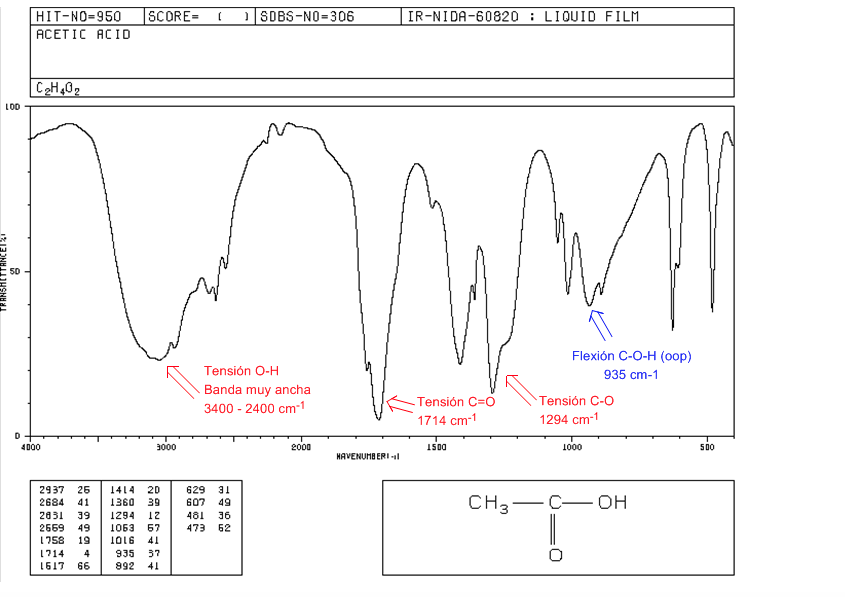
OH-Spannung: Von 3400 bis 2400 cm-1. Sehr breit aufgrund der Bildung von Wasserstoffbrückenbindungen.
C=O-Spannung: 1730–1700 cm –1
CO-Spannung: 1320-1200 cm-1
COH Flexion (oop): Glockenförmiges Band bei 900 cm-1
Ester
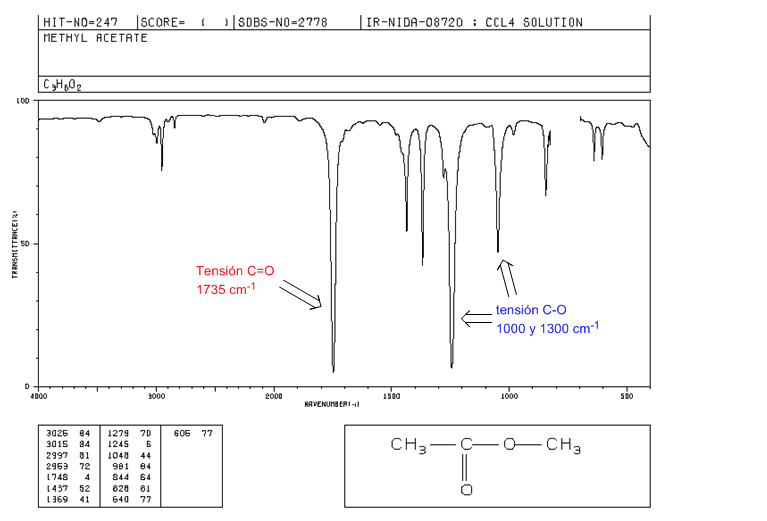
C=O-Spannung bei 1735 cm-1. Bei konjugierten Doppelbindungen mit dem Carbonyl verschiebt sich die Bande zu niedrigeren Werten. Wenn sich die Doppelbindung an der Alkoxygruppe (-OR) des Esters befindet, wird eine Verschiebung zu höheren Werten beobachtet.
CO-Spannung: 2 Bänder bei 1300 und 1000 cm-1. Der um 1300 beobachtete ist breiter und intensiver.
Säurehalogenide
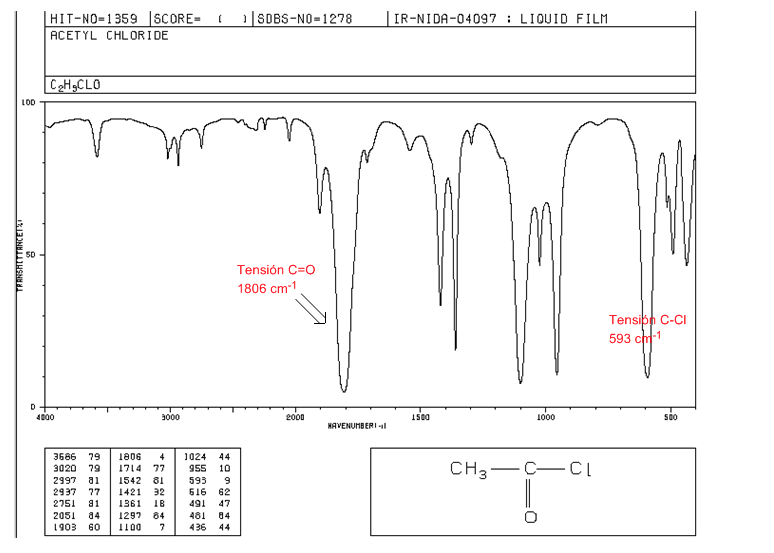
C=O-Spannung: 1810 - 1775 cm-1
C-Cl-Spannung: intensives Band 730 - 550 cm-1
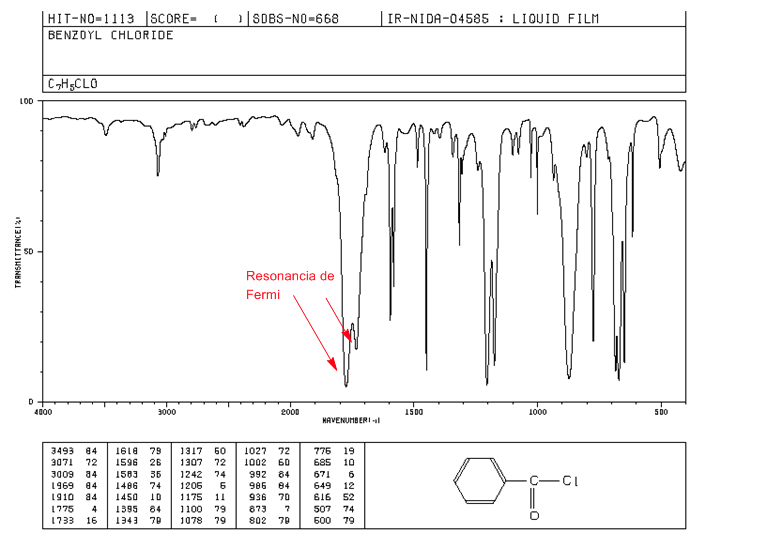
Fermi-Resonanz
Obertöne sind Schwingungsübergänge vom Grundzustand zu höheren angeregten Zuständen. Die Absorptionsfrequenzen sind die Frequenz der Grundabsorption. Fermi-Resonanz , resultieren aus der Kopplung einer fundamentalen Absorptionsbande mit einem Oberton oder einer Kombinationsbande.
Aromatische Alkanoylhalogenide weisen bei der Fermi-Resonanz zwei C=O-Spannungsbanden auf.
 Nitrile
Nitrile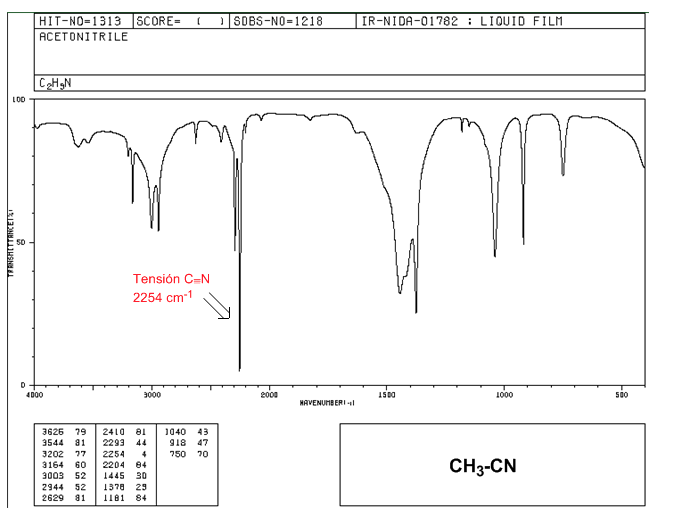
Amide
C=O-Spannung: 1680 - 1630 cm-1
NH-Spannung: Zwischen 3350 und 3180 cm-1. Primäre Amide haben zwei Banden, während sekundäre Amide nur eine Bande haben.
Beugung NH: 1640 - 1550 cm-1
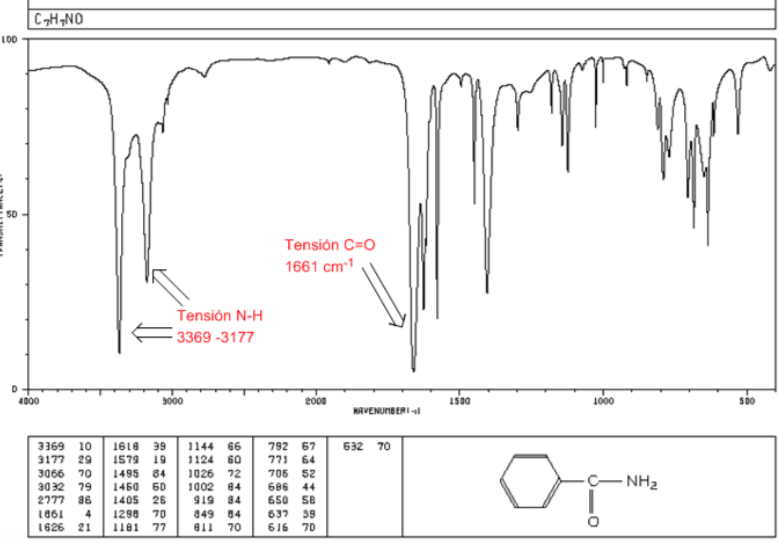
IR-Spektrum von Aminen
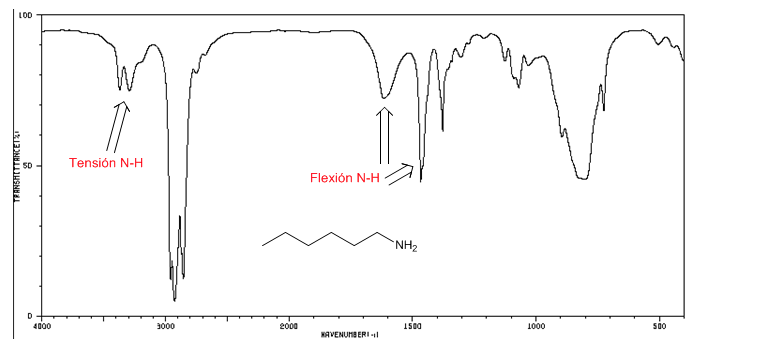
NH-Spannung: zwischen 3500 und 3300 cm-1. Die primären Amine zeigen zwei Banden (symmetrisch und asymmetrisch), die sekundären nur eine Bande.
NH-Biegung: Primäre Amine zwei Banden bei 1640 und 1560 cm-1. Sekundär eine Bande bei 1500 cm-1
IR-Spektrum von 1-Hexan-Amin
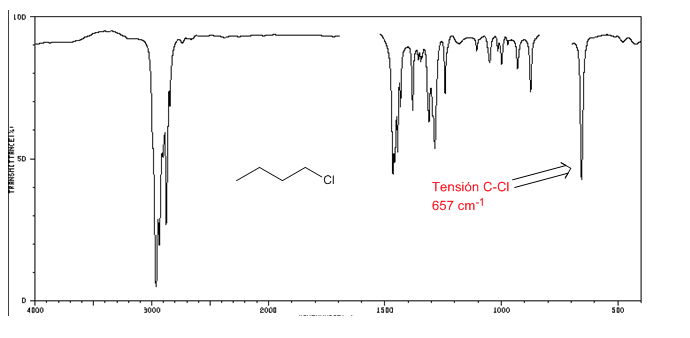
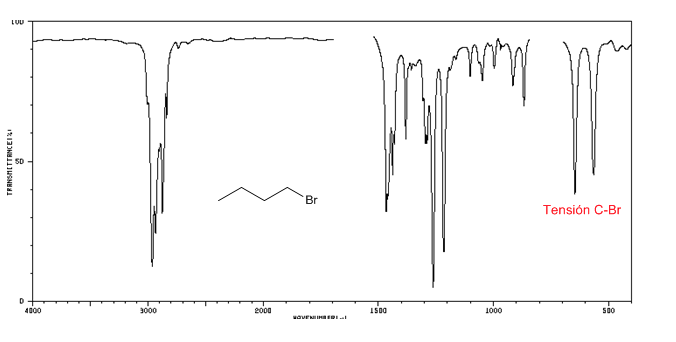
IR-Spektrum von Alkylhalogeniden
C-Cl-Spannung: 785 - 540 cm-1
Größe C-Br: 650 - 510 cm-1
 Empfohlene Quellen zur Erweiterung der Suche:
Empfohlene Quellen zur Erweiterung der Suche:
1. Aga Fano SA Emissionsspektroskopie. (Abgerufen am 10. September 2007). http://hiq.aga.com.co/International/Web/LG/CO/likelgspgco.nsf/DocByAlias/anal_icp .
2. Alonso, P. et al. Chemie Cou..Ed. McGraw-Hill. 1990.
3. Álvarez Jiménez, MD und Gómez del Río, MI Didaktischer Leitfaden Analytische Chemie II. UNED. 1999.
4. Ankünfte Jimeno Siro; Burriel Barcelona Fernando; Hernández Mendez Jesus; Lucena Graf Felipe. Qualitative Analytische Chemie. ISBN: 8497321405. ISB. 2006.
5. Ayres, Gilbert H. Quantitative chemische Analyse. Editionen des Schlosses, 4. Aufl . ISBN: 8421902806. 1981.
6. Bermejo Barrera. M del Pilar. Allgemeine, quantitative und instrumentelle analytische Chemie. Redaktion Paraninfo. 7. Auflage. ISBN: 8428318093. 1990.
7. Blanco, M., Cerdá, V. und Sanz Medel, A., Analytical Atomic Spectroscopy, Veröffentlichungen der Autonomen Universität Barcelona. 1990.
8. Brode. RW, Chemische Spektroskopie, New York 1952.
9. Burriel, MF, Lucena, CF. Quantitative Analytische Chemie. Revolutionäre Ausgabe. Havanna.1978.
10. Burriel, F. Qualitative Analytische Chemie. Redaktion Paraninfo. ISBN: 8497321405. S. 1072. , 2003.