spektroskopi inframerah
Spektrometri inframerah sangat berguna untuk penentuan kualitatif senyawa organik dan untuk menyimpulkan struktur molekul dari gugus fungsi senyawa organik dan anorganik.
Dalam analisis kualitatif spektroskopi inframerah dapat digunakan untuk identifikasi zat murni atau untuk penyerapan, lokalisasi, dan identifikasi pengotor.
Untuk menemukan pengotor dalam suatu zat, perbandingan dibuat antara spektrum zat yang dipelajari dan sampel zat murni. Kotoran menyebabkan pita serapan tambahan muncul dalam spektrum.
Di IR mereka juga menemukan peningkatan penggunaan dalam analisis kuantitatif, bidang utama penerapan jenis analisis ini adalah dalam kuantifikasi polutan atmosfer yang berasal dari proses industri.
Bagian dari spektrum elektromagnetik yang membentang dari 0,8 hingga 1000μm (yang sesuai dengan bilangan gelombang antara 12800 dan 10 cm-1), dianggap sebagai wilayah inframerah yang dibagi menjadi tiga wilayah yang disebut:
a).- IR Dekat. b).- IR Fundamental atau Menengah c).- IR Jauh
Setiap jenis ikatan menyerap radiasi infra merah pada frekuensi yang berbeda, yang memungkinkan untuk menentukan jenis gugus fungsi apa yang dimiliki molekul yang diteliti. Spektrofotometer inframerah bekerja pada pertengahan inframerah dan memindai dari 4000 c m − 1 hingga 400 c m − 1
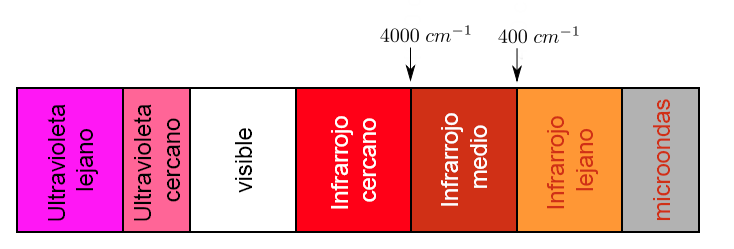
Namun, wilayah kepentingan analitis adalah wilayah IR Fundamental karena sebagian besar instrumen inframerah mencakup wilayah ini.
Sebagian besar bahan organik dan anorganik menunjukkan penyerapan dan spektrum terutama disebabkan oleh peregangan dan pembengkokan vibrasi di dalam molekul. Spektrum infra merah adalah salah satu sifat paling khas dari suatu senyawa karena tidak ada dua spektrum yang identik untuk dua senyawa yang berbeda, seperti sidik jari.
Di dalam wilayah IR Fundamental ada dua wilayah, salah satunya adalah yang disebut
gugus fungsi dari 4000cm-1 sampai 1300 cm-1, dan daerah jari dari 1300 cm-1 sampai 670cm-1.
Di wilayah gugus fungsi, posisi puncak serapan lebih tinggi atau lebih rendah hanya bergantung pada gugus fungsi tempat serapan tiba dan bukan pada struktur molekul lengkap. Posisi puncak di daerah jari bergantung pada struktur molekul yang lengkap.
Karakteristik yang harus dimiliki oleh getaran untuk menghasilkan pita serapan:
Radiasi insiden harus memiliki frekuensi yang sama dengan frekuensi getaran yang akan dihasilkannya.
Bahwa getaran yang dihasilkan menghasilkan perubahan momen dipol, yaitu getaran tidak akan menyerap radiasi infra merah, jika tidak terjadi perubahan momen dipol disebut getaran inaktif dan akan aktif bila terjadi perubahan dipol tersebut. momen.
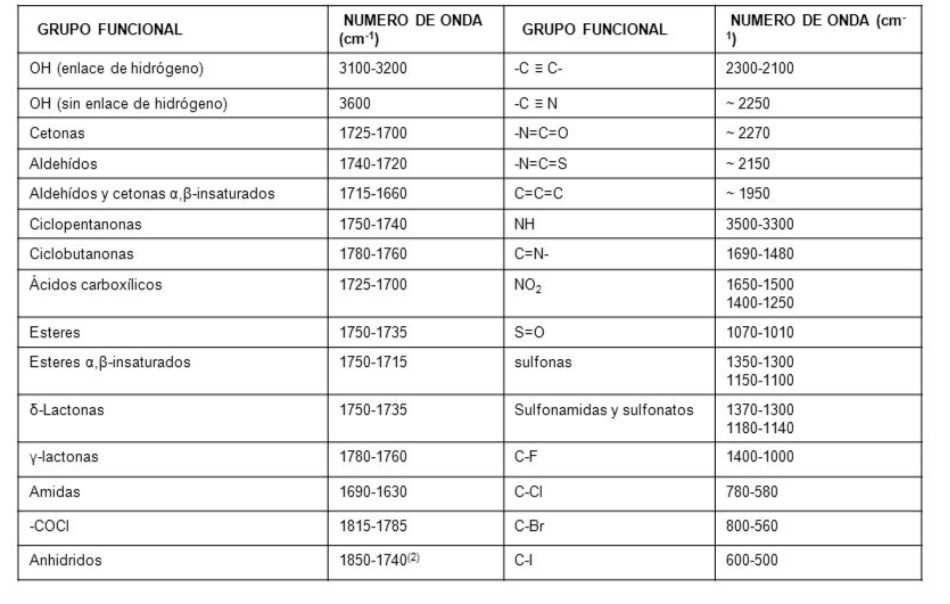
Secara tradisional, sumbu x spektrum infra merah menggunakan jumlah gelombang ( ν ¯ , dibaca "nu bar"') dan didefinisikan sebagai kebalikan dari panjang gelombang dalam cm. ν ¯ = 1 λ . Sumbu y mewakili persentase radiasi yang ditransmisikan (transmitansi) yang diwakili oleh % T . Bentuk spektrum inframerah heksana ditunjukkan di bawah ini.
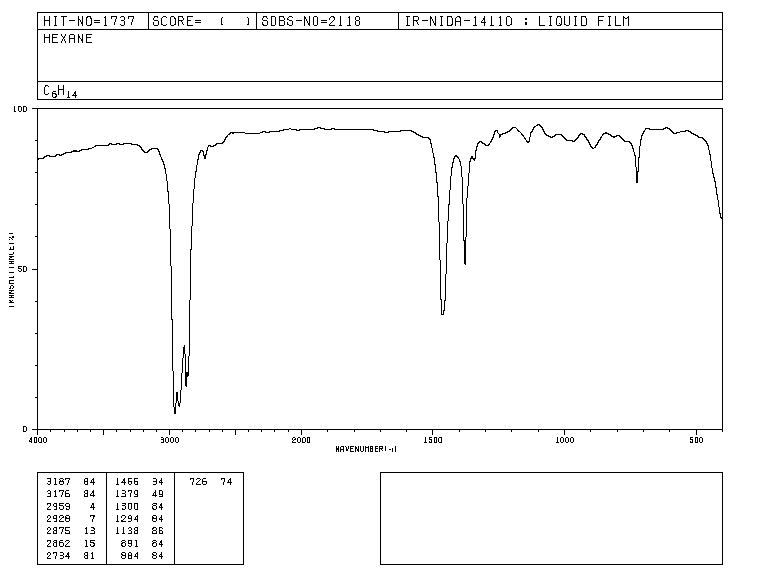
Pita mewakili area di mana ikatan molekul menyerap radiasi infra merah. Di pita transmisinya kecil dan absorbansinya besar.
jenis getaran
Getaran tegangan (peregangan). Atom-atom yang disatukan oleh ikatan tunggal, rangkap, atau rangkap tiga bergerak menuju dan menjauhi arah ikatan, seperti halnya dua massa yang terikat pada pegas berosilasi.
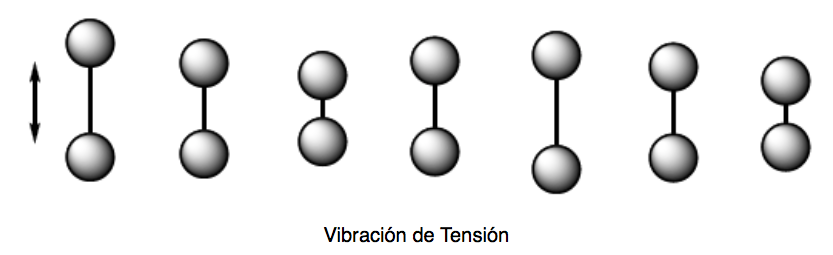
Ada dua mode getaran tegangan: simetris dan asimetris.
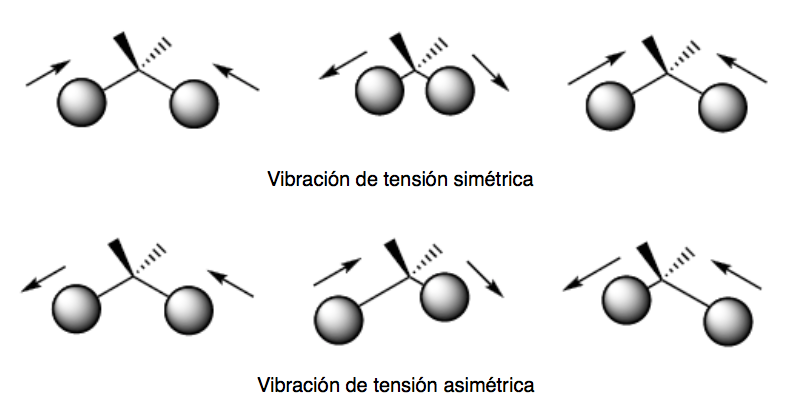
getaran lentur. Atom-atom bergetar sehingga sudutnya bervariasi, tetapi panjang ikatannya tidak. Ada empat mode vibrasi tekukan: scissoring, rocking, wagging, dan twisting.
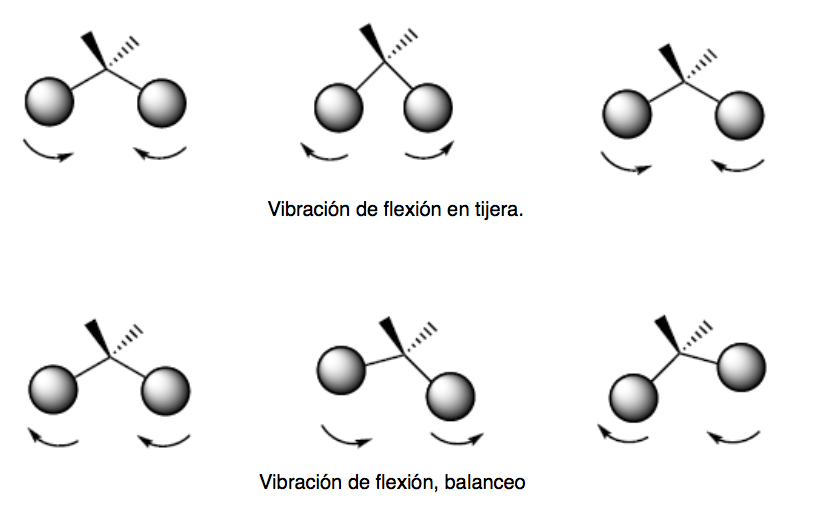
Kedua mode getaran ini terjadi di bidang yang mengandung tiga atom yang berpartisipasi dalam getaran tersebut.
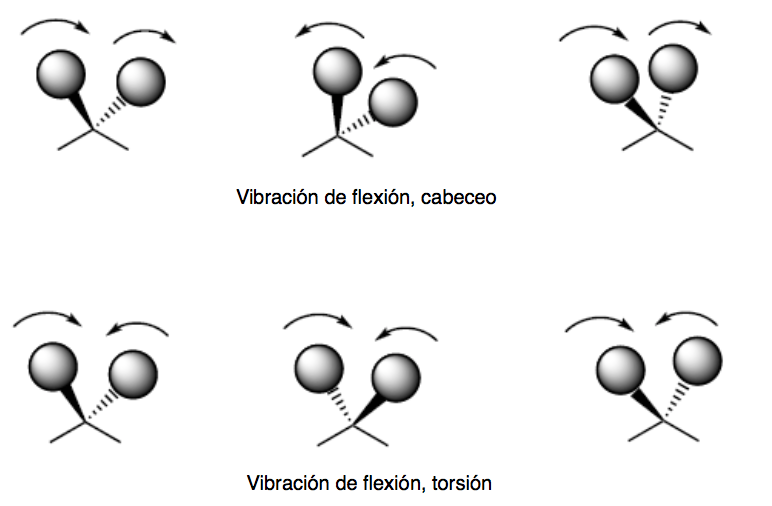
Mode getaran pitch dan torsi terjadi di luar bidang (Out of plane) dan biasanya diwakili oleh Oop.
osilator harmonik kuantum
Getaran molekuler dapat dipelajari dengan model osilator harmonik kuantum. Energi diberikan oleh:
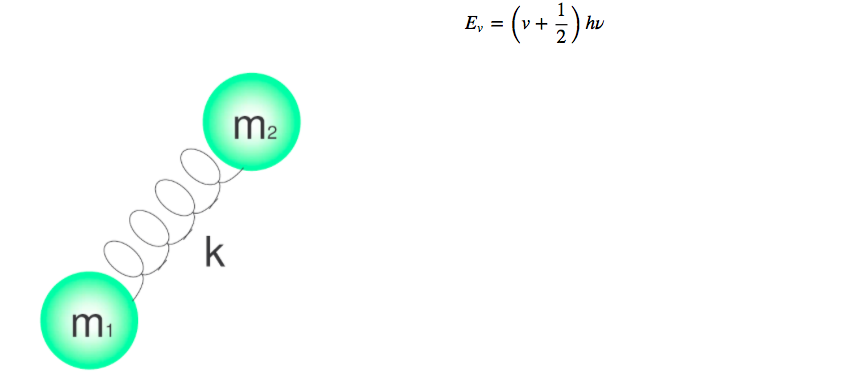
Tingkat energi yang berbeda diberikan oleh bilangan kuantum v, yang mengambil nilai 0.1.2.3.4.....
h adalah konstanta Planck dan ν adalah frekuensi osilator yang diberikan oleh ekspresi:
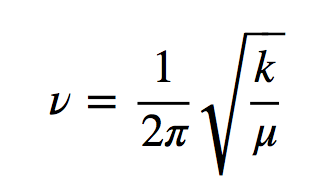
di mana k adalah konstanta gaya pegas dan μ adalah massa tereduksi dari sistem
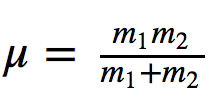
Membagi frekuensi dengan kecepatan cahaya memberikan jumlah gelombang ν ¯
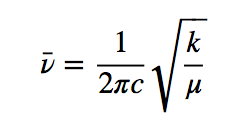
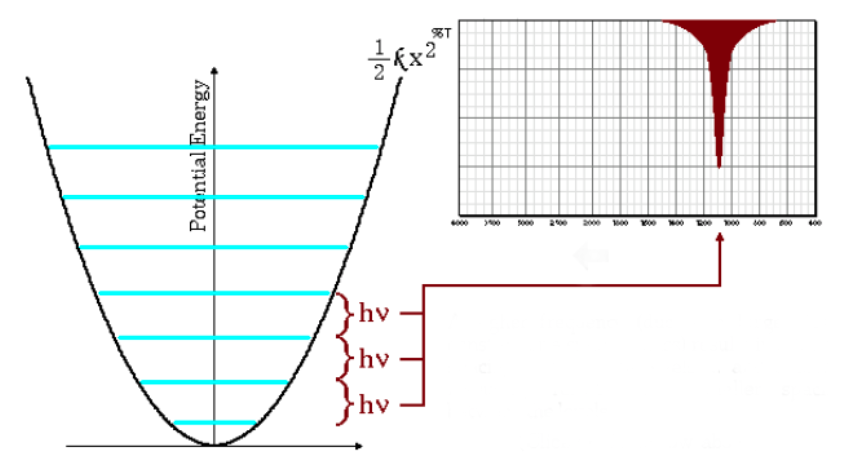
Persamaan di atas menunjukkan bahwa massa tereduksi kecil (atom bermassa rendah) dan konstanta gaya tinggi (ikatan kuat) menyebabkan frekuensi tinggi. Dalam kondisi ini pita serapan muncul pada bilangan gelombang tinggi.
Seperti dapat dilihat pada grafik, frekuensi tinggi menimbulkan jarak yang lebih besar antara tingkat energi.
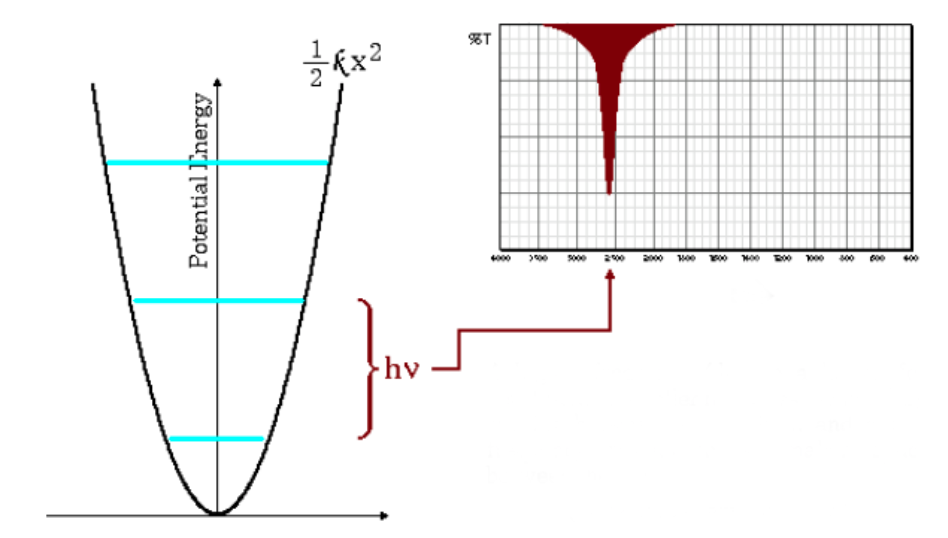
Frekuensi penyerapan rendah
Persamaan di atas juga menunjukkan bahwa massa tereduksi besar dan konstanta gaya kecil (ikatan lemah) menyebabkan frekuensi rendah. Dalam kondisi ini pita serapan keluar pada bilangan gelombang rendah.
Seperti dapat dilihat pada grafik, frekuensi rendah menimbulkan jarak yang lebih kecil antara tingkat energi.
Getaran molekul utama
spektrum IR
Dalam spektrum inframerah, frekuensi (dalam bilangan gelombang) diplot terhadap persentase cahaya yang ditransmisikan (transmitansi). Persentase transmitansi didefinisikan sebagai hasil bagi antara intensitas cahaya yang ditransmisikan melalui sampel, I M , dan intensitas cahaya berkas referensi I R dikalikan dengan 100.
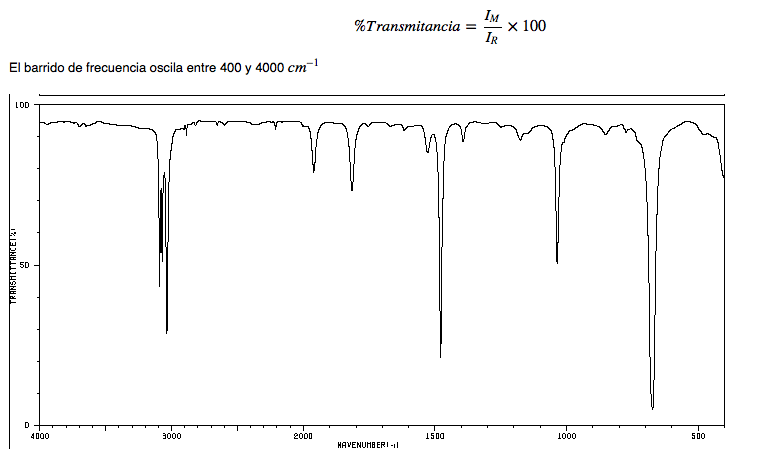
spektrum IR alkana
• Strain CH: alkana menunjukkan vibrasi regangan CH sedikit di bawah 3000 c m − 1
• CH tekuk: CH 2 rantai menunjukkan vibrasi tekukan (gunting) pada 1465 c m − 1 , sementara metil menghasilkan pita pada 1375 c m − 1 akibat vibrasi tekuk simetris dan lainnya pada 1450 c m − 1 akibat getaran lentur asimetris. Semua band push-up adalah intensitas sedang.
Perhatikan bahwa pita lentur asimetris metil tumpang tindih dengan pita lentur gunting CH 2 .
spektrum IR heksana
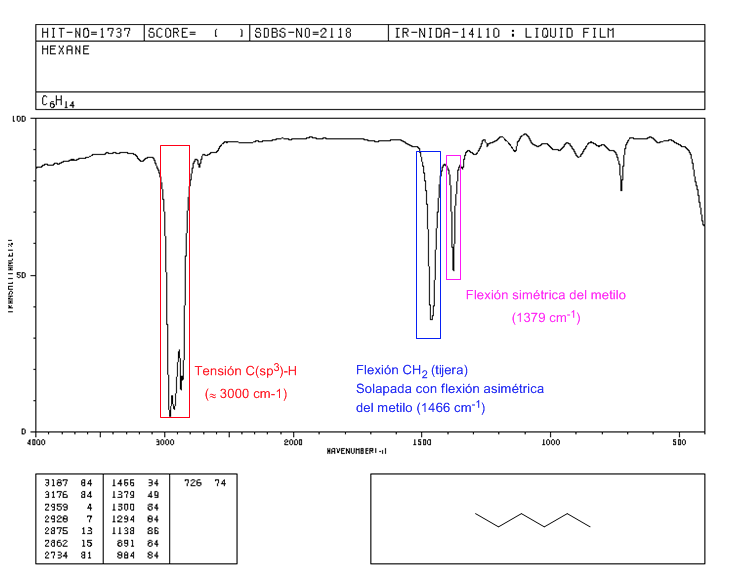
Spektrum 2,2-dimetilbutana
Adanya gugus tert-butil menghasilkan pemisahan pita lentur simetris menjadi dua pita pada 1390 dan 1370 c m − 1 . Band pada 1390 setengah kuat dari pada 1370.
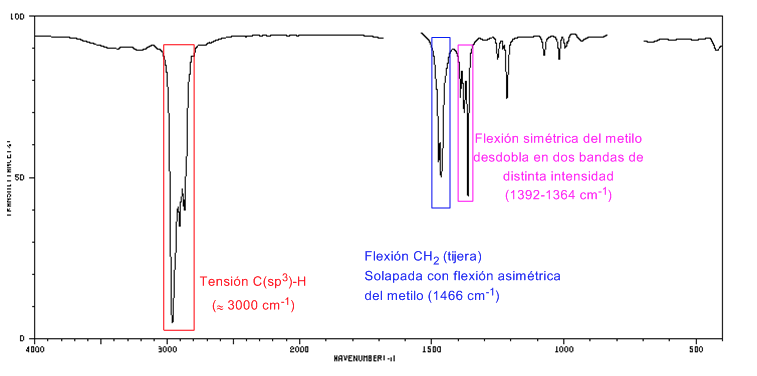
Spektrum IR sikloalkana
Sikloalkana memiliki spektrum IR yang sangat mirip dengan alkana dengan pita regangan CH sedikit di bawah 3000 c m − 1 dan pita lentur CH dalam gunting untuk CH 2 pada 1465 c m − 1 . Perbedaan utama dengan alkana adalah tidak adanya pita peregangan metil yang simetris. 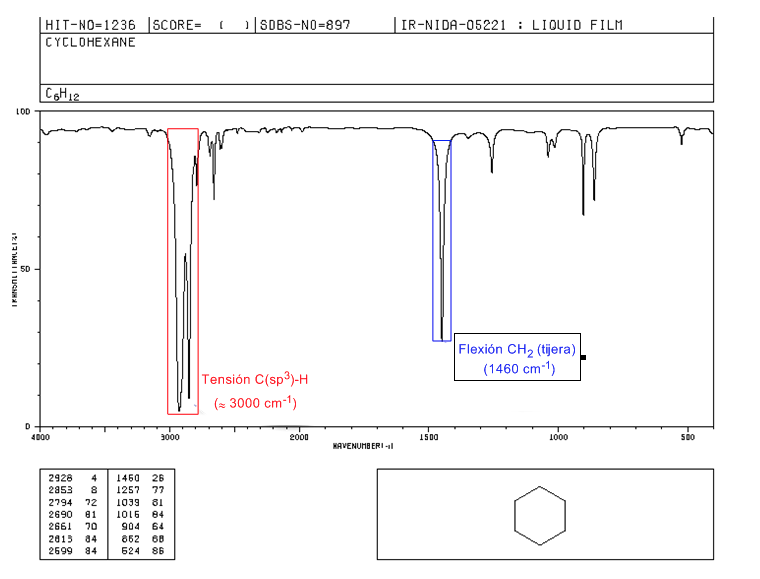
Perhatikan tidak adanya pita lentur simetris metil yang terdapat pada alkana pada 1375 c m − 1 .
spektrum IR alkena
• Tegangan C(sp2)-H: 3100 -3000 cm-1
• Tegangan C=C: 1600 cm-1
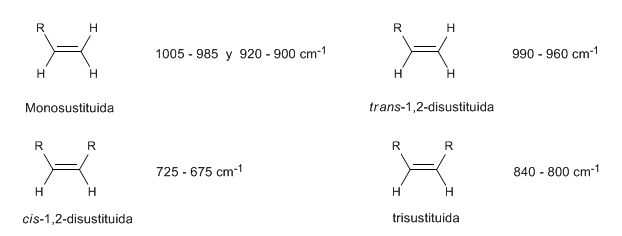
• Pembengkokan di luar bidang (oop) ikatan C=CH: 1000 - 650 cm-1. Jenis pita ini memungkinkan untuk mengetahui derajat substitusi alkena.
Spektrum 1-pentena
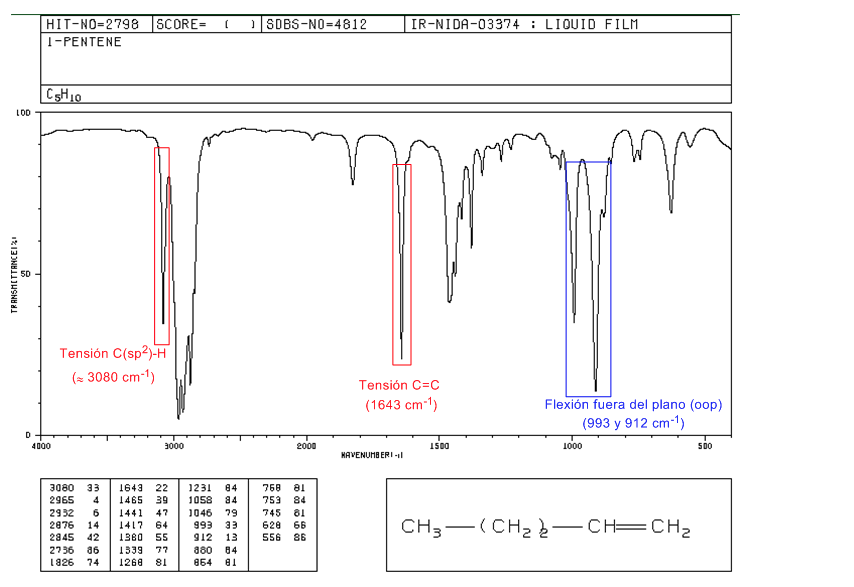
Pada alkena monosubstitusi, seperti 1-pentena, tekukan CH di luar bidang menghasilkan dua pita yang terletak di 1005-985 dan 920-900 c m − 1 .
Stereokimia dan spektroskopi IR alkena
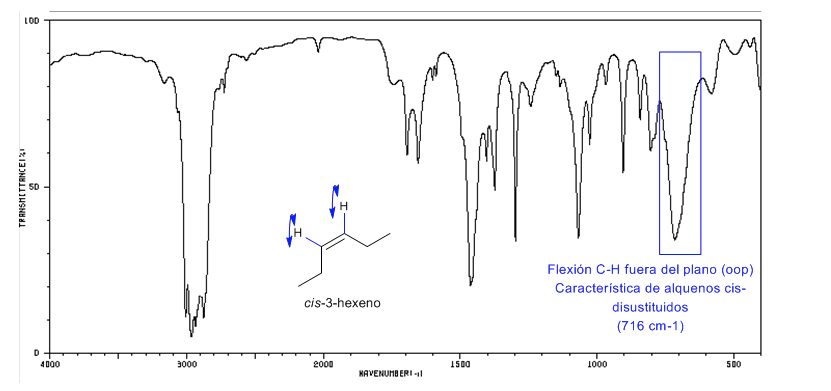
Alkena terdisubstitusi Cis menghadirkan pita tekuk CH di luar bidang yang memungkinkannya dibedakan. Band ini muncul antara 725-675 c m − 1
Spektrum Cis-3-heksena
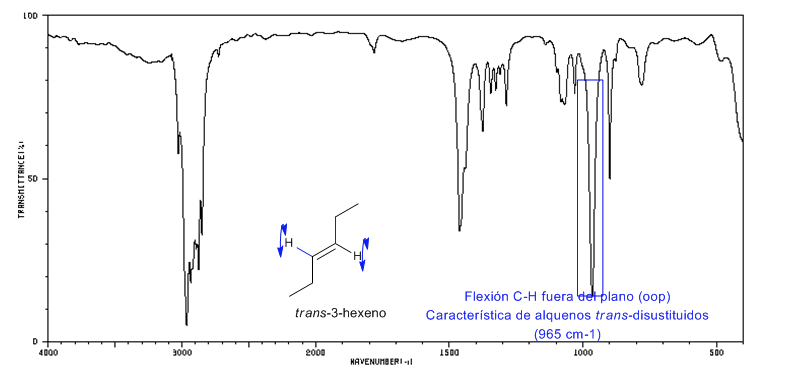
Spektrum Trans-3-heksena
Alkena trans-disubstitusi menghadirkan pita serapan yang kuat antara 980-965 c m − 1 yang memungkinkan identifikasinya. Perhatikan ketiadaan pita tegangan C=C pada 1600 c m − 1 karena kurangnya polaritas.
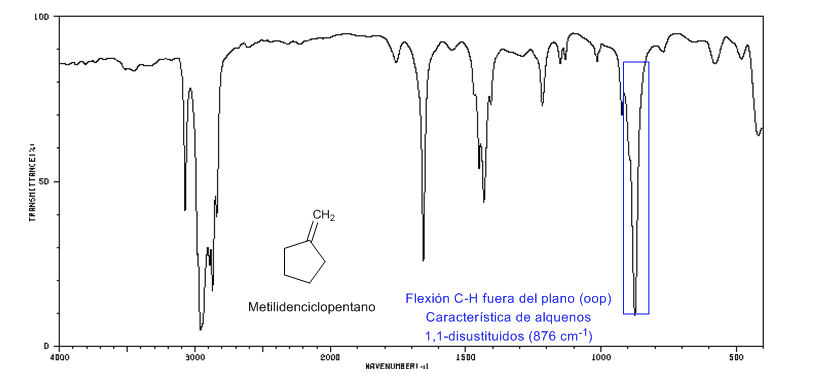
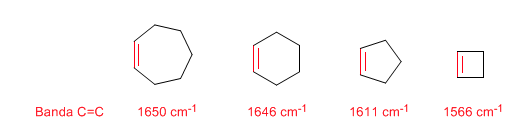
Strain Cincin: Ikatan C=C Endosiklik
Saat ukuran cincin mengecil, pita tegangan ikatan C=C bergerak ke arah jumlah gelombang yang lebih sedikit. Pengecualian siklopropena dikaitkan dengan kopling antara getaran tegangan ikatan C=C dan CC. Kopling ini tidak terjadi pada siklobutena karena ikatan C=C dan CC saling tegak lurus.
 Spektrum IR siklopenten
Spektrum IR siklopenten 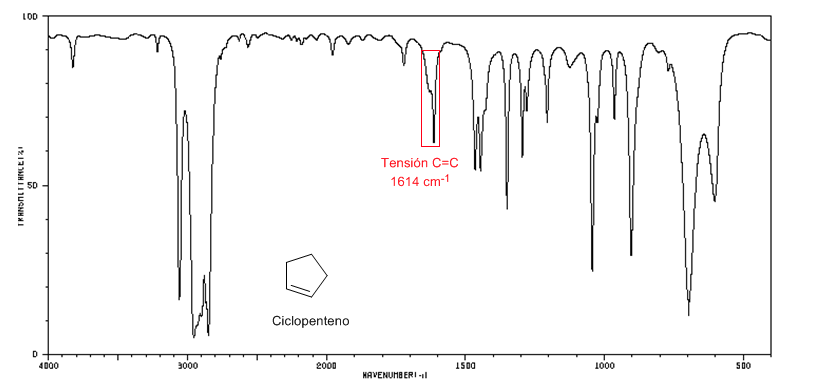
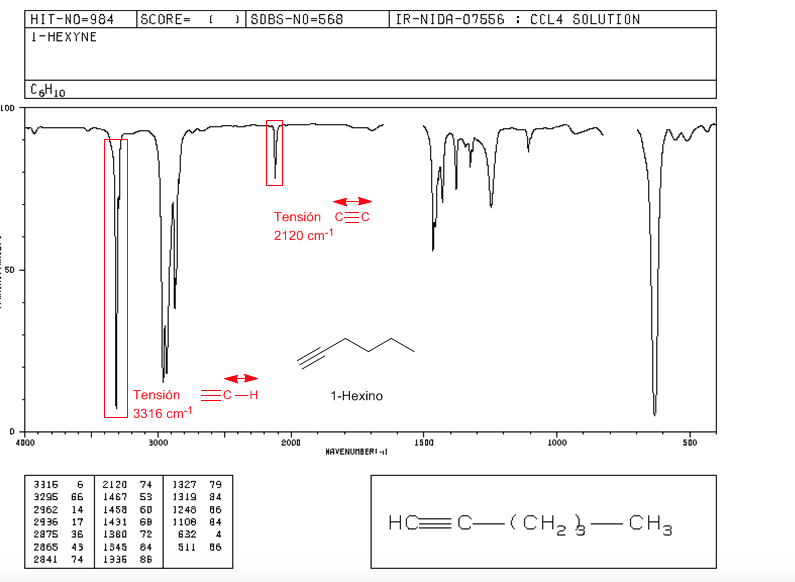
Tegangan ≡ C − H : 3300 c m − 1
Tegangan − C ≡ C − : 2150 c m − 1 . Alkuna simetris tidak menunjukkan pita ini, karena sangat lemah di pita internal. Konjugasi menurunkan nilainya sedikit.
spektrum 1-hexine
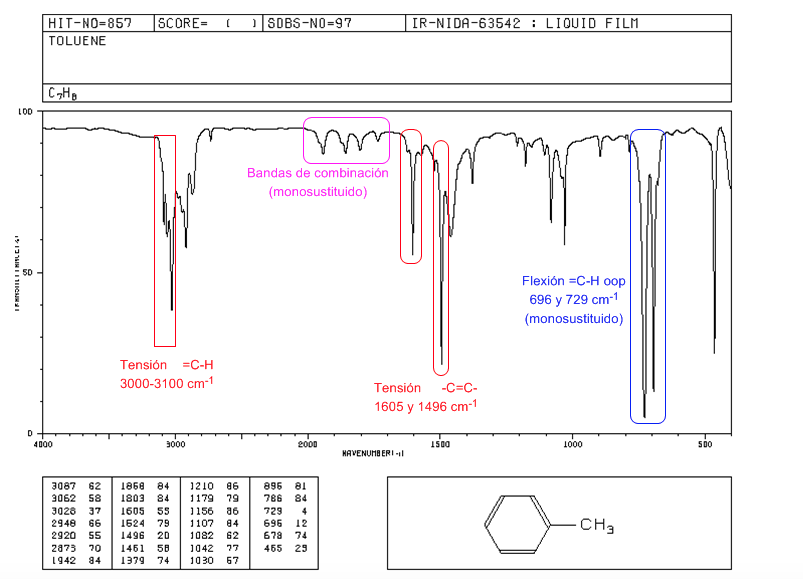
Spektrum IR aromatik
Tegangan = CH: 3100 cm-1
Tegangan -C=C- : 1600 dan 1475 cm-1
Fleksi = CH keluar bidang: 900-690 cm-1
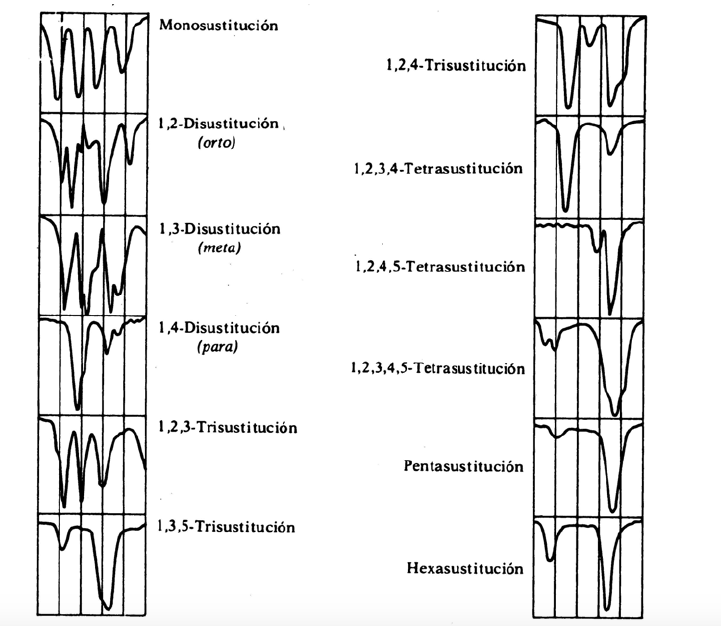
Getaran oop bersama dengan nada tambahan dan pita kombinasi yang muncul antara tahun 2000 dan 1667 cm-1 memungkinkan kita untuk mengetahui tingkat substitusi benzena.
band pengganti
![]()
Spektrum alkohol dan fenol
Ketegangan OH: Pita lebar dari 3500 hingga 3200 cm-1. Dengan tidak adanya ikatan hidrogen, tampak sebagai puncak tajam pada 3650-3600 cm-1.
Ketegangan CO: Pita antara 1250-1000 cm-1. Ini memungkinkan untuk membedakan antara alkohol primer (1050 cm-1), sekunder (1100 cm-1), tersier (1150 cm-1) dan fenol (1220 cm-1).
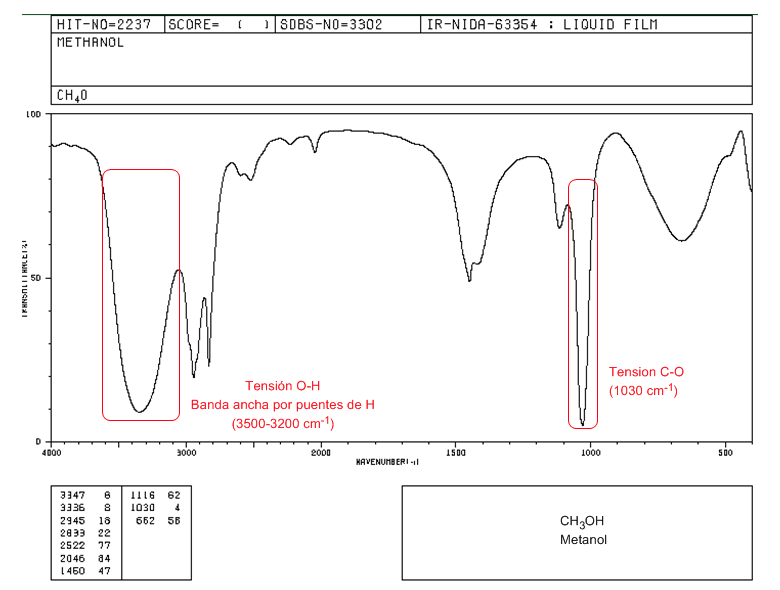
Spektrum IR alkohol primer (metanol)
Dalam spektrum metanol kita dapat mengamati pita tegangan OH yang sangat lebar, karena pembentukan ikatan hidrogen. Pita tegangan CO keluar pada bilangan gelombang rendah (1030) karena merupakan alkohol tanpa substituen.
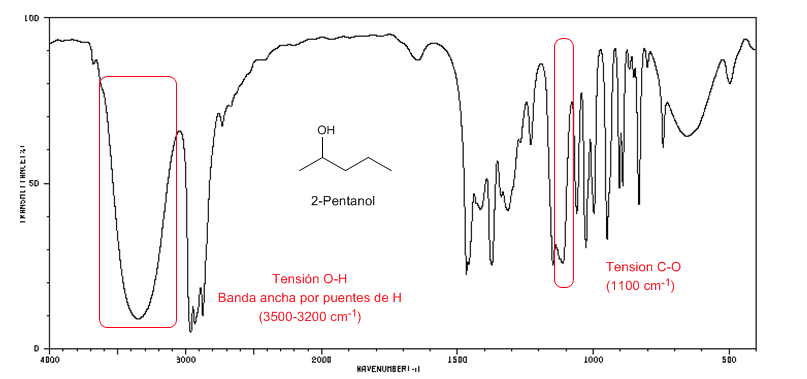
Spektrum IR alkohol sekunder (2-pentanol)
Amati perpindahan pita CO menuju jumlah gelombang yang lebih besar sehubungan dengan metanol.
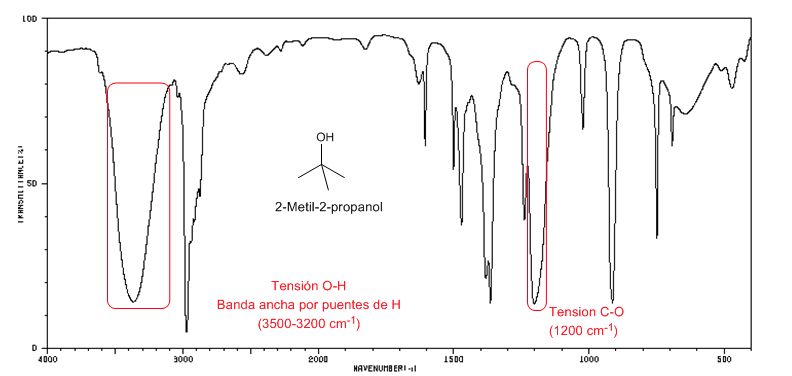
 Spektrum IR alkohol tersier ( 2-metil-2-propanol)
Spektrum IR alkohol tersier ( 2-metil-2-propanol)Alkohol tersier memiliki pita CO yang bergeser ke frekuensi yang lebih tinggi daripada alkohol primer dan sekunder.
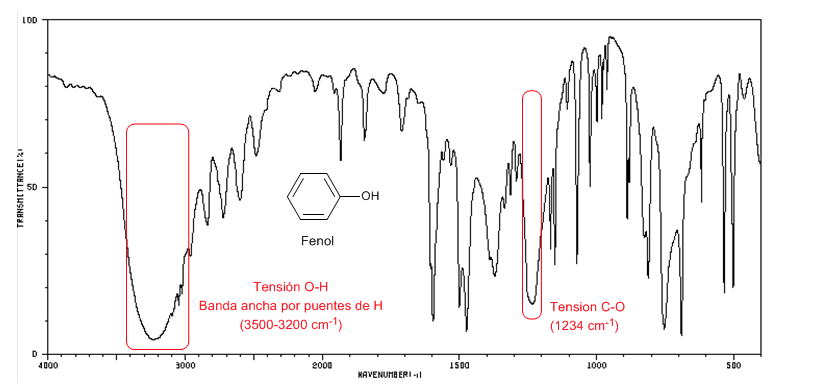
Fenol menghadirkan pita serapan CO di atas 1200 cm-1
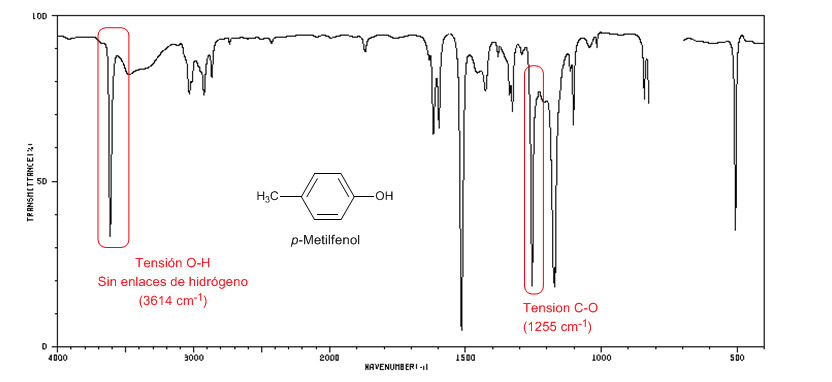
Spektrum berikut menunjukkan pita regangan OH tanpa adanya ikatan hidrogen.
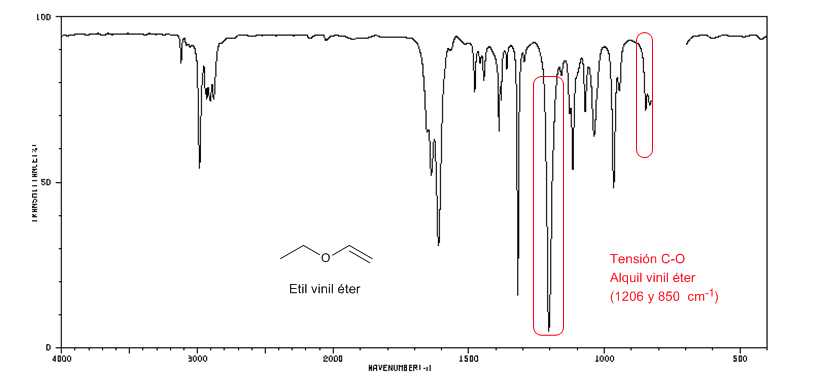
Alkil vinil eter (CH2=CH-OR) menghadirkan dua pita pada 1220 dan 850 cm-1. Yang terakhir sangat lemah.
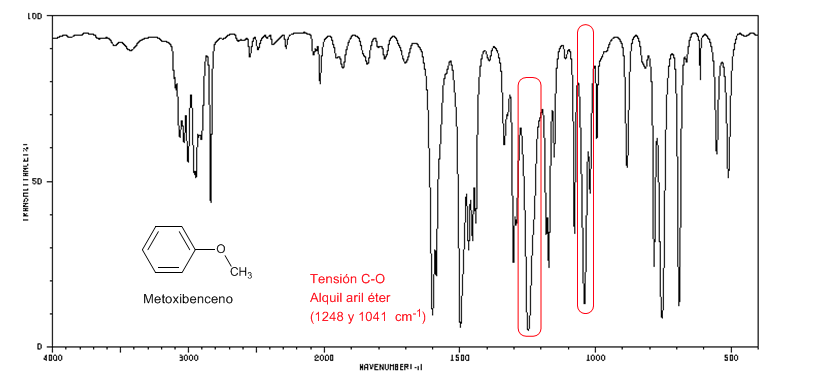
Aril alkil eter (Ar-OR) menghadirkan dua pita pada 1250 dan 1040 cm-1
Spektrum IR 1-metoksiheksana

Etil vinil eter menghadirkan dua pita pada 1220 dan 850 cm-1, yang terakhir sangat lemah.
Methoxybenzene menghadirkan dua pita pada 1250 dan 1040 cm-1
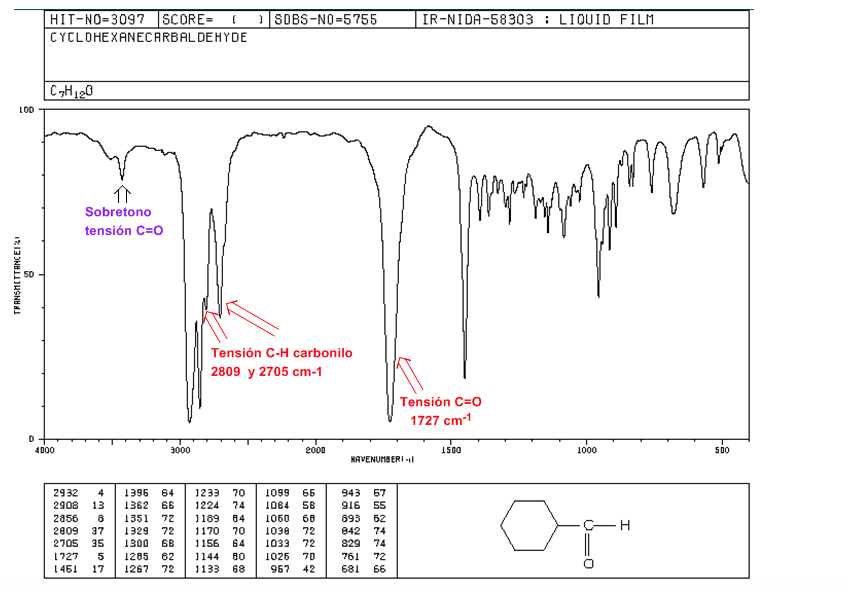
aldehida
Tegangan C=O: 1725 cm-1
Strain karbonil CH: dua pita lemah pada 2850 dan 2750 cm-1. Pita pada 2850 cenderung tumpang tindih dengan tegangan C(sp3)-H
C=O Voltage Overtone lebih dari 3500 cm-1.
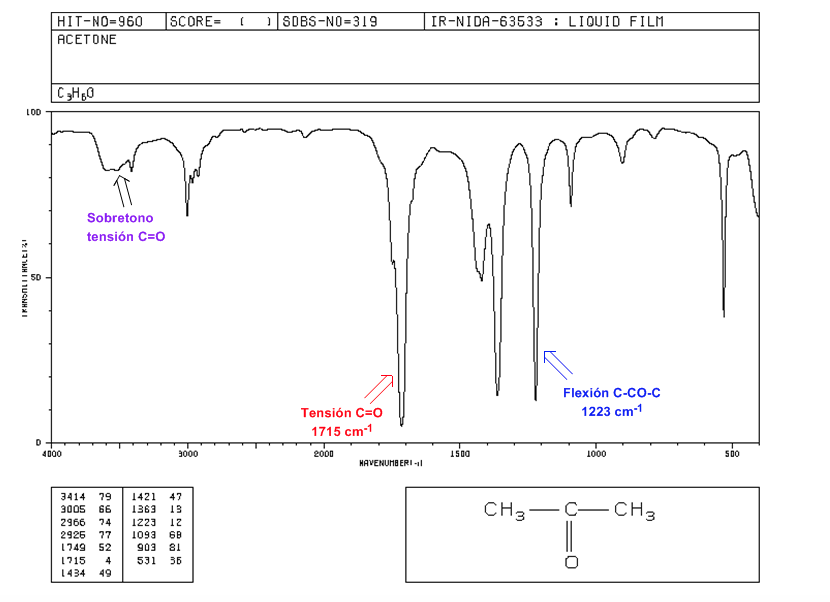
C=O tension: Intens band pada 1715 cm-1.
Fleksi C-CO-C: 1300 - 1100 cm-1.
C=O voltage overtone: dari 3500 hingga 3350 cm-1.
Pengaruh konjugasi pada pita Ketegangan C=O
Spektrum IR asam karboksilat dan turunannya
Asam karboksilat
Ketegangan OH: Dari 3400 hingga 2400 cm-1. Sangat luas karena pembentukan ikatan hidrogen.
Tegangan C=O: 1730-1700 cm-1
Ketegangan CO: 1320-1200 cm-1
COH Flexion (oop): Band berbentuk lonceng pada 900 cm-1
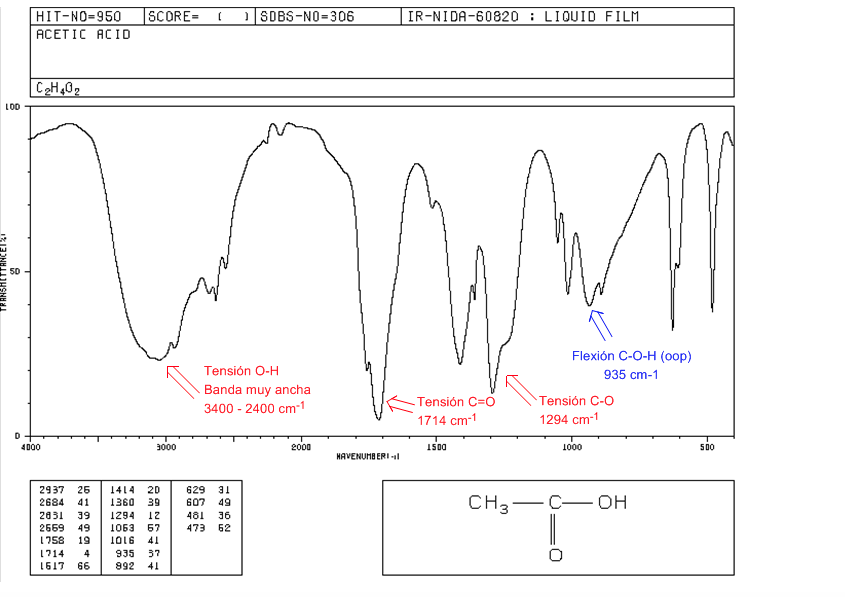
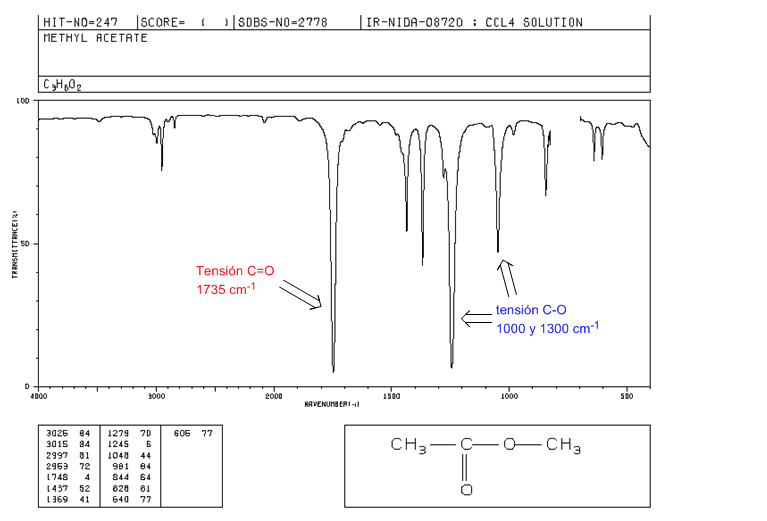
ester
Tegangan C=O pada 1735 cm-1. Jika ada ikatan rangkap terkonjugasi dengan karbonil, pita bergeser ke nilai yang lebih rendah. Ketika ikatan rangkap berada pada gugus alkoksi (-OR) dari ester, terjadi pergeseran ke nilai yang lebih tinggi.
Ketegangan CO: 2 pita pada 1300 dan 1000 cm-1. Menjadi lebih luas dan lebih intens yang diamati pada 1300.
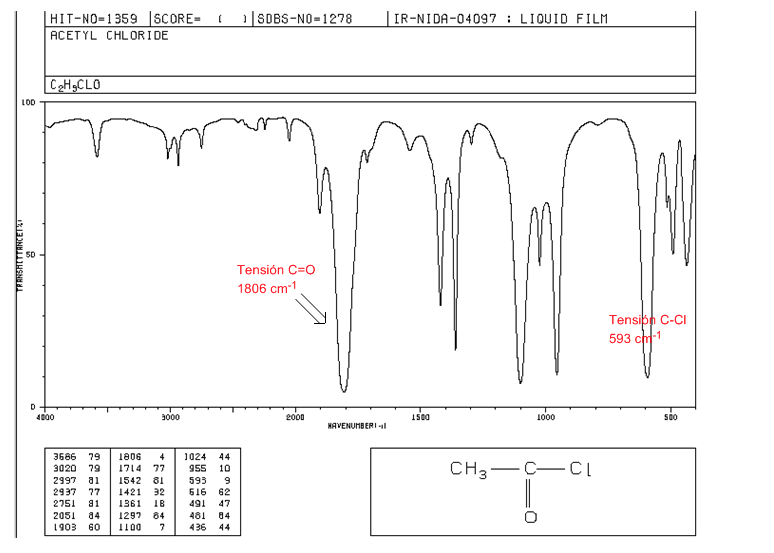
asam halida
Tegangan C=O: 1810 - 1775 cm-1
Ketegangan C-Cl: pita intens 730 - 550 cm-1
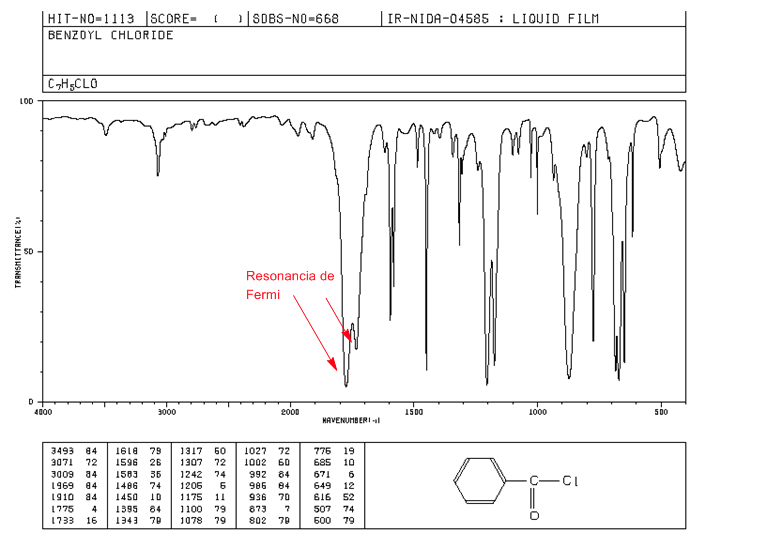
Resonansi Fermi
Overtones adalah transisi vibrasi dari keadaan dasar ke keadaan tereksitasi lebih tinggi. Frekuensi penyerapan menjadi frekuensi penyerapan fundamental. Resonansi Fermi , hasil dari penggabungan pita serapan fundamental dengan nada tambahan atau pita kombinasi.
Alkanoil halida aromatik memperlihatkan dua pita regangan C=O melalui resonansi Fermi.
 Nitril
Nitril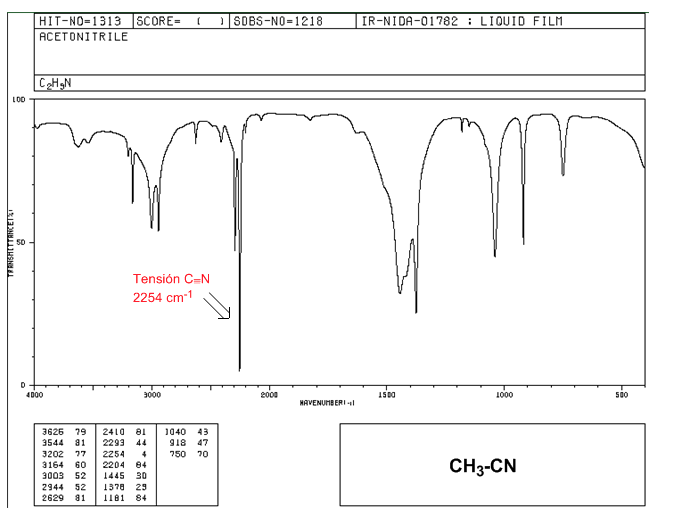
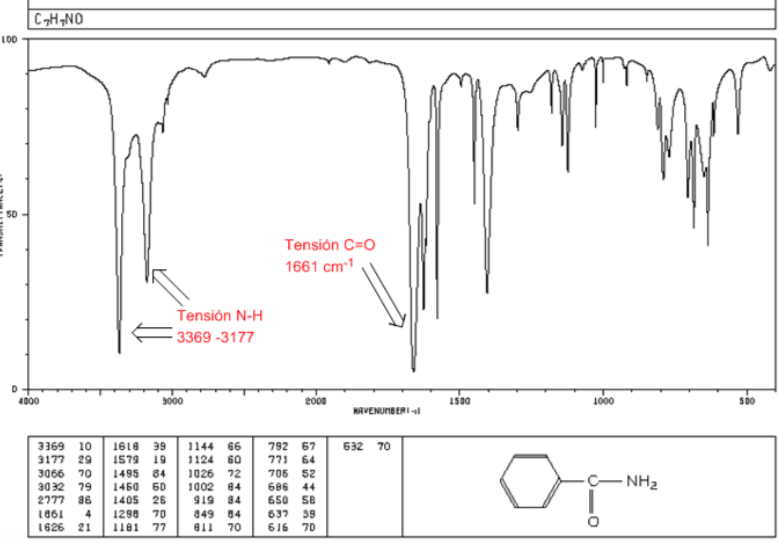
amida
Tegangan C=O: 1680 - 1630 cm-1
Ketegangan NH: Antara 3350 dan 3180 cm-1. Amida primer memiliki dua pita, sedangkan amida sekunder hanya memiliki satu pita.
Fleksi NH: 1640 - 1550 cm-1
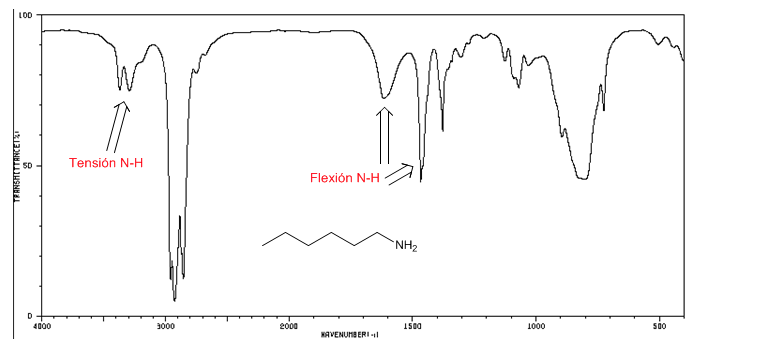
spektrum IR amina
Ketegangan NH: antara 3500 dan 3300 cm-1. Amina primer menghadirkan dua pita (simetris dan asimetris), yang sekunder hanya satu pita.
Pembengkokan NH: Amina primer dua pita pada 1640 dan 1560 cm-1. Sekunder pita pada 1500 cm-1
Spektrum IR 1-heksana-amina
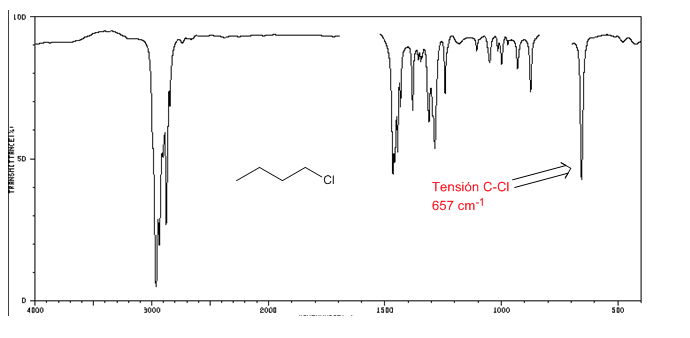
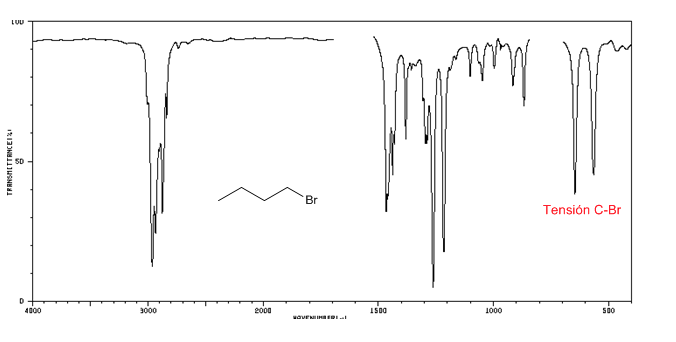
Spektrum IR alkil halida
Tegangan C-Cl : 785 - 540 cm-1
Ension C-Br : 650 - 510 cm-1
 Sumber yang disarankan untuk memperluas pencarian:
Sumber yang disarankan untuk memperluas pencarian:
1. Spektroskopi Emisi Aga Fano SA. (Diakses 10 September 2007). http://hiq.aga.com.co/International/Web/LG/CO/likelgspgco.nsf/DocByAlias/anal_icp .
2. Alonso, P. et al. kimia Cou..Ed. McGraw-Hill. 1990.
3. Álvarez Jiménez, MD dan Gómez del Río, Panduan Didaktik MI Kimia Analitik II. UNED. 1999.
4. Kedatangan Jimeno Siro; Burriel Barcelo Fernando; Hernandez Mendez Yesus; Lucena Hitung Felipe. Kimia Analitik Kualitatif. ISBN: 8497321405. ISBN. 2006.
5. Ayres, Gilbert H. Analisis Kimia Kuantitatif. Edisi Kastil, edisi ke-4 . ISBN: 8421902806. 1981.
6. Bermejo Barrera. M del Pilar. Kimia analitik umum, kuantitatif dan instrumental. Editorial Paraninfo. Edisi ke-7. ISBN: 8428318093. 1990.
7. Blanco, M., Cerdá, V. dan Sanz Medel, A., Spektroskopi Atom Analitik, Publikasi Universitas Otonomi Barcelona. 1990.
8. Brod. RW, Spektroskopi Kimia, New York 1952.
9. Burriel, MF, Lucena, CF. Kimia Analitik Kuantitatif. Edisi revolusioner. Havana.1978.
10. Burriel, F. Kimia Analitik Kualitatif. Editorial Paraninfo. ISBN: 8497321405. hlm. 1072. , 2003.