Sintesi di composti 1,3 e 1,5-dicarbonilici
Proporre un progetto di sintesi con il metodo della disconnessione (metodo synthon) da materiali semplici ed economici, per le seguenti molecole:
(Ricordiamo che se non è possibile proporre una disconnessione diretta, sarà necessario ricorrere alla strategia di funzionalizzare preventivamente il MOb, fino a raggiungere un modello di disconnessione applicabile)
SOLUZIONI AI PROBLEMI PROPOSTI
MOb 01 non ha alcun rapporto di ossigeno, un aspetto che in un certo senso è un vantaggio per il chimico. Ovvero, la strategia da utilizzare consentirà la ricerca di relazioni diossigenate nella molecola precursore (equivalente sintetico) con un certo grado di libertà, cioè si potrà postulare, in funzione della struttura del MOb, un intervallo di dicarbonil e/o relazioni idrossicarboniliche, nelle posizioni relative 1.2, 1.3 , 1.4, 1.5 e/o 1.6 o loro varianti, quali composti carbonilici α, β-insaturi.
In questa occasione si eserciterà la sintesi ricorrendo ai rapporti diossigenati 1.3 e/o 1.5. In questo modo, la molecola bersaglio ei precursori verranno convertiti in strutture disconnettibili secondo uno schema noto e prestabilito.
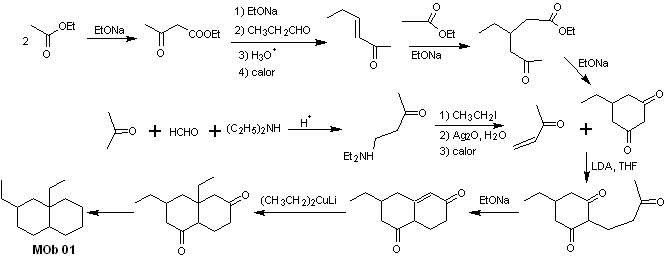
Soluzione MOb 01
Analisi retrosintetica : nella molecola in questione, si può iniziare eseguire un AGF, ponendo un gruppo C=O nella struttura della molecola precursore, in una posizione tale, che consenta successivamente di realizzare un altro AGF, con un doppio legame localizzato sul carbonio alfa e beta rispetto al carbonile, per procedere per scollegarlo.
L'insaturazione α, β, rispetto a C=O, va cercata come l'alchene più sostituito tra le alternative che potrebbero esistere. La presenza di un sostituente in posizione beta in C=O ci porta a pensare che potrebbe essersi aggiunto come nucleofilo a un composto carbonilico α, β insaturo, secondo la reazione di addizione coniugata di Michael. Sulla base di queste considerazioni, la seguente analisi retrosintetica può essere postulata per MOb 01:
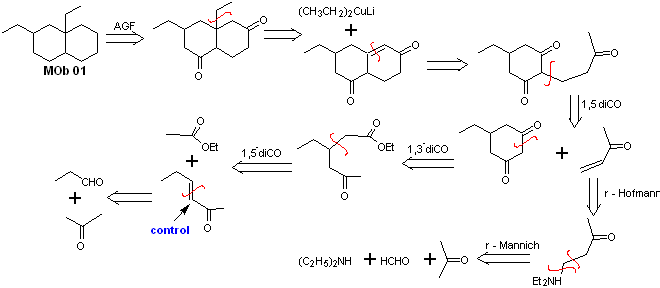
Sintesi di MOb 01 : la condensazione tra un'aldeide enolizzabile e un chetone produce normalmente prodotti di autocondensazione o di condensazione incrociata. Questo può essere evitato, ricorrendo alla strategia di esercitare il controllo, nel nucleofilo del chetone, come si può vedere nello schema allegato.
D'altra parte, quando è richiesto l'uso di vinil chetoni come substrato nella reazione di Michael, significherebbe l'uso di formaldeide. Purtroppo questa aldeide, essendo molto reattiva in un mezzo basico, tende a provocare reazioni di polimerizzazione, che abbassano drasticamente la resa della sintesi, per questo motivo la reazione di Mannich e l'eliminazione di Hofmann sono opportunamente combinate per vinilchetoni con rese elevate.
L'eliminazione di Hofmann potrebbe essere effettuata nello stesso terreno basico utilizzato per la reazione di Michael, quindi non è necessario isolare il vinil chetone.
Tuttavia, a causa dell'esperienza ancora limitata nella sintesi, sarà postulato l'uso di ossido d'argento in un mezzo acquoso per ottenere l'eliminazione dell'ammina e la formazione del vinil chetone.
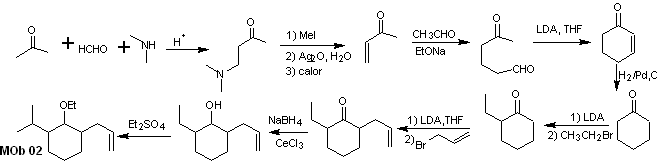
Soluzione MOb 02
Analisi retrosintetica : la presenza dei gruppi etilico e propenilico in posizione 2 rispetto al gruppo etereo guida la strategia di disconnessione funzionalizzando l'etere al chetone e successivamente occupandosi dell'alchilazione di un cicloesanone enolato. Le disconnessioni che si verificano nelle molecole precursori sono state spiegate nella soluzione di MOb 01.
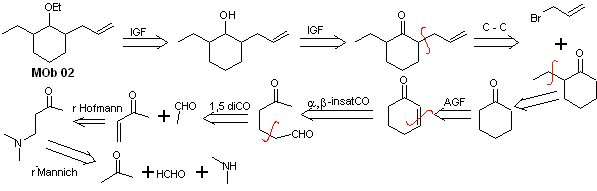
Sintesi. Per preparare l'enolato cinetico si utilizzerà LDA, perché questa base debolmente nucleofila ha un elevato ingombro sterico e astrae un protone dal carbonio meno ingombrato del chetone. Per garantire invece la riduzione del gruppo carbonilico ad alcool in presenza di un gruppo alchenico, si utilizzerà NaBH 4 in presenza di sali di Ce +3.
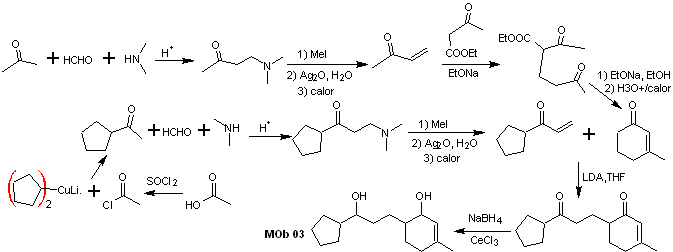
Soluzione MOb 03
Analisi retrosintetica : la posizione relativa in 1,5 dei gruppi idrossilici, consente di proporre una molecola precursore 1,5-diCO, che è disconnessa secondo questo modello dal legame che unisce il cicloesenone al resto della molecola, per formare due molecole precursori α,β-insaturi CO.
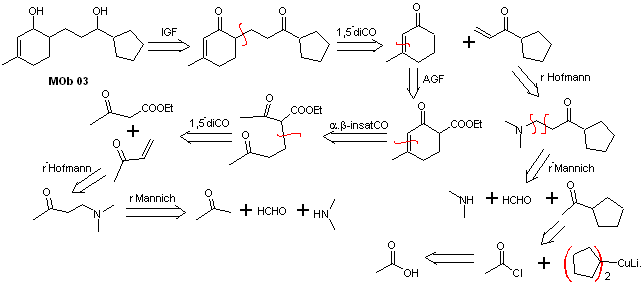
Sintesi. Occorre esercitare il controllo per la formazione dei vinilchetoni, per i quali si combina opportunamente la reazione di Mannich, seguita dall'eliminazione di Hofmann. Per la reazione di Michael si può usare come nucleofilo un chetoestere formato dalla condensazione di Claisen dell'estere di acetato di etile, evitando così l'autocondensazione del chetone.
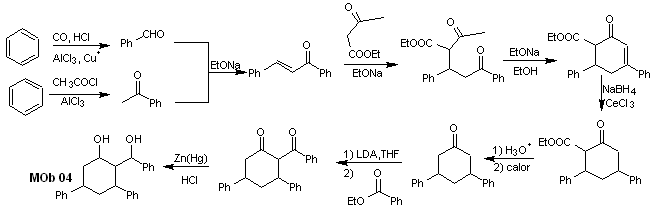
Soluzione MOb 04
Analisi retrosintetica : L'OH in posizione 1,3, può essere trasformato in 1,3-diCO, per procedere alla disconnessione secondo questo modello, che origina due equivalenti sintetici, di cui è sottoposto a funzionalizzazione aggiungendo –COOEt e un punto di insaturazione in 3,5-difenilcicloesanone. I precursori generati presentano modelli diossigenati per la loro rispettiva disconnessione.
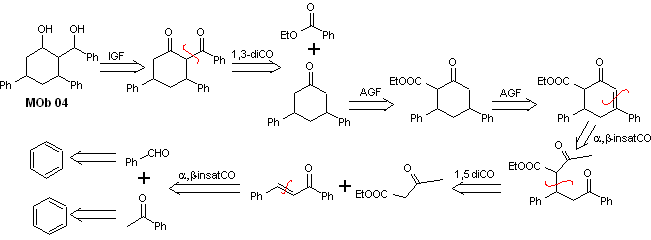 Sintesi. Parte dal benzene e controlla la reazione di Michael e le condensazioni.
Sintesi. Parte dal benzene e controlla la reazione di Michael e le condensazioni.
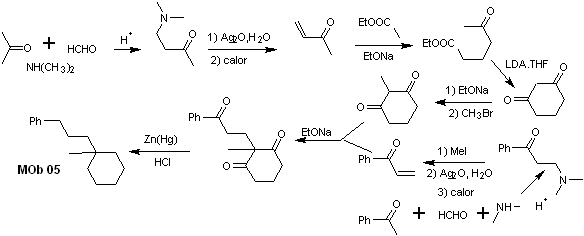
Soluzione MOb 05
Analisi retrosintetica : varie relazioni dicarboniliche possono essere considerate per la struttura della molecola precursore (equivalente sintetico) di MOb 05. Ad esempio, individuando il primo gruppo C=O attaccato al benzene, si può postulare una relazione 1,3-diCO, un α , β-insatCO o 1,5-diCO, che coinvolge cicloesano, con uno o due gruppi C=O. Si assume quest'ultima opzione, in quanto tra i gruppi C=O è presente un gruppo metilico aggiuntivo, di facile preparazione, proprio per l'effetto attivante dei due gruppi C=O, sul nucleofilo che si forma in mezzo di base. Sulla base di queste considerazioni, si può postulare il seguente schema di analisi retrosintetica per MOb 05.
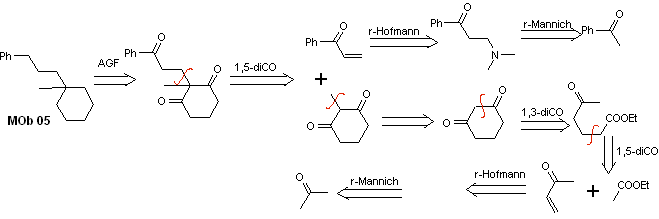 sintesi . Il vinil acetofenone viene preparato con buone rese attraverso la reazione di Mannich, seguita dall'eliminazione di Hofmann. D'altra parte il L'1,3-cicloesandione, viene preparato dalla condensazione di Claisen di un chetoestere nella posizione 1,5-diCO. Questo dichetone viene alchilato e si ottiene un H in un mezzo basico per formare il nucleofilo che agirà sul composto a,b-insatCO. I gruppi C=O della molecola tricarbonilica formata vengono ridotti a metile mediante riduzione di Clemmensen, ponendo un eccesso di amalgama di zinco in un mezzo acido.
sintesi . Il vinil acetofenone viene preparato con buone rese attraverso la reazione di Mannich, seguita dall'eliminazione di Hofmann. D'altra parte il L'1,3-cicloesandione, viene preparato dalla condensazione di Claisen di un chetoestere nella posizione 1,5-diCO. Questo dichetone viene alchilato e si ottiene un H in un mezzo basico per formare il nucleofilo che agirà sul composto a,b-insatCO. I gruppi C=O della molecola tricarbonilica formata vengono ridotti a metile mediante riduzione di Clemmensen, ponendo un eccesso di amalgama di zinco in un mezzo acido.
Soluzione MOb 06
Analisi retrosintetica. Viene disconnesso dal lattone, operazione che ci permette di intravedere un gruppo estere. La molecola precursore formata, può anche essere soggetta al composto carbonilico, che potrebbe essersi formato
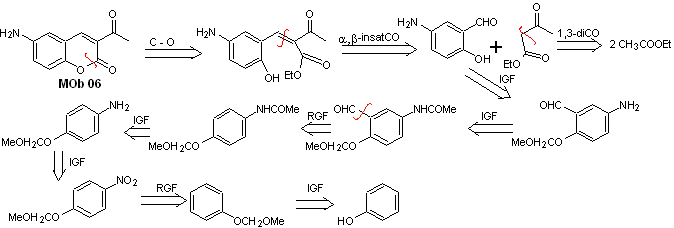
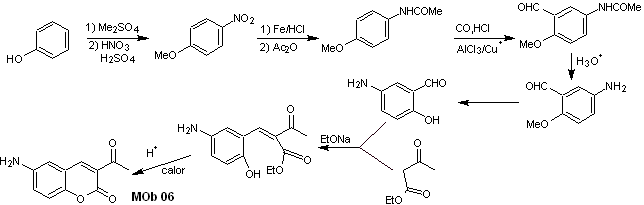
sintesi . Il gruppo alcolico è controllato proteggendolo con dimetile etere. Quindi il composto dicarbonilico deve essere sintetizzato
Soluzione MOb 07
Analisi retrosintetica. Ancora una volta, il processo di disconnessione inizia a causa della funzione lattone, le relazioni diossigenate che compaiono in abiti da ballo. Continua con la disconnessione 1,5-diCO e, quindi, arriva a fenolo e benzaldeide.
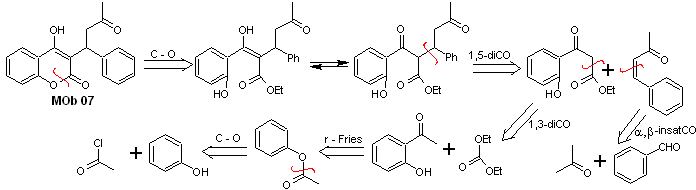
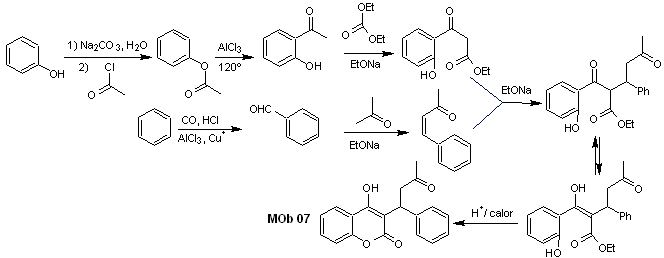
Sintesi. I materiali di partenza sono benzene e fenolo, l'acetilfenolo richiesto viene preparato secondo la reazione di riarrangiamento di Fries.
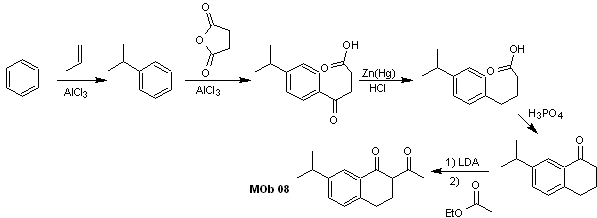
Soluzione MOb 08
Analisi retrosintetica. La presenza della relazione 1,3-diCO in MOb 08 invita alla disconnessione secondo questo modello di disconnessione, la molecola precursore generata, non è necessario funzionalizzarla a nessun modello diossigenato disconnettibile, ma piuttosto vengono utilizzate le reazioni di ciclizzazione dell'acilazione intramolecolare Friedel-Crafts.
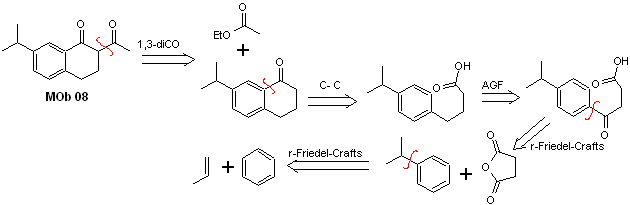
Sintesi. L'acilazione del cumene con l'anidride succinica sono le reazioni fondamentali che governano la sintesi.L'orientamento del gruppo isopropilico verso un secondo elettrofilo che si avvicina all'anello benzenico è ideale per formare il MOb.
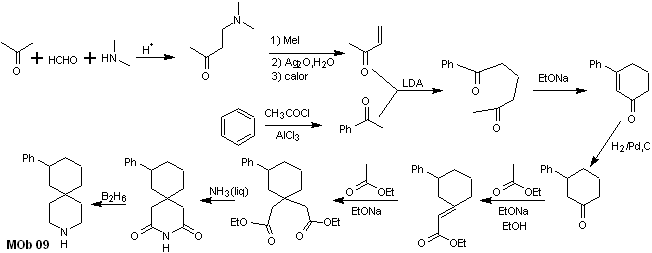
Soluzione MOb 09
Analisi retrosintetica : l'eterociclo azotato del MOb può essere funzionalizzato verso una struttura facilmente scollegabile come la funzione ammidica. Lo scheletro 1,5-diCO prodotto sarà disconnesso come previsto da questo modello, per arrivare a un α, β -insatCO, che, quando disconnesso, genera un equivalente sintetico di un cicloesanone fenil-sostituito. Quest'ultima struttura richiede l'uso appropriato di retro-Hofmann e retro-Mannich, per arrivare a materiali di partenza semplici ed economici.
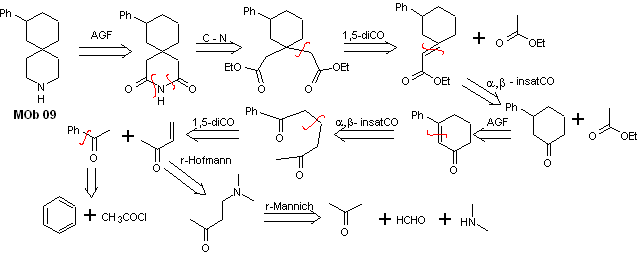
Sintesi. L'appropriata combinazione della reazione di Mannich e dell'eliminazione di Hofmann, seguita da reazioni di condensazione di tipo aldolico e di tipo Michael, dominano la strategia di sintesi di MOb 09,
Soluzione MOb 10
Analisi retrosintetica: la disconnessione dell'acetale ciclico porta a una molecola precursore, facilmente convertibile in un modello di disconnessione noto come α , β -insatCO. Le funzioni diossigenate che vengono successivamente generate sono disinseribili, secondo modelli noti.
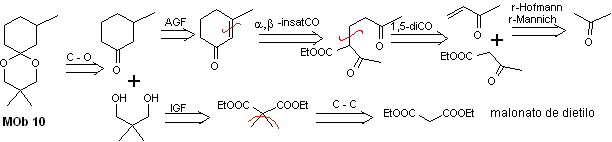
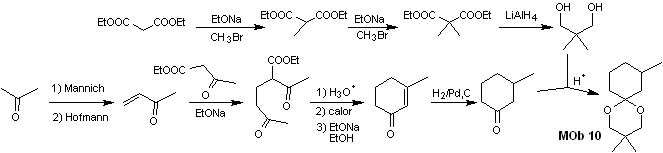
Sintesi. Il dietil malonato è il semplice materiale di partenza richiesto per la sintesi da un lato e l'acetoacetato di etile dall'altro. E dietilmalonato viene doppiamente metilato e per sua riduzione con eccesso di LiALH 4 si prepara il diolo. Che in un mezzo acido formerà l'acetale ciclico.
Soluzione Mob 11
Analisi retrosintetica. La funzionalizzazione più appropriata richiede l'aggiunta di due installazioni coniugate con il gruppo C=O, questa strategia sarà giustificata in seguito, quando sarà richiede un nucleofilo da aggiungere a un substrato di Michael.
Sarà invece necessario esercitare un controllo, in alcune condensazioni, per evitare l'autocondensazione dell'acetone, per il quale si utilizza l'estere acetoacetico, risultato della condensazione di Claisen dell'estere acetato di etile.
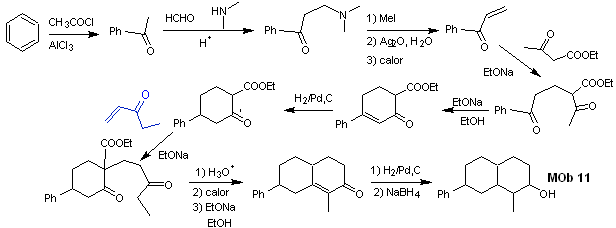
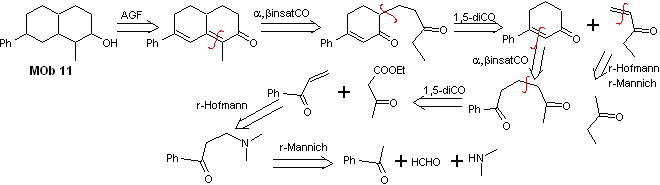 sintesi . Le reazioni iniziali della sintesi sono già state ampiamente spiegate nella soluzione dei MOb precedenti, si noti solo che la reazione di condensazione intramolecolare richiesta è la reazione di annelazione di Robinson.
sintesi . Le reazioni iniziali della sintesi sono già state ampiamente spiegate nella soluzione dei MOb precedenti, si noti solo che la reazione di condensazione intramolecolare richiesta è la reazione di annelazione di Robinson.
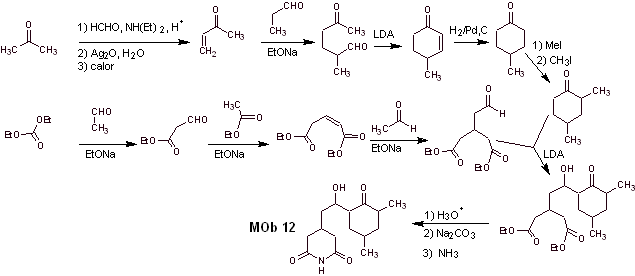
Soluzione Mob 12
Analisi retrosintetica : la disconnessione iniziale da parte dei legami ammidici genera una molecola precursore con vari rapporti di diossigeno, da cui viene selezionato 1,3-diO, per dividere la molecola in due frammenti importanti e con ciascuno di essi procedere alle disconnessioni necessarie per generare un progetto di sintesi convergente.
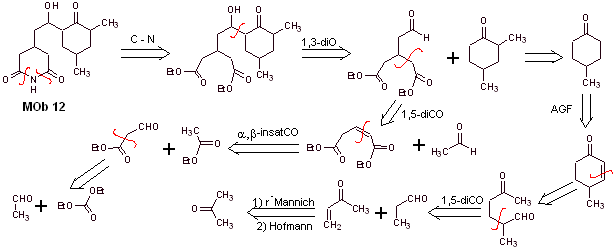
Sintesi. La corretta manipolazione di un'aldeide, generando più idrogeni acidi sul suo carbonio alfa, fa parte di una buona strategia di sintesi.
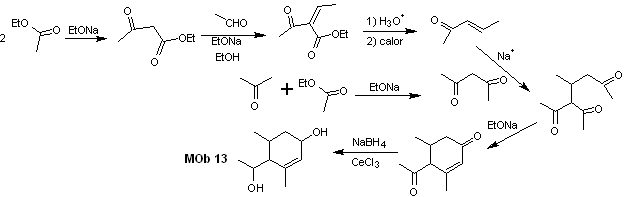
Soluzione MOb 13
Analisi retrosintetica. Il composto diossidrilico, MOb 13, viene trasformato in un composto dicarbonilico, per generare una molecola precursore, scomponibile secondo il modello α, β – insat.CO, per procedere con 1,5-diCO e altri di questa natura, fino ad arrivare a materie prime semplici.
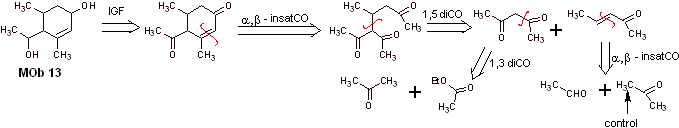 Sintesi. Il controllo deve essere esercitato in alcune reazioni di condensazione catalizzate da basi, per evitare le rispettive autocondensazioni, che genereranno basse rese di sintesi.
Sintesi. Il controllo deve essere esercitato in alcune reazioni di condensazione catalizzate da basi, per evitare le rispettive autocondensazioni, che genereranno basse rese di sintesi.
Soluzione MOb 14
Analisi retrosintetica . Questa molecola ha una somiglianza con MOb 11, quindi le disconnessioni effettuate avranno qualche somiglianza.
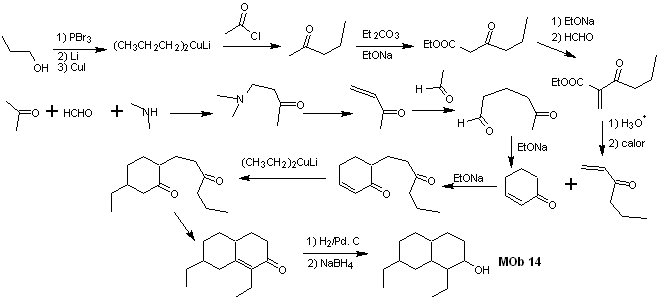
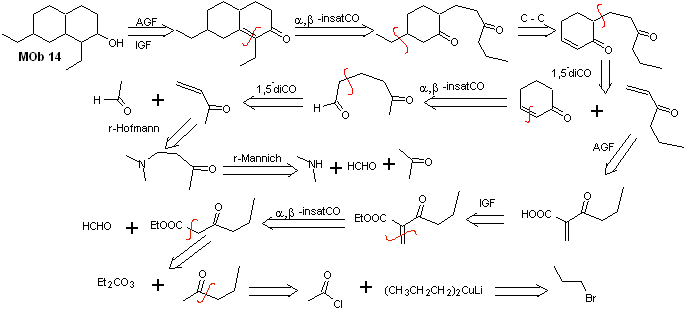 Sintesi
Sintesi
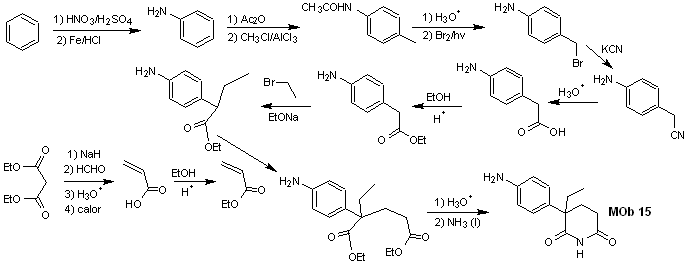
Soluzione MOb 15
Analisi retrosintetica. La disconnessione dei legami NO del lattame consente di generare una molecola precursore, che può essere disconnessa secondo i modelli già studiati e di esercitare un controllo per evitare reazioni di competizione.
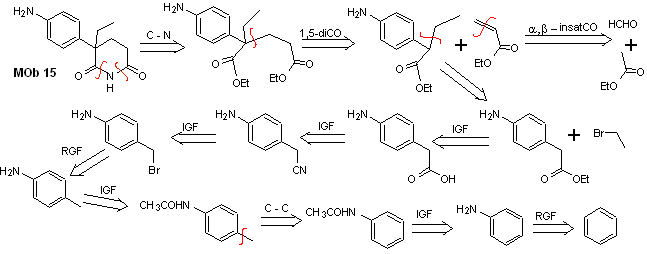 sintesi . Finora tutte le reazioni sono state ripetutamente spiegate, quindi in questo esercizio si darà per scontato che la chimica dei composti diossigenati richieda misure di controllo della sintesi per rettificarla alla luce dei risultati ottenuti.
sintesi . Finora tutte le reazioni sono state ripetutamente spiegate, quindi in questo esercizio si darà per scontato che la chimica dei composti diossigenati richieda misure di controllo della sintesi per rettificarla alla luce dei risultati ottenuti.