Synthese von 1,3- und 1,5-Dicarbonylverbindungen
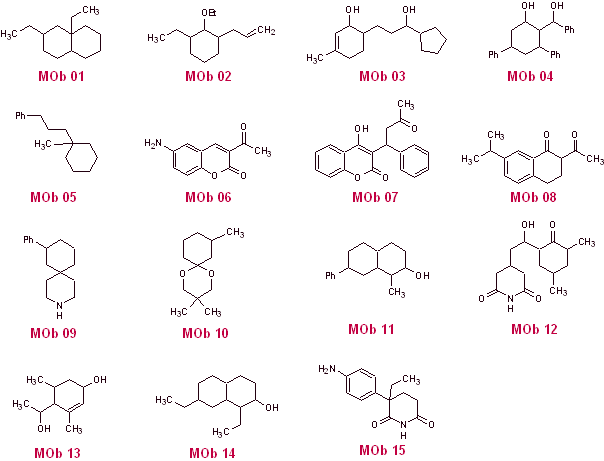
Schlagen Sie ein Synthesedesign nach der Trennungsmethode (Synthon-Methode) aus einfachen und erschwinglichen Materialien für die folgenden Moleküle vor:
(Denken Sie daran, dass, wenn es nicht möglich ist, eine direkte Trennung vorzuschlagen, auf die Strategie der vorherigen Funktionalisierung des MOb zurückgegriffen werden muss, bis ein anwendbares Trennungsmodell erreicht ist.)
LÖSUNGEN FÜR VORGESCHLAGENE PROBLEME
MOb 01 hat kein Sauerstoffverhältnis, ein Aspekt, der für den Chemiker in gewisser Weise von Vorteil ist. Das heißt, die zu verwendende Strategie ermöglicht die Suche nach dioxygenierten Beziehungen im Vorläufermolekül (synthetisches Äquivalent) mit einem gewissen Freiheitsgrad, d. h. es kann je nach Struktur des MOb eine Reihe von Dicarbonylgruppen postuliert werden und/oder Hydroxycarbonylbeziehungen, in relativen Positionen 1,2, 1,3 , 1,4, 1,5 und/oder 1,6 oder ihre Varianten, wie α,β-ungesättigte Carbonylverbindungen.
Bei dieser Gelegenheit wird die Synthese durchgeführt, wobei auf die dioxygenierten Verhältnisse von 1,3 und/oder 1,5 zurückgegriffen wird. Auf diese Weise werden das Zielmolekül und die Vorläufer gemäß einem bekannten und vorher festgelegten Muster in trennbare Strukturen umgewandelt.
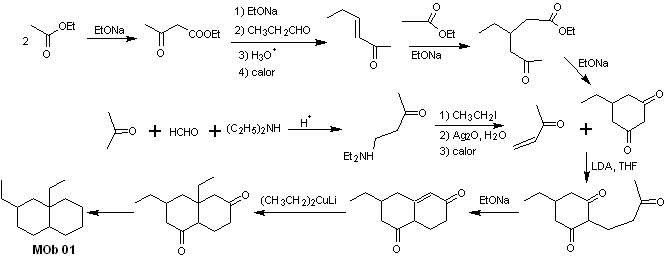
Lösung MOb 01
Retrosynthetische Analyse : Bei dem betreffenden Molekül kann man damit beginnen Führen Sie eine AGF durch, indem Sie eine C=O-Gruppe in der Struktur des Vorläufermoleküls an einer solchen Position platzieren, die es später ermöglicht, eine weitere AGF mit einer Doppelbindung am Alpha- und Beta-Kohlenstoff in Bezug auf das Carbonyl herzustellen, um fortzufahren um es zu trennen.
Die α,β-Unsättigung in Bezug auf C=O muss als das am stärksten substituierte Alken der möglichen Alternativen gesucht werden. Das Vorhandensein eines Substituenten in der Beta-Position an C=O lässt uns vermuten, dass er gemäß der konjugierten Michael-Additionsreaktion als Nucleophil an eine α,β-ungesättigte Carbonylverbindung addiert sein könnte. Aufgrund dieser Überlegungen kann für MOb 01 folgende retrosynthetische Analyse postuliert werden:
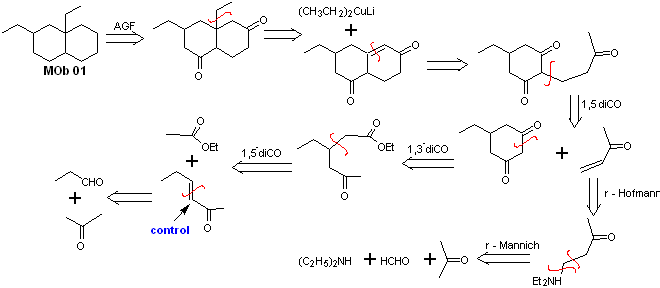
Synthese von MOb 01 : Die Kondensation zwischen einem enolisierbaren Aldehyd und Keton erzeugt normalerweise Selbstkondensations- oder Kreuzkondensationsprodukte. Dies kann vermieden werden, indem auf die Strategie der Kontrollausübung im Nucleophil des zurückgegriffen wird Keton, wie aus dem beigefügten Schema ersichtlich ist.
Wenn es andererseits erforderlich ist, Vinylketone als Substrat in der Michael-Reaktion zu verwenden, würde dies die Verwendung von Formaldehyd bedeuten. Leider neigt dieser in basischem Medium sehr reaktive Aldehyd zu Polymerisationsreaktionen, die die Ausbeute der Synthese drastisch mindern, weshalb für Vinylketone mit hohen Ausbeuten die Mannich-Reaktion und die Hofmann-Eliminierung adäquat kombiniert werden.
Die Hofmann-Eliminierung könnte im gleichen basischen Medium durchgeführt werden, das für die Michael-Reaktion verwendet wird, so dass es nicht notwendig ist, das Vinylketon zu isolieren.
Aufgrund der noch begrenzten Erfahrung in der Synthese wird jedoch die Verwendung von Silberoxid in einem wässrigen Medium postuliert, um die Eliminierung des Amins und die Bildung des Vinylketons zu erreichen.
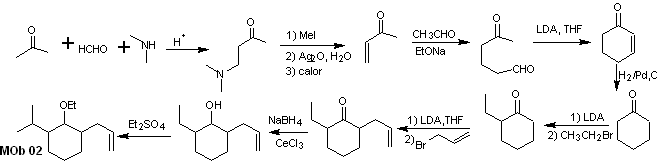
Lösung MOb 02
Retrosynthetische Analyse : Das Vorliegen der Ethyl- und Propenylgruppen in Position 2 zur Ethergruppe leitet die Trennungsstrategie durch Funktionalisierung des Ethers zum Keton und anschließende Alkylierung eines Cyclohexanonenolats. Die in den Vorläufermolekülen auftretenden Trennungen wurden in der Lösung von MOb 01 erklärt.
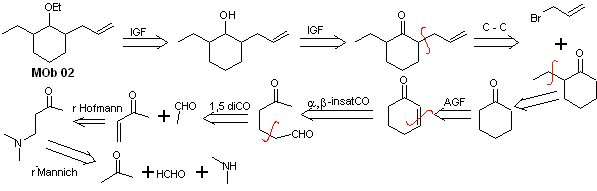
Synthese. Zur Herstellung des kinetischen Enolats wird LDA verwendet, da diese schwach nukleophile Base eine hohe sterische Hinderung aufweist und ein Proton vom weniger gehinderten Kohlenstoff des Ketons abstrahiert. Um andererseits die Reduktion der Carbonylgruppe zu Alkohol in Gegenwart einer Alkengruppe zu gewährleisten, wird NaBH 4 in Gegenwart von Ce +3 -Salzen verwendet.
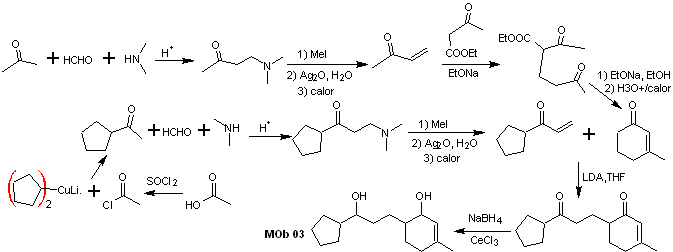
Lösung MOb 03
Retrosynthetische Analyse : Die relative Position in 1,5 der Hydroxylgruppen erlaubt es, ein 1,5-diCO-Vorläufermolekül vorzuschlagen, das gemäß diesem Modell durch die Bindung getrennt ist, die das Cyclohexenon mit dem Rest des Moleküls verbindet, um zwei zu bilden Moleküle Vorstufen α,β-ungesättigtes CO.
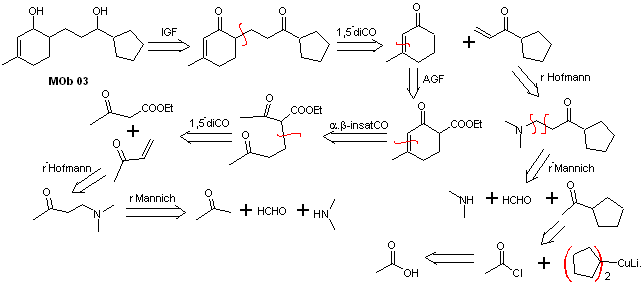
Synthese. Es ist notwendig, die Bildung von Vinylketonen zu kontrollieren, wozu die Mannich-Reaktion mit anschließender Hofmann-Eliminierung geeignet kombiniert wird. Für die Michael-Reaktion kann ein durch Claisen-Kondensation des Ethylacetatesters gebildeter Ketoester als Nucleophil verwendet werden, wodurch die Selbstkondensation des Ketons vermieden wird.
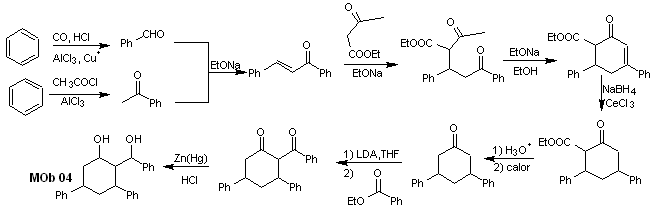
Lösung MOb 04
Retrosynthetische Analyse : Das OH in Position 1,3 kann in 1,3-diCO umgewandelt werden, um mit der Trennung gemäß diesem Modell fortzufahren, wodurch zwei synthetische Äquivalente entstehen, von denen es einer Funktionalisierung durch Zugabe von –COOEt unterzogen wird und ein Ungesättigtheitspunkt in 3,5-Diphenylcyclohexanon. Die erzeugten Vorläufer stellen dioxygenierte Modelle für ihre jeweilige Trennung dar.
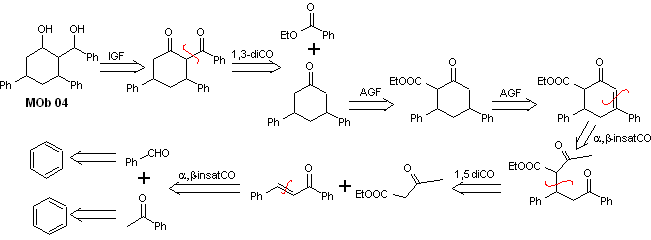 Synthese. Es geht von Benzol aus und steuert die Michael-Reaktion und Kondensationen.
Synthese. Es geht von Benzol aus und steuert die Michael-Reaktion und Kondensationen.
Lösung MOb 05
Retrosynthetische Analyse : Für die Struktur des Vorläufermoleküls (synthetisches Äquivalent) von MOb 05 können verschiedene Dicarbonylbeziehungen in Betracht gezogen werden. Beispielsweise kann durch Lokalisierung der ersten an Benzol gebundenen C=O-Gruppe eine 1,3-diCO-Beziehung postuliert werden, ein α,β-insatCO oder 1,5-diCO, das Cyclohexan beinhaltet, mit einer oder zwei C=O-Gruppen. Diese letzte Option wird angenommen, da sich zwischen den C=O-Gruppen eine zusätzliche Methylgruppe befindet, die gerade wegen der aktivierenden Wirkung der beiden C=O-Gruppen auf das entstehende Nucleophil leicht herstellbar ist Grundmedium. Basierend auf diesen Überlegungen kann das folgende retrosynthetische Analyseschema für MOb 05 postuliert werden.
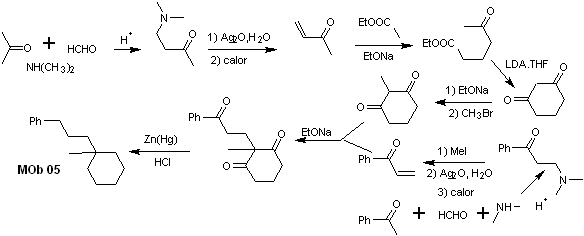
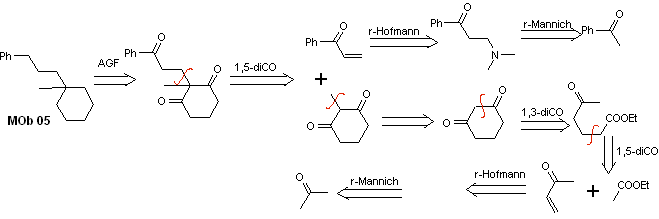 Synthese . Vinylacetophenon wird in guten Ausbeuten durch die Mannich-Reaktion mit anschließender Hofmann-Eliminierung hergestellt. Andererseits die 1,3-Cyclohexandion wird aus der Claisen-Kondensation eines Ketoesters in der 1,5-diCO-Position hergestellt. Dieses Diketon wird alkyliert und ein H wird in einem basischen Medium erhalten, um das Nucleophil zu bilden, das auf die a,b-insatCO-Verbindung wirkt. Die C=O-Gruppen des gebildeten Tricarbonylmoleküls werden durch Clemmensen-Reduktion zu Methyl reduziert, wobei ein Überschuss an Zinkamalgam in ein saures Medium gegeben wird.
Synthese . Vinylacetophenon wird in guten Ausbeuten durch die Mannich-Reaktion mit anschließender Hofmann-Eliminierung hergestellt. Andererseits die 1,3-Cyclohexandion wird aus der Claisen-Kondensation eines Ketoesters in der 1,5-diCO-Position hergestellt. Dieses Diketon wird alkyliert und ein H wird in einem basischen Medium erhalten, um das Nucleophil zu bilden, das auf die a,b-insatCO-Verbindung wirkt. Die C=O-Gruppen des gebildeten Tricarbonylmoleküls werden durch Clemmensen-Reduktion zu Methyl reduziert, wobei ein Überschuss an Zinkamalgam in ein saures Medium gegeben wird.
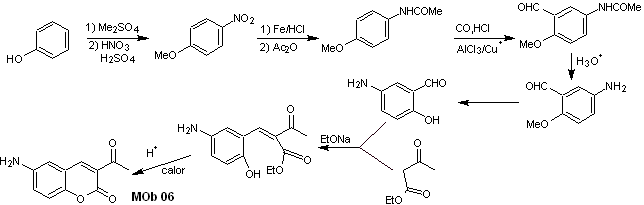
Lösung MOb 06
Retrosynthetische Analyse. Es wird durch das Lacton getrennt, eine Operation, die es uns ermöglicht, einen Blick auf eine Estergruppe zu werfen. Das gebildete Vorläufermolekül kann auch der möglicherweise gebildeten Carbonylverbindung ausgesetzt werden
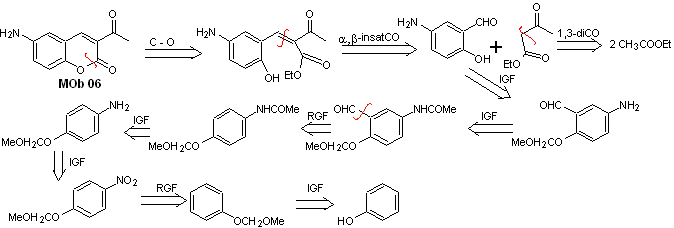
Synthese . Die Alkoholgruppe wird kontrolliert, indem sie mit Dimethyl geschützt wird Äther. Dann muss die Dicarbonylverbindung synthetisiert werden
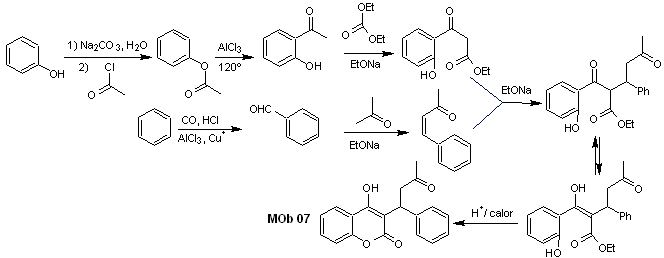
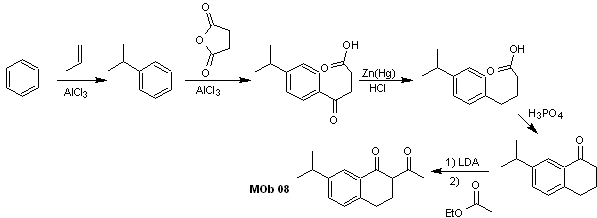
Lösung MOb 07
Retrosynthetische Analyse. Wiederum beginnt der Trennungsprozess aufgrund der Lactonfunktion, der dioxygenierten Beziehungen, die darin auftreten Tanzkleidung. Es geht weiter mit der 1,5-diCO-Spaltung und gelangt so zu Phenol und Benzaldehyd.
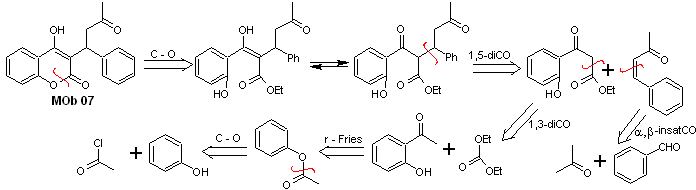
Synthese. Ausgangsstoffe sind Benzol und Phenol, das benötigte Acetylphenol wird nach der Fries-Umlagerungsreaktion hergestellt.
Lösung MOb 08
Retrosynthetische Analyse. Das Vorhandensein der 1,3-diCO-Beziehung in MOb 08 lädt gemäß diesem Trennungsmodell zur Trennung ein, das erzeugte Vorläufermolekül muss nicht zu einem trennbaren dioxygenierten Modell funktionalisiert werden, sondern die Cyclisierungsreaktionen der Acylierung werden intramolekular genutzt Friedel-Crafts.
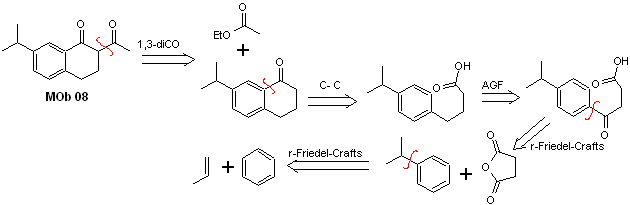
Synthese. Die Acylierung von Cumol mit Bernsteinsäureanhydrid stellt die grundlegende Reaktion der Synthese dar. Die Orientierung der Isopropylgruppe zu einem zweiten Elektrophil, das sich dem Benzolring nähert, ist ideal, um das MOb zu bilden.
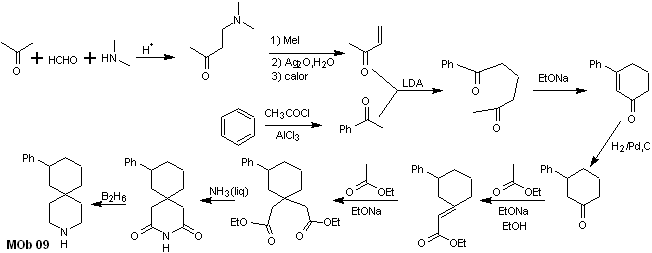
Lösung MOb 09
Retrosynthetische Analyse : Der stickstoffhaltige Heterocyclus des MOb kann zu einer leicht trennbaren Struktur wie der Amidfunktion funktionalisiert werden. Das erzeugte 1,5-diCO-Gerüst wird, wie von diesem Modell vorhergesagt, getrennt, um zu einem α,β-insatCO zu gelangen, das, wenn es getrennt wird, ein synthetisches Äquivalent eines Phenyl-substituierten Cyclohexanons erzeugt. Diese letzte Struktur erfordert die richtige Verwendung von Retro-Hofmann und Retro-Mannich, um zu einfachen und erschwinglichen Ausgangsmaterialien zu gelangen.
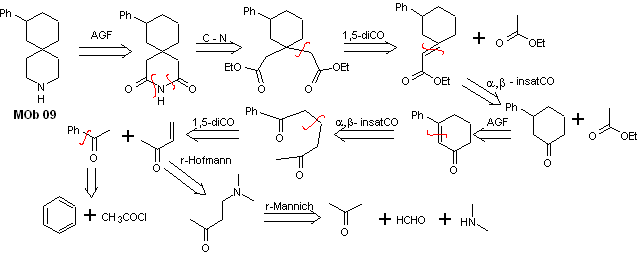
Synthese. Die geeignete Kombination aus Mannich-Reaktion und Hofmann-Eliminierung, gefolgt von Kondensationsreaktionen vom Aldol- und Michael-Typ, dominiert die Synthesestrategie von MOb 09,
MOb 10-Lösung
Retrosynthetische Analyse: Die Trennung des cyclischen Acetals führt zu einem Vorläufermolekül, das sich leicht in ein Trennungsmodell umwandeln lässt, das als α ,β -insatCO bekannt ist. Die sauerstofffreien Funktionen, die anschließend erzeugt werden, sind durch bekannte Modelle trennbar.
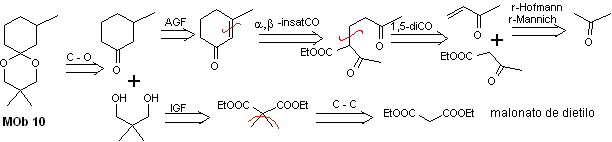
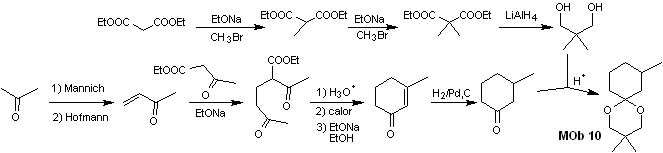
Synthese. Malonsäurediethylester ist einerseits der für die Synthese benötigte einfache Ausgangsstoff, andererseits Acetessigsäureethylester. E Diethylmalonat wird zweifach methyliert und durch dessen Reduktion mit überschüssigem LiALH 4 wird das Diol hergestellt. Welches in einem sauren Medium das cyclische Acetal bildet.
Lösung Mob 11
Retrosynthetische Analyse. Die am besten geeignete Funktionalisierung erfordert die Hinzufügung von zwei Installationen, die mit der C=O-Gruppe konjugiert sind, diese Strategie wird später gerechtfertigt, wenn dies der Fall ist erfordert ein Nucleophil, um an ein Michael-Substrat zu addieren.
Andererseits wird es notwendig sein, bei einigen Kondensationen eine Kontrolle auszuüben, um die Selbstkondensation von Aceton, für die der Acetessigester verwendet wird, das Ergebnis der Claisen-Kondensation des Ethylacetatesters, zu vermeiden.
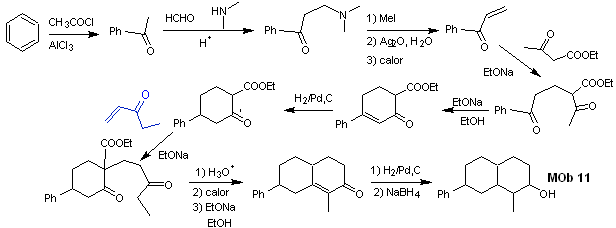
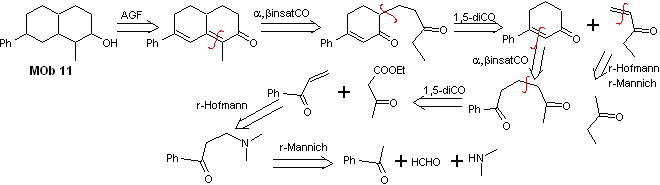 Synthese . Die Anfangsreaktionen der Synthese wurden bereits in der Lösung der vorangegangenen MObs ausführlich erklärt, es sei nur darauf hingewiesen, dass die erforderliche intramolekulare Kondensationsreaktion die Robinson-Anellierungsreaktion ist.
Synthese . Die Anfangsreaktionen der Synthese wurden bereits in der Lösung der vorangegangenen MObs ausführlich erklärt, es sei nur darauf hingewiesen, dass die erforderliche intramolekulare Kondensationsreaktion die Robinson-Anellierungsreaktion ist.
Mob 12-Lösung
Retrosynthetische Analyse : Die anfängliche Trennung durch die Amidbindungen erzeugt ein Vorläufermolekül mit verschiedenen Disauerstoffverhältnissen, aus denen 1,3-diO ausgewählt wird, um das Molekül in zwei wichtige Fragmente zu teilen und mit jedem von ihnen zu den notwendigen Trennungen zu gelangen, um a zu erzeugen konvergentes Synthesedesign.
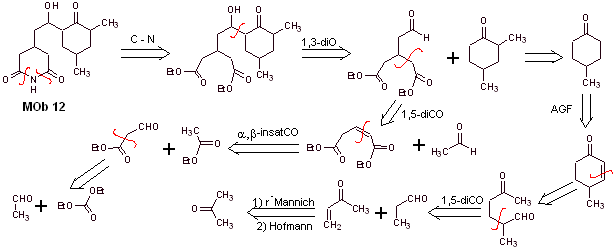
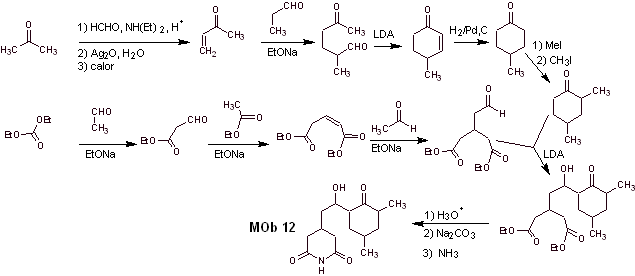
Synthese. Der richtige Umgang mit einem Aldehyd, der mehr saure Wasserstoffatome an seinem Alpha-Kohlenstoff erzeugt, ist Teil einer guten Synthesestrategie.
Lösung MOb 13
Retrosynthetische Analyse. Die Dihydroxyverbindung, MOb 13, wird in eine Dicarbonylverbindung umgewandelt, um ein Vorläufermolekül zu erzeugen, das gemäß dem α, β – insat.CO-Modell trennbar ist, um mit 1,5-diCO und anderen dieser Art fortzufahren, bis man ankommt einfache Ausgangsstoffe.
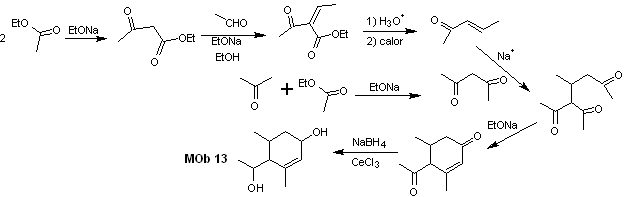
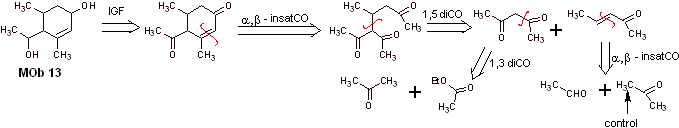 Synthese. Bei einigen basenkatalysierten Kondensationsreaktionen muss eine Kontrolle ausgeübt werden, um die jeweiligen Selbstkondensationen zu vermeiden, die zu geringen Syntheseausbeuten führen.
Synthese. Bei einigen basenkatalysierten Kondensationsreaktionen muss eine Kontrolle ausgeübt werden, um die jeweiligen Selbstkondensationen zu vermeiden, die zu geringen Syntheseausbeuten führen.
Lösung MOb 14
Retrosynthetische Analyse . Dieses Molekül hat eine Ähnlichkeit mit MOb 11, daher werden die hergestellten Unterbrechungen eine gewisse Ähnlichkeit aufweisen.
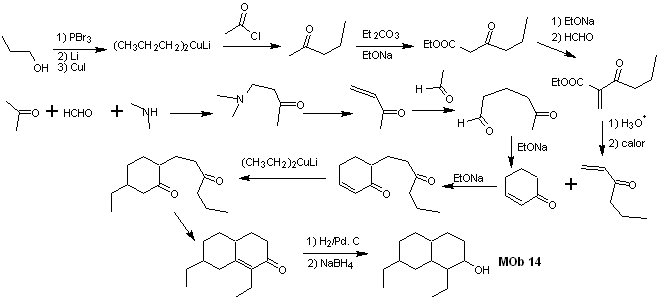
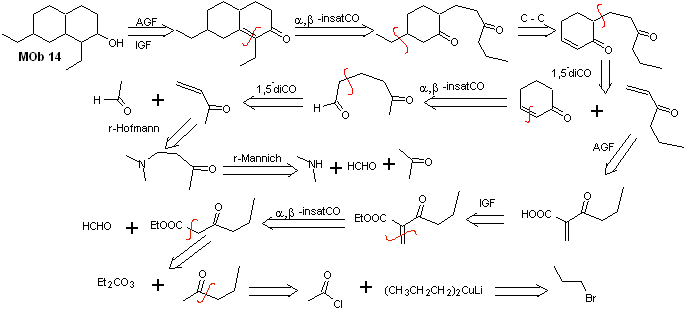 Synthese
Synthese
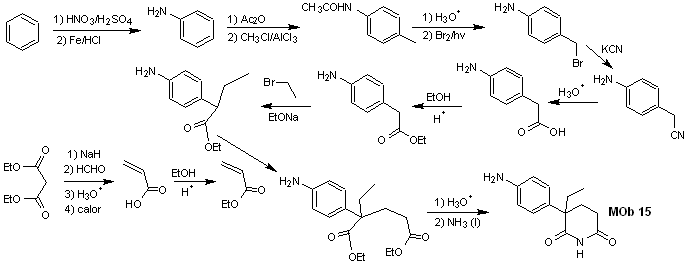
Lösung MOb 15
Retrosynthetische Analyse. Die Trennung der NO-Bindungen des Lactams ermöglicht es, ein Vorläufermolekül zu erzeugen, das gemäß den bereits untersuchten Modellen getrennt werden kann, und eine Kontrolle auszuüben, um Konkurrenzreaktionen zu vermeiden.
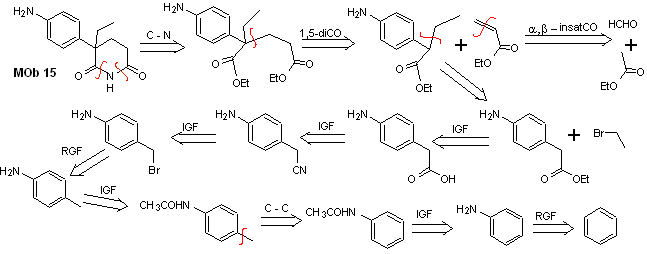 Synthese . Bisher wurden alle Reaktionen wiederholt erklärt, so dass in dieser Übung davon ausgegangen wird, dass die Chemie der dioxygenierten Verbindungen angesichts der erhaltenen Ergebnisse Synthesekontrollmaßnahmen erfordert, um sie zu korrigieren.
Synthese . Bisher wurden alle Reaktionen wiederholt erklärt, so dass in dieser Übung davon ausgegangen wird, dass die Chemie der dioxygenierten Verbindungen angesichts der erhaltenen Ergebnisse Synthesekontrollmaßnahmen erfordert, um sie zu korrigieren.