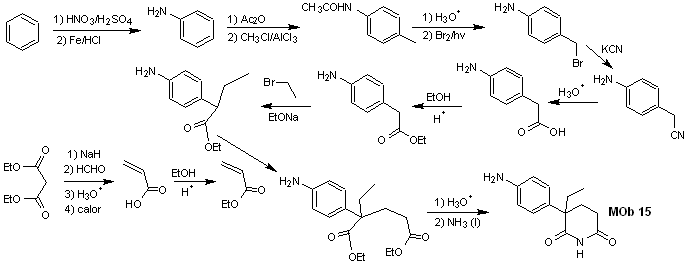
Síntese de compostos 1,3 e 1,5-dicarbonil
Proponha um projeto de síntese pelo método de desconexão (método synthon) a partir de materiais simples e acessíveis, para as seguintes moléculas:
(Lembre-se que caso não seja possível propor um desligamento direto, será necessário recorrer à estratégia de funcionalização prévia do MOb, até chegar a um modelo de desligamento aplicável)
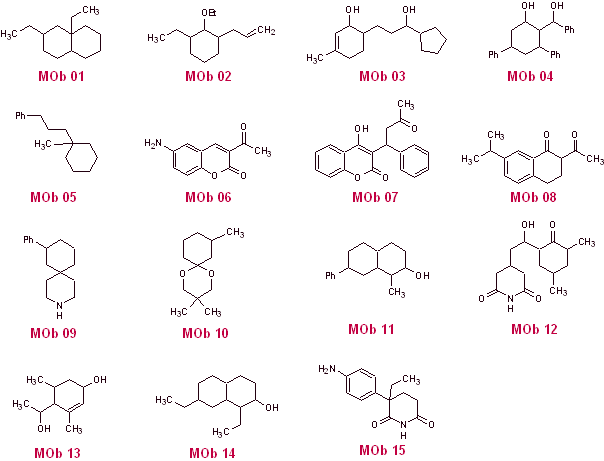
SOLUÇÕES PARA PROBLEMAS PROPOSTOS
O MOb 01 não possui nenhuma proporção de dioxigênio, um aspecto que de certa forma é uma vantagem para o químico. Ou seja, a estratégia a ser utilizada permitirá a busca de relações dioxigenadas na molécula precursora (equivalente sintético) com certo grau de liberdade, ou seja, pode-se postular, dependendo da estrutura do MOb, uma faixa de dicarbonil e/ou relações hidroxicarbonil, nas posições relativas 1.2, 1.3 , 1.4, 1.5 e/ou 1.6 ou suas variantes, tais como compostos carbonílicos α, β-insaturados.
Nesta ocasião, a síntese será exercida, recorrendo-se às proporções de 1,3 e/ou 1,5 dioxigenados. Dessa forma, a molécula alvo e os precursores serão convertidos em estruturas desconectáveis de acordo com um padrão conhecido e pré-estabelecido.
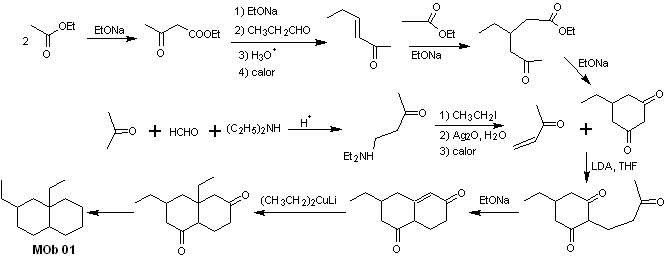
Solução MOb 01
Análise retrossintética : Na molécula em questão, pode-se começar com realizar um AGF, colocando um grupo C=O na estrutura da molécula precursora, em tal posição, que permite posteriormente fazer outro AGF, com uma ligação dupla localizada no carbono alfa e beta em relação ao carbonilo, para proceder para desconectá-lo.
A insaturação α, β, em relação a C=O, deve ser buscada como o alceno mais substituído das alternativas que podem existir. A presença de um substituinte na posição beta em C=O nos leva a pensar que ele poderia ter adicionado como nucleófilo a um composto carbonílico insaturado α, β, segundo a reação de adição conjugada de Michael. Com base nessas considerações, a seguinte análise retrossintética pode ser postulada para MOb 01:
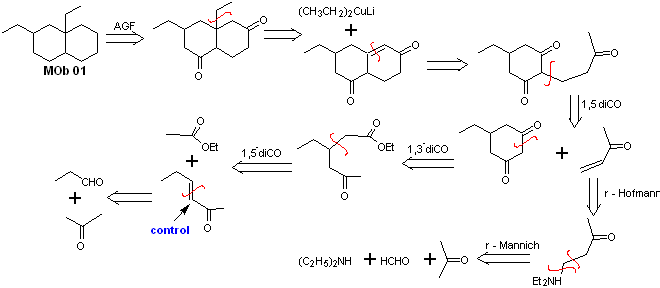
Síntese de MOb 01 : A condensação entre um aldeído enolizável e uma cetona normalmente produz produtos de autocondensação ou de condensação cruzada. Isso pode ser evitado, recorrendo à estratégia de exercer controle, no nucleófilo do cetona, como pode ser visto no esquema anexo.
Por outro lado, quando for necessário usar vinilcetonas como substrato na reação de Michael, isso significaria o uso de formaldeído. Infelizmente, esse aldeído, sendo muito reativo em meio básico, tende a causar reações de polimerização, que reduzem drasticamente o rendimento da síntese. Por isso, a reação de Mannich e a eliminação de Hofmann são adequadamente combinadas para vinilcetonas com altos rendimentos.
A eliminação de Hofmann poderia ser realizada no mesmo meio básico utilizado para a reação de Michael, portanto não é necessário isolar a vinilcetona.
No entanto, devido à experiência ainda limitada em síntese, será postulado o uso de óxido de prata em meio aquoso para conseguir a eliminação da amina e formação da vinilcetona.
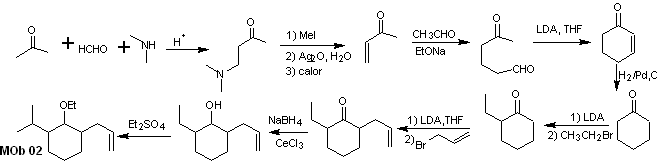
Solução MOb 02
Análise retrossintética : A presença dos grupos etil e propenil na posição 2 ao grupo éter orienta a estratégia de desconexão funcionalizando o éter à cetona e, posteriormente, tratando da alquilação de um enolato de ciclohexanona. As desconexões que ocorrem nas moléculas precursoras foram explicadas na solução do MOb 01.
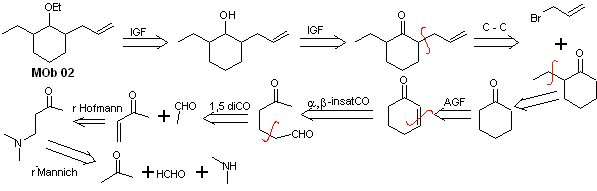
Síntese. Para preparar o enolato cinético será utilizado o LDA, pois esta base fracamente nucleofílica possui um alto impedimento estérico e abstrai um próton do carbono menos impedido da cetona. Por outro lado, para garantir a redução do grupo carbonila a álcool na presença de um grupo alceno, NaBH 4 será utilizado na presença de sais de Ce+3.
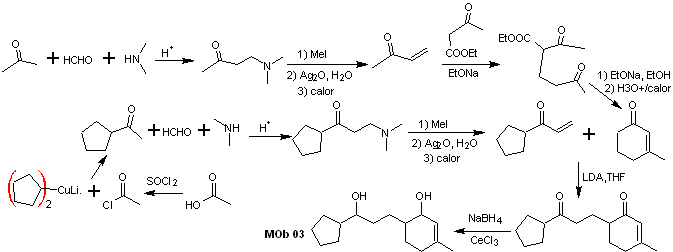
Solução MOb 03
Análise retrossintética : A posição relativa em 1,5 dos grupos hidroxila, permite propor uma molécula precursora de 1,5-diCO, que é desconectada segundo este modelo pela ligação que une a ciclohexenona ao resto da molécula, para formar duas moléculas precursoras α,β-insaturadas CO.
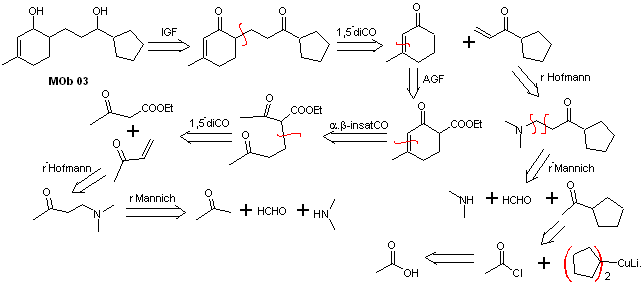
Síntese. É necessário exercer controle para a formação de vinilcetonas, para as quais a reação de Mannich é adequadamente combinada, seguida da eliminação de Hofmann. Para a reação de Michael, um cetoéster formado pela condensação de Claisen do éster de acetato de etila pode ser usado como nucleófilo, evitando assim a autocondensação da cetona.
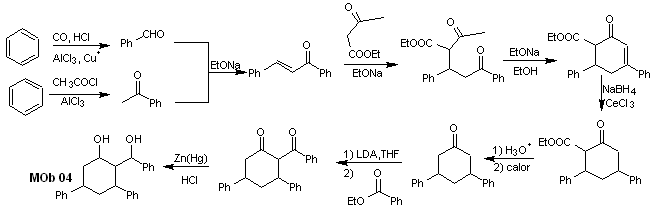
Solução MOb 04
Análise retrossintética : O OH na posição 1,3, pode ser transformado em 1,3-diCO, para proceder à desconexão segundo este modelo, que origina dois equivalentes sintéticos, dos quais é submetido a funcionalização por adição de –COOEt e um ponto de insaturação em 3,5-difenilciclohexanona. Os precursores gerados apresentam modelos dioxigenados para sua respectiva desconexão.
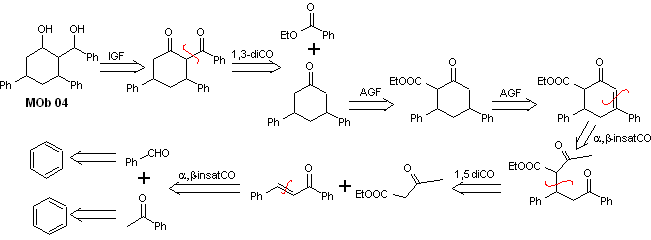 Síntese. Começa a partir do benzeno e controla a reação de Michael e as condensações.
Síntese. Começa a partir do benzeno e controla a reação de Michael e as condensações.
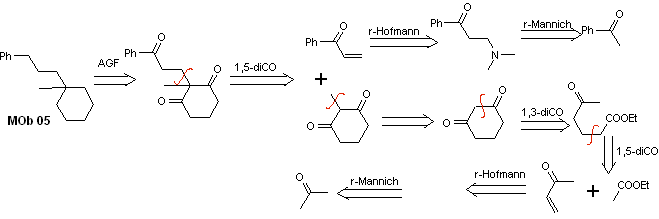
Solução MOb 05
Análise retrossintética : Várias relações dicarbonil podem ser consideradas para a estrutura da molécula precursora (equivalente sintético) de MOb 05. Por exemplo, localizando o primeiro grupo C=O ligado ao benzeno, uma relação 1,3-diCO pode ser postulada, um α , β-insatCO ou 1,5-diCO, envolvendo ciclohexano, com um ou dois grupos C=O. Esta última opção é assumida, uma vez que existe um grupo metilo adicional entre os grupos C=O, que é fácil de preparar, precisamente devido ao efeito ativador dos dois grupos C=O, sobre o nucleófilo que se forma em meio básico. Com base nessas considerações, o seguinte esquema de análise retrossintética para MOb 05 pode ser postulado.
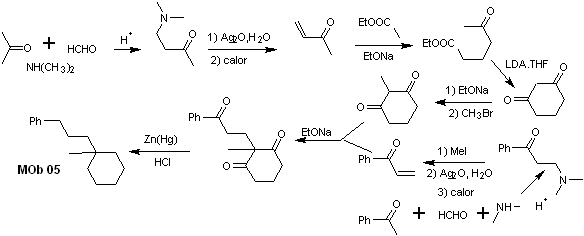
 síntese . A vinil acetofenona é preparada com bons rendimentos através da reação de Mannich, seguida da eliminação de Hofmann. Por outro lado o 1,3-ciclohexanodiona, é preparado a partir da condensação de Claisen de um cetoéster na posição 1,5-diCO. Essa dicetona é alquilada e um H é obtido em meio básico para formar o nucleófilo que atuará sobre o composto a,b-insatCO. Os grupos C=O da molécula de tricarbonila formados são reduzidos a metila pela redução de Clemmensen, colocando um excesso de amálgama de zinco em meio ácido.
síntese . A vinil acetofenona é preparada com bons rendimentos através da reação de Mannich, seguida da eliminação de Hofmann. Por outro lado o 1,3-ciclohexanodiona, é preparado a partir da condensação de Claisen de um cetoéster na posição 1,5-diCO. Essa dicetona é alquilada e um H é obtido em meio básico para formar o nucleófilo que atuará sobre o composto a,b-insatCO. Os grupos C=O da molécula de tricarbonila formados são reduzidos a metila pela redução de Clemmensen, colocando um excesso de amálgama de zinco em meio ácido.
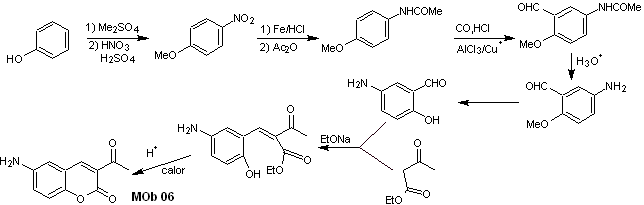
Solução MOb 06
Análise retrossintética. É desconectado pela lactona, operação que nos permite vislumbrar um grupo éster. A molécula precursora formada, também pode estar sujeita ao composto carbonílico, que poderia ter sido formado
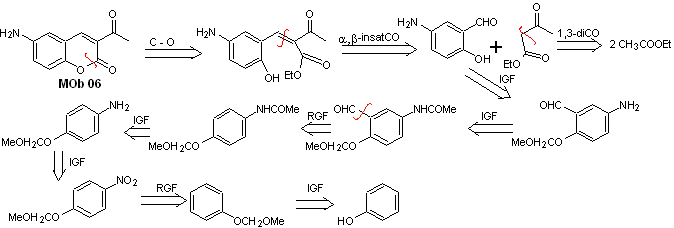
síntese . O grupo álcool é controlado protegendo-o com dimetil éter. Então o composto dicarbonílico deve ser sintetizado
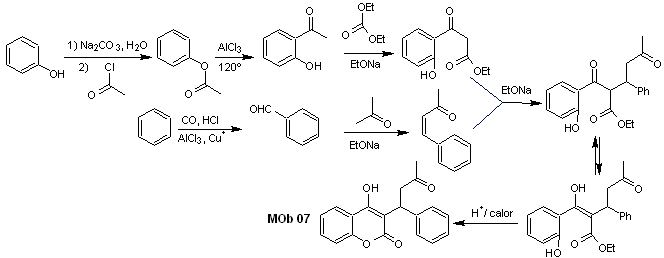
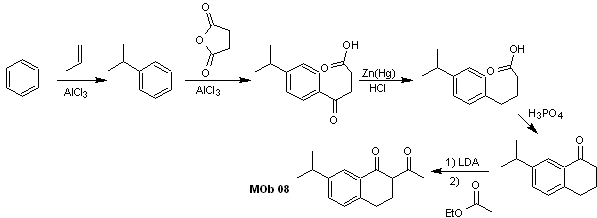
Solução MOb 07
Análise retrossintética. Mais uma vez, o processo de desconexão começa devido à função lactona, as relações dioxigenadas que aparecem em roupas de dança. Continua com a desconexão do 1,5-diCO e, assim, chega ao fenol e ao benzaldeído.
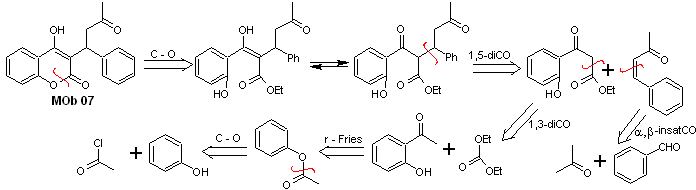
Síntese. Os materiais de partida são benzeno e fenol, o acetilfenol necessário é preparado de acordo com a reação de rearranjo de Fries.
Solução MOb 08
Análise retrossintética. A presença da relação 1,3-diCO em MOb 08 convida à desconexão de acordo com este modelo de desconexão, a molécula precursora gerada, não é necessário funcionalizá-la para nenhum modelo dioxigenado desconectável, mas sim as reações de ciclização da acilação são usadas intramolecular Friedel-Artesanato.
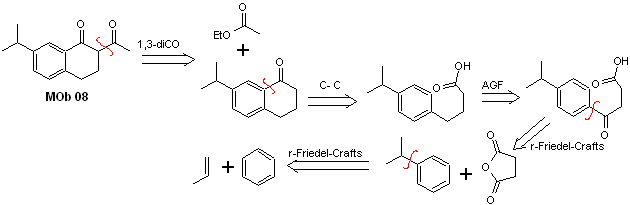
Síntese. A acilação do cumeno com anidrido succínico são as reações básicas que regem a síntese.A orientação do grupo isopropílico para um segundo eletrófilo que se aproxima do anel benzênico é ideal para formar o MOb.
Solução MOb 09
Análise retrossintética : O heterociclo nitrogenado do MOb pode ser funcionalizado em uma estrutura facilmente desconectável, como a função amida. O esqueleto de 1,5-diCO produzido será desconectado conforme previsto por este modelo, para chegar a um α,β -insatCO, que, ao ser desconectado, gera um equivalente sintético de uma ciclohexanona substituída por fenil. Esta última estrutura requer o uso adequado de retro-Hofmann e retro-Mannich, para chegar a materiais de partida simples e acessíveis.
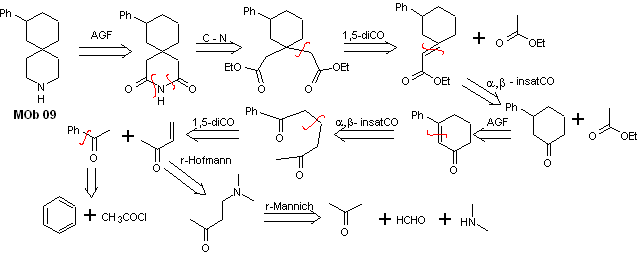
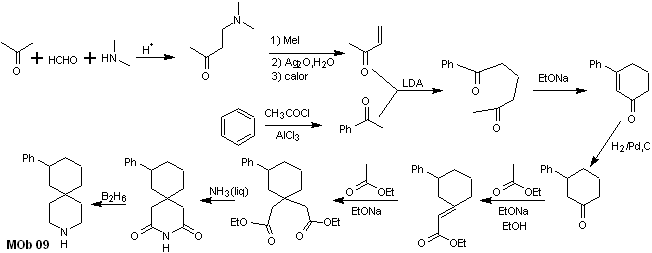
Síntese. A combinação apropriada da reação de Mannich e eliminação de Hofmann, seguida por reações de condensação do tipo aldol e Michael, dominam a estratégia de síntese de MOb 09,
solução MOb 10
Análise retrossintética: A desconexão do acetal cíclico leva a uma molécula precursora, facilmente conversível em um modelo de desconexão conhecido como α , β -insatCO. As funções dioxigenadas que são geradas posteriormente são desconectáveis, por modelos conhecidos.
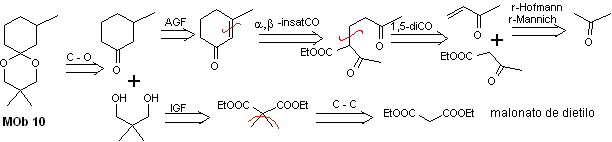
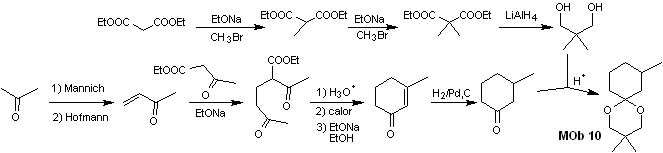
Síntese. O malonato de dietila é o material de partida simples necessário para a síntese, por um lado, e o acetoacetato de etila, por outro. O malonato de dietila E é duplamente metilado e por sua redução com excesso de LiALH 4 , o diol é preparado. Que em meio ácido formará o acetal cíclico.
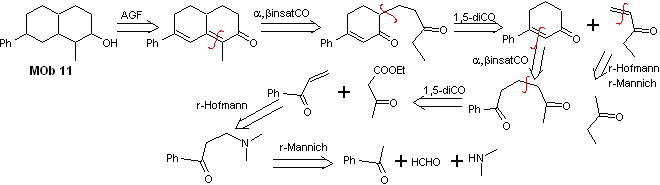
Solution Mob 11
Análise retrossintética. A funcionalização mais adequada requer a adição de duas instalações conjugadas com o grupo C=O, estratégia que será justificada mais adiante, quando for requer um nucleófilo para adicionar a um substrato de Michael.
Por outro lado, será necessário exercer controle, em algumas condensações, para evitar a autocondensação da acetona, para a qual se utiliza o éster acetoacético, resultado da condensação de Claisen do éster acetato de etila.
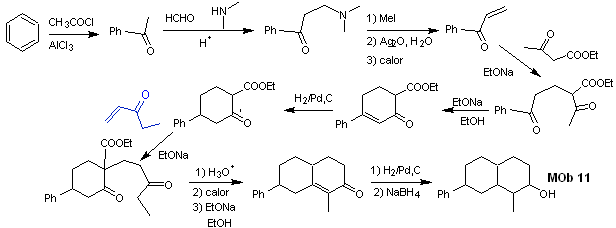
 síntese . As reações iniciais da síntese já foram amplamente explicadas na solução dos MObs anteriores, deve-se apenas observar que a reação de condensação intramolecular necessária é a reação de anelação de Robinson.
síntese . As reações iniciais da síntese já foram amplamente explicadas na solução dos MObs anteriores, deve-se apenas observar que a reação de condensação intramolecular necessária é a reação de anelação de Robinson.
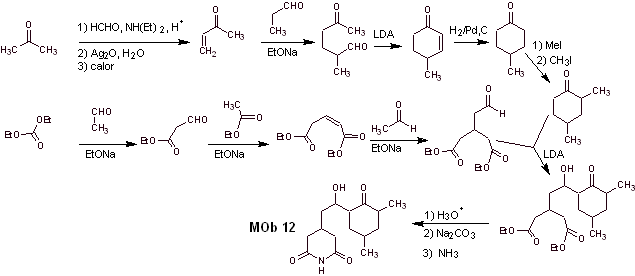
Solução Mob 12
Análise retrossintética : A desconexão inicial pelas ligações amida gera uma molécula precursora com várias proporções de dioxigênio, da qual é selecionado 1,3-diO, para dividir a molécula em dois fragmentos importantes e com cada um deles proceder às desconexões necessárias para gerar um projeto de síntese convergente.
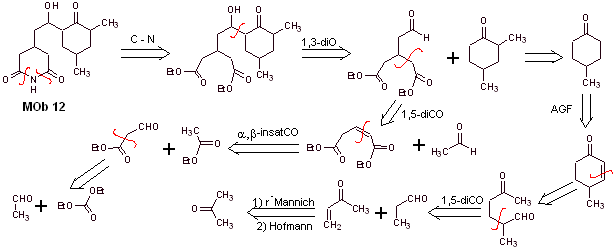
Síntese. O manuseio adequado de um aldeído, gerando mais hidrogênios ácidos em seu carbono alfa, faz parte de uma boa estratégia de síntese.
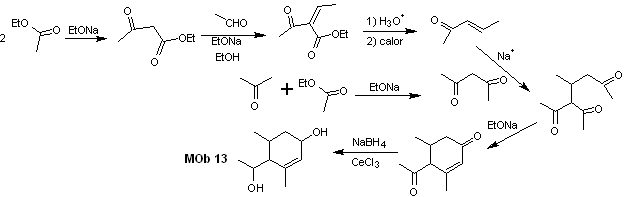
Solução MOb 13
Análise retrossintética. O composto dihidroxi, MOb 13, é transformado em um composto dicarbonílico, para gerar uma molécula precursora, desconectável de acordo com o modelo α, β – insat.CO, para prosseguir com 1,5-diCO e outros desta natureza, até chegar a materiais de partida simples.
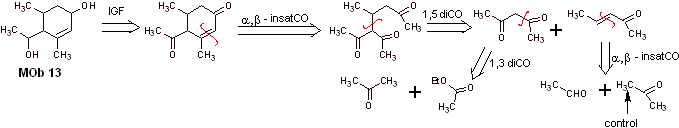 Síntese. O controle deve ser exercido em algumas reações de condensação catalisadas por base, para evitar as respectivas autocondensações, que irão gerar baixos rendimentos de síntese.
Síntese. O controle deve ser exercido em algumas reações de condensação catalisadas por base, para evitar as respectivas autocondensações, que irão gerar baixos rendimentos de síntese.
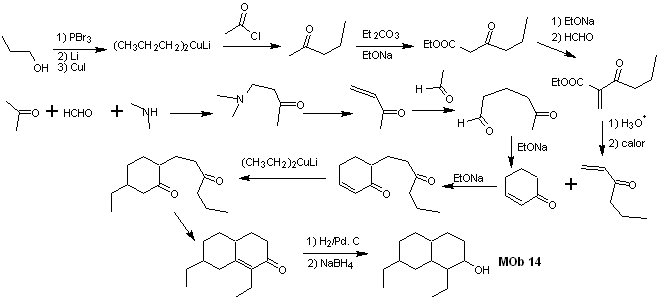
Solução MOb 14
Análise retrossintética . Essa molécula tem uma semelhança com a MOb 11, então as desconexões que forem feitas terão alguma semelhança.
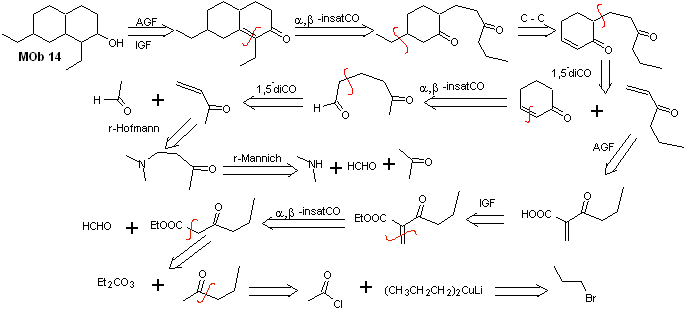 Síntese
Síntese
Solução MOb 15
Análise retrossintética. A desconexão das ligações NO da lactama permite gerar uma molécula precursora, que pode ser desconectada de acordo com os modelos já estudados e exercer controle para evitar reações de competição.
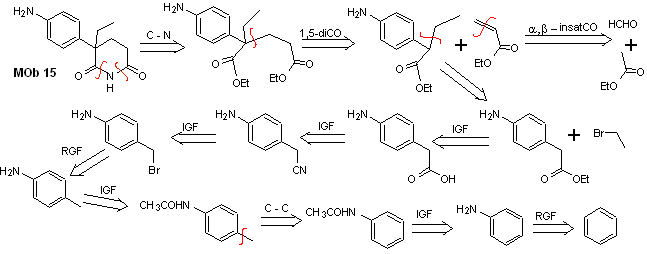 síntese . Todas las reacciones, hasta el momento han sido reiteradamente explicadas, por lo que en el presente ejercicio, se dará por sentado que, la química los compuestos dioxigenados, requiere de medidas de control de la síntesis, para rectificar la misma a la luz de los resultados obtidos.
síntese . Todas las reacciones, hasta el momento han sido reiteradamente explicadas, por lo que en el presente ejercicio, se dará por sentado que, la química los compuestos dioxigenados, requiere de medidas de control de la síntesis, para rectificar la misma a la luz de los resultados obtidos.