Synthèse de composés 1,3 et 1,5-dicarbonyle
Proposer un design de synthèse par la méthode de déconnexion (méthode synthon) à partir de matériaux simples et abordables, pour les molécules suivantes :
(Rappelons que s'il n'est pas possible de proposer une déconnexion directe, il faudra recourir à la stratégie de fonctionnalisation préalable du MOb, jusqu'à aboutir à un modèle de déconnexion applicable)
SOLUTIONS AUX PROBLÈMES PROPOSÉS
MOb 01 n'a pas de rapport dioxygène, un aspect qui, dans un certain sens, est un avantage pour le chimiste. C'est-à-dire que la stratégie à utiliser permettra la recherche de relations dioxygénées dans la molécule précurseur (équivalent synthétique) avec un certain degré de liberté, c'est-à-dire qu'on pourra postuler, en fonction de la structure du MOb, une gamme de dicarbonyl et/ou les relations hydroxycarbonyle, en positions relatives 1.2, 1.3 , 1.4, 1.5 et/ou 1.6 ou leurs variants, tels que les composés carbonylés α, β-insaturés.
A cette occasion, la synthèse s'exercera en recourant aux rapports dioxygénés 1,3 et/ou 1,5. De cette manière, la molécule cible et les précurseurs seront convertis en structures déconnectables selon un schéma connu et préétabli.
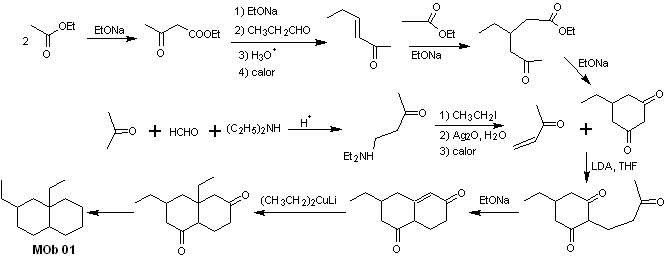
Solution MOb 01
Analyse rétrosynthétique : Dans la molécule en question, on peut commencer par effectuer un AGF, en plaçant un groupe C=O dans la structure de la molécule précurseur, dans une telle position, qui permet plus tard de faire un autre AGF, avec une double liaison située sur le carbone alpha et bêta par rapport au carbonyle, pour procéder pour le déconnecter.
L'insaturation α, β, par rapport à C=O, doit être recherchée comme l'alcène le plus substitué des alternatives qui pourraient exister. La présence d'un substituant en position bêta en C=O laisse penser qu'il aurait pu s'ajouter comme nucléophile à un composé carbonylé α,β insaturé, selon la réaction d'addition conjuguée de Michael. Sur la base de ces considérations, l'analyse rétrosynthétique suivante peut être postulée pour MOb 01 :
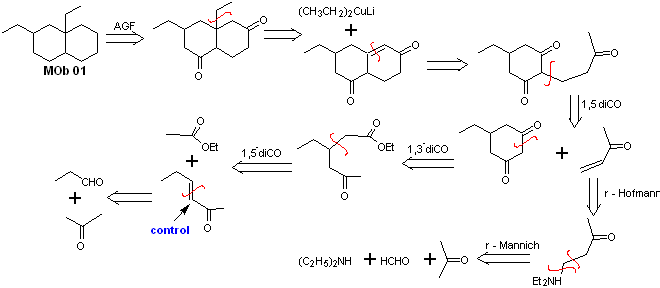
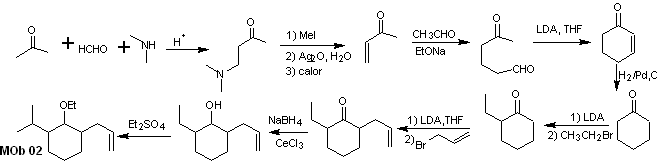
Synthèse de MOb 01 : La condensation entre un aldéhyde énolisable et une cétone produit normalement des produits d'autocondensation ou de condensation croisée. Cela peut être évité, en recourant à la stratégie du contrôle, chez le nucléophile du cétone, comme on peut le voir dans le schéma ci-joint.
D'autre part, lorsqu'il est nécessaire d'utiliser des cétones vinyliques comme substrat dans la réaction de Michael, cela signifierait l'utilisation de formaldéhyde. Malheureusement, cet aldéhyde, étant très réactif en milieu basique, a tendance à provoquer des réactions de polymérisation, qui abaissent drastiquement le rendement de la synthèse.Pour cette raison, la réaction de Mannich et l'élimination d'Hofmann sont adéquatement combinées pour les vinylcétones à hauts rendements.
L'élimination d'Hofmann pourrait être réalisée dans le même milieu basique que celui utilisé pour la réaction de Michael, il n'est donc pas nécessaire d'isoler la vinylcétone.
Cependant, du fait de l'expérience encore limitée en synthèse, l'utilisation d'oxyde d'argent en milieu aqueux sera postulée pour réaliser l'élimination de l'amine et la formation de la vinylcétone.
Solution MOb 02
Analyse rétrosynthétique : La présence des groupements éthyle et propényle en position 2 du groupement éther guide la stratégie de déconnexion en fonctionnalisant l'éther en cétone, et en traitant ensuite l'alkylation d'un énolate de cyclohexanone. Les déconnexions qui se produisent dans les molécules précurseurs ont été expliquées dans la solution de MOb 01.
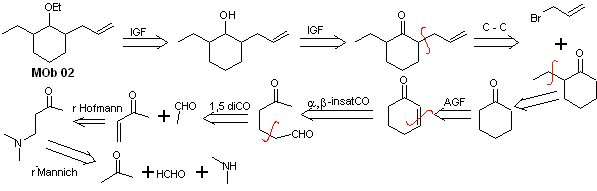
La synthèse. Pour préparer l'énolate cinétique, on utilisera le LDA, car cette base faiblement nucléophile a un fort encombrement stérique et extrait un proton du carbone le moins encombré de la cétone. Par contre, pour garantir la réduction du groupement carbonyle en alcool en présence d'un groupement alcène, on utilisera NaBH 4 en présence de sels de Ce +3 .
Solution MOb 03
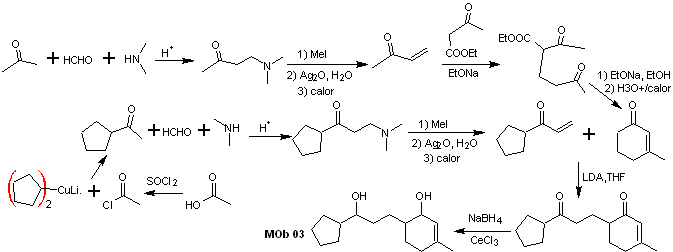
Analyse rétrosynthétique : La position relative en 1,5 des groupements hydroxyles, permet de proposer une molécule précurseur de 1,5-diCO, qui est déconnectée selon ce modèle par la liaison qui unit la cyclohexénone au reste de la molécule, pour former deux molécules précurseurs CO α,β-insaturé.
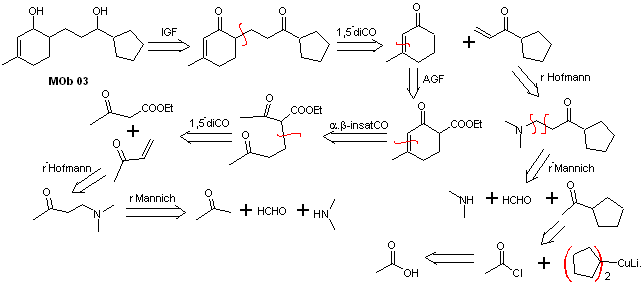
La synthèse. Il est nécessaire de contrôler la formation des vinylcétones, pour lesquelles la réaction de Mannich est suffisamment combinée, suivie de l'élimination d'Hofmann. Pour la réaction de Michael, un cétoester formé par la condensation de Claisen de l'ester d'acétate d'éthyle peut être utilisé comme nucléophile, évitant ainsi l'autocondensation de la cétone.
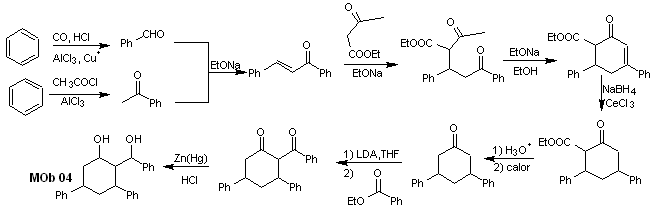
Solution MOb 04
Analyse rétrosynthétique : L'OH en position 1,3, peut être transformé en 1,3-diCO, pour procéder à la déconnexion selon ce modèle, qui est à l'origine de deux équivalents synthétiques, dont il est soumis à une fonctionnalisation par ajout de –COOEt et un point d'insaturation dans la 3,5-diphénylcyclohexanone. Les précurseurs générés présentent des modèles dioxygénés pour leur déconnexion respective.
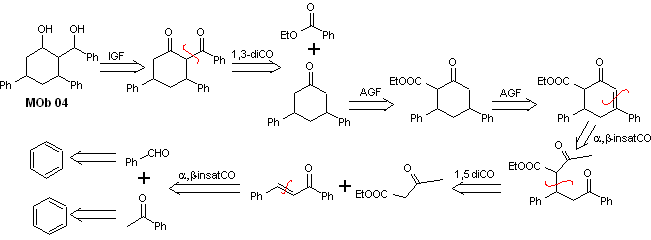 La synthèse. Il part du benzène et contrôle la réaction de Michael et les condensations.
La synthèse. Il part du benzène et contrôle la réaction de Michael et les condensations.
Solution MOb 05
Analyse rétrosynthétique : Différentes relations dicarbonyles peuvent être envisagées pour la structure de la molécule précurseur (équivalent synthétique) de MOb 05. Par exemple, en localisant le premier groupe C=O attaché au benzène, une relation 1,3-diCO peut être postulée, un α , β-insatCO ou 1,5-diCO, faisant intervenir le cyclohexane, avec un ou deux groupements C=O. Cette dernière option est supposée, car il existe un groupe méthyle supplémentaire entre les groupes C = O, qui est facile à préparer, précisément en raison de l'effet activateur des deux groupes C = O, sur le nucléophile qui se forme dans milieu de base. Sur la base de ces considérations, le schéma d'analyse rétrosynthétique suivant pour MOb 05 peut être postulé.
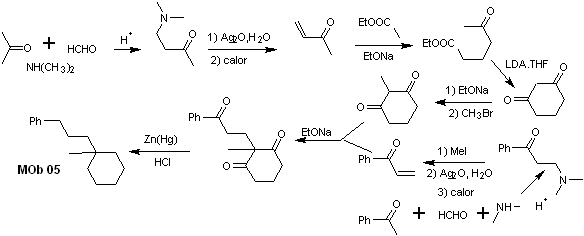
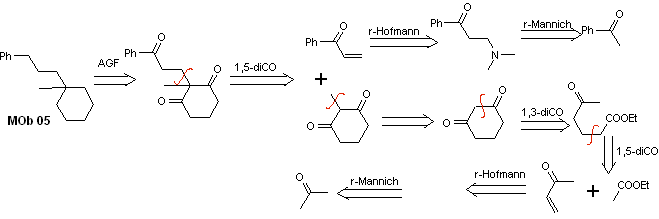 synthèse . L'acétophénone vinylique est préparée avec de bons rendements par la réaction de Mannich, suivie d'une élimination de Hofmann. D'autre part le La 1,3-cyclohexanedione, est préparée à partir de la condensation de Claisen d'un cétoester en position 1,5-diCO. Cette dicétone est alkylée et un H est obtenu en milieu basique pour former le nucléophile qui va agir sur le composé a,b-insatCO. Les groupements C=O de la molécule tricarbonyle formée sont réduits en méthyle par réduction Clemmensen en plaçant un excès d'amalgame de zinc en milieu acide.
synthèse . L'acétophénone vinylique est préparée avec de bons rendements par la réaction de Mannich, suivie d'une élimination de Hofmann. D'autre part le La 1,3-cyclohexanedione, est préparée à partir de la condensation de Claisen d'un cétoester en position 1,5-diCO. Cette dicétone est alkylée et un H est obtenu en milieu basique pour former le nucléophile qui va agir sur le composé a,b-insatCO. Les groupements C=O de la molécule tricarbonyle formée sont réduits en méthyle par réduction Clemmensen en plaçant un excès d'amalgame de zinc en milieu acide.
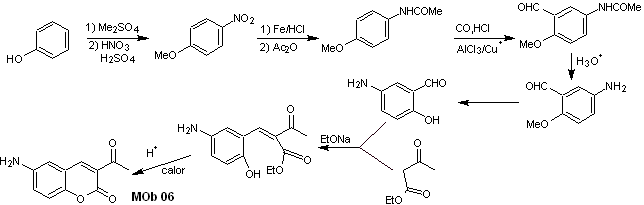
Solution MOb 06
Analyse rétrosynthétique. Il est déconnecté par la lactone, opération qui permet d'entrevoir un groupement ester. La molécule précurseur formée, peut également être soumise au composé carbonylé, qui aurait pu être formé
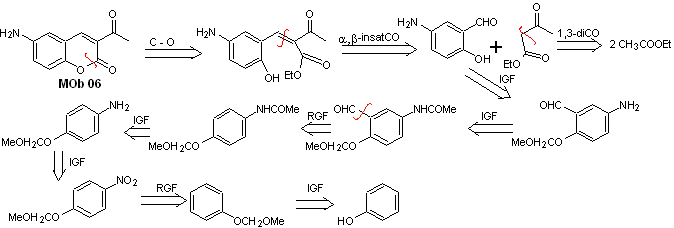
synthèse . Le groupe alcool est contrôlé en le protégeant avec du diméthyl éther. Ensuite, le composé dicarbonylé doit être synthétisé
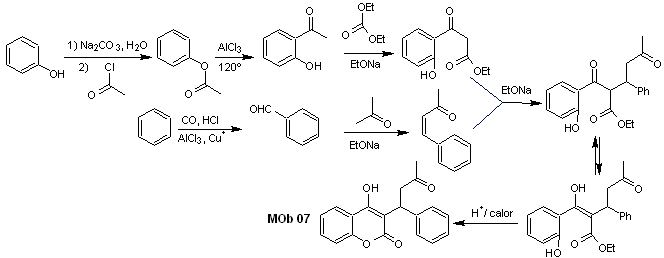
Solution MOb 07
Analyse rétrosynthétique. Une fois de plus, le processus de déconnexion commence en raison de la fonction lactone, les relations dioxygénées qui apparaissent dans vêtements de danse. Il continue avec la déconnexion 1,5-diCO, et ainsi, il arrive au phénol et au benzaldéhyde.
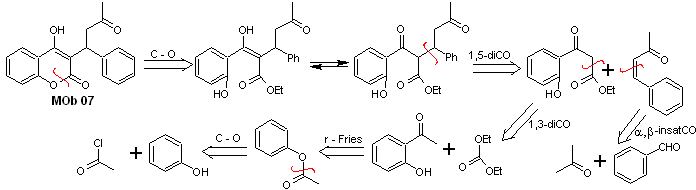
La synthèse. Les matières premières sont le benzène et le phénol, l'acétylphénol requis est préparé selon la réaction de réarrangement de Fries.
Solution MOb 08
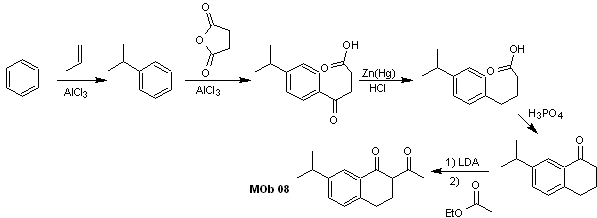
Analyse rétrosynthétique. La présence de la relation 1,3-diCO dans MOb 08 invite à la déconnexion selon ce modèle de déconnexion, la molécule précurseur générée, il n'est pas nécessaire de la fonctionnaliser en un modèle dioxygéné déconnectable, mais plutôt les réactions de cyclisation de l'acylation sont utilisées intramoléculaires Friedel-Crafts.
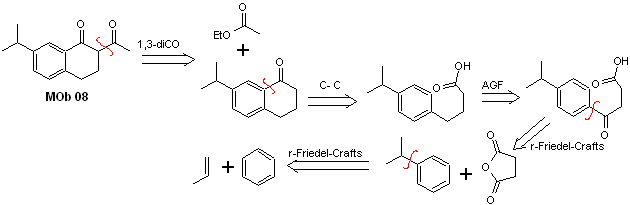
La synthèse. L'acylation du cumène avec l'anhydride succinique sont les réactions de base qui régissent la synthèse.L'orientation du groupe isopropyle vers un second électrophile qui se rapproche du cycle benzénique est idéale pour former le MOb.
Solution MOb 09
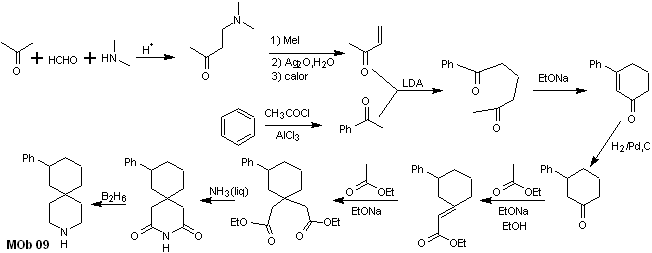
Analyse rétrosynthétique : L'hétérocycle azoté du MOb peut être fonctionnalisé vers une structure facilement déconnectable comme la fonction amide. Le squelette 1,5-diCO produit sera déconnecté comme prédit par ce modèle, pour arriver à un α, β -insatCO, qui, lorsqu'il est déconnecté, génère un équivalent synthétique d'une cyclohexanone phényl-substituée. Cette dernière structure nécessite la bonne utilisation du rétro-Hofmann et du rétro-Mannich, pour arriver à des matériaux de départ simples et abordables.
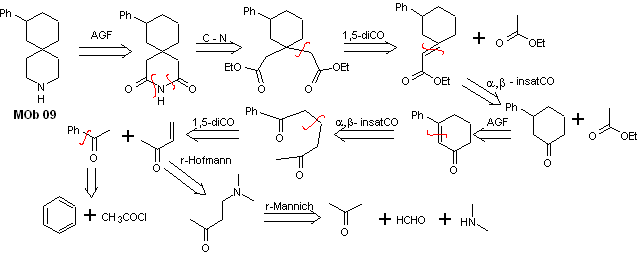
La synthèse. La combinaison appropriée de la réaction de Mannich et de l'élimination d'Hofmann, suivie de réactions de condensation de type aldol et Michael, domine la stratégie de synthèse de MOb 09,
Solution MOb 10
Analyse rétrosynthétique : La déconnexion de l'acétal cyclique conduit à une molécule précurseur, facilement convertible en un modèle de déconnexion appelé α , β -insatCO. Les fonctions dioxygénées générées ultérieurement sont déconnectables, par des modèles connus.
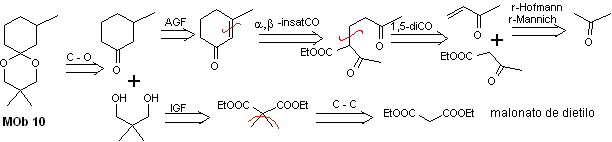
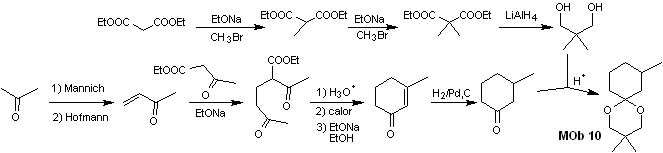
La synthèse. Le malonate de diéthyle est la matière première simple nécessaire à la synthèse d'une part et l'acétoacétate d'éthyle d'autre part. Le malonate de diéthyle E est doublement méthylé et par réduction de celui-ci avec un excès de LiALH 4 , le diol est préparé. Qui en milieu acide formera l'acétal cyclique.
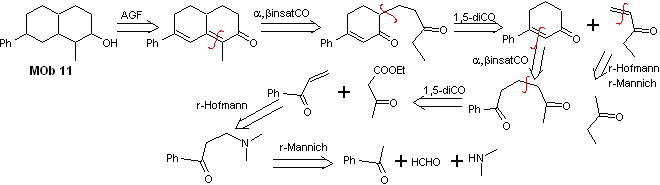
Solution Mob 11
Analyse rétrosynthétique. La fonctionnalisation la plus appropriée nécessite l'adjonction de deux installations conjuguées au groupe C=O, cette stratégie sera justifiée ultérieurement, lorsqu'elle sera nécessite un nucléophile à ajouter à un substrat de Michael.
En revanche, il faudra exercer un contrôle, dans certaines condensations, pour éviter l'autocondensation de l'acétone, pour laquelle on utilise l'ester acétoacétique, résultat de la condensation de Claisen de l'ester d'acétate d'éthyle.
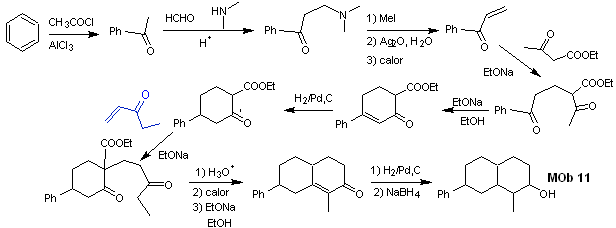
 synthèse . Les réactions initiales de la synthèse ont déjà été abondamment expliquées dans la solution des MObs précédents, il faut seulement noter que la réaction de condensation intramoléculaire requise est la réaction d'annelation de Robinson.
synthèse . Les réactions initiales de la synthèse ont déjà été abondamment expliquées dans la solution des MObs précédents, il faut seulement noter que la réaction de condensation intramoléculaire requise est la réaction d'annelation de Robinson.
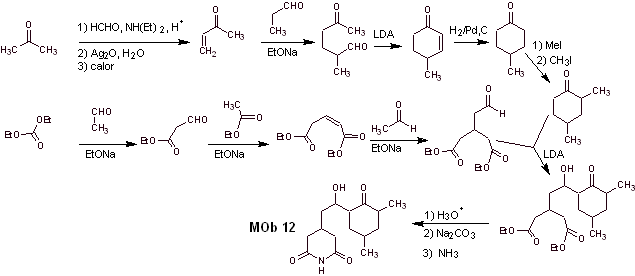
Solution Mob 12
Analyse rétrosynthétique : La déconnexion initiale par les liaisons amide génère une molécule précurseur avec différents rapports de dioxygène, à partir de laquelle 1,3-diO est sélectionné, pour diviser la molécule en deux fragments importants et avec chacun d'eux procéder aux déconnexions nécessaires pour générer un conception de synthèse convergente.
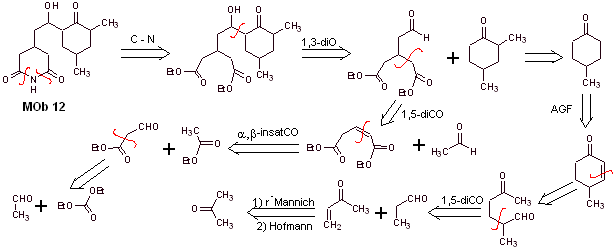
La synthèse. La bonne manipulation d'un aldéhyde, générant des hydrogènes plus acides sur son carbone alpha, fait partie d'une bonne stratégie de synthèse.
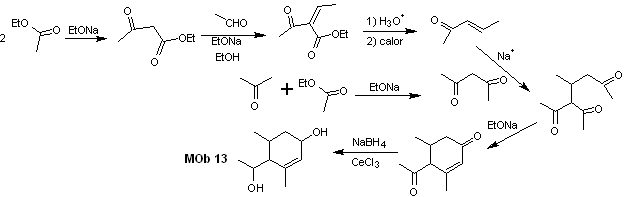
Solution MOb 13
Analyse rétrosynthétique. Le composé dihydroxy, MOb 13, se transforme en composé dicarbonylé, pour générer une molécule précurseur, déconnectable selon le modèle α, β – insat.CO, pour procéder au 1,5-diCO et autres de cette nature, jusqu'à arriver à matériaux de départ simples.
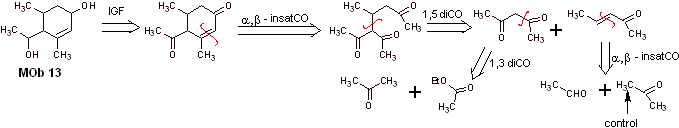 La synthèse. Un contrôle doit être exercé dans certaines réactions de condensation catalysées par une base, pour éviter les auto-condensations respectives, qui généreront de faibles rendements de synthèse.
La synthèse. Un contrôle doit être exercé dans certaines réactions de condensation catalysées par une base, pour éviter les auto-condensations respectives, qui généreront de faibles rendements de synthèse.
Solution MOb 14
Analyse rétrosynthétique . Cette molécule a une ressemblance avec MOb 11, donc les déconnexions qui sont faites auront une certaine similitude.
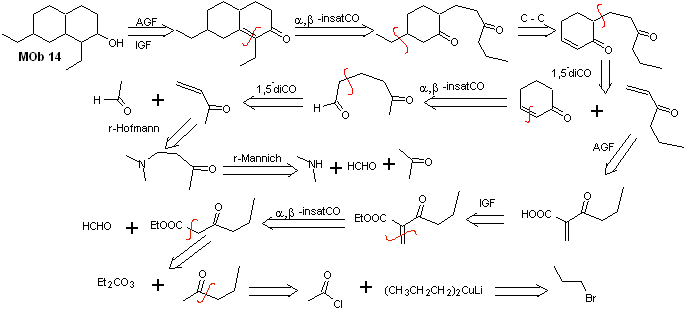 La synthèse
La synthèse
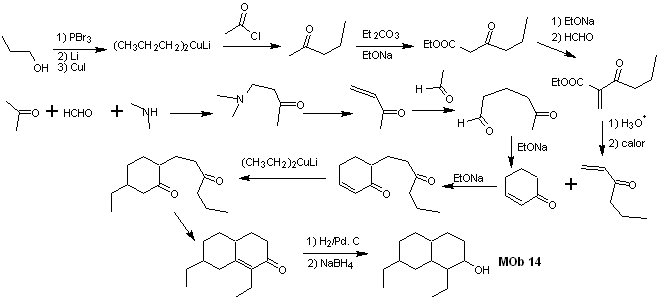
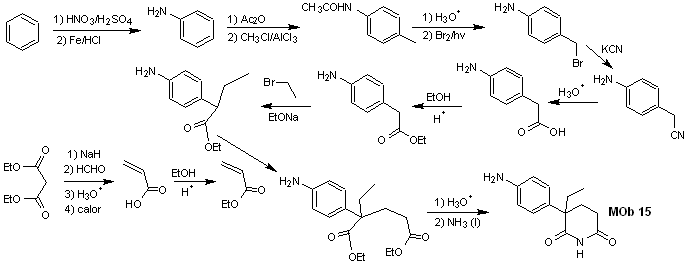
Solution MOb 15
Analyse rétrosynthétique. La déconnexion des liaisons NO du lactame permet de générer une molécule précurseur, déconnectable selon les modèles déjà étudiés et d'exercer un contrôle pour éviter les réactions de compétition.
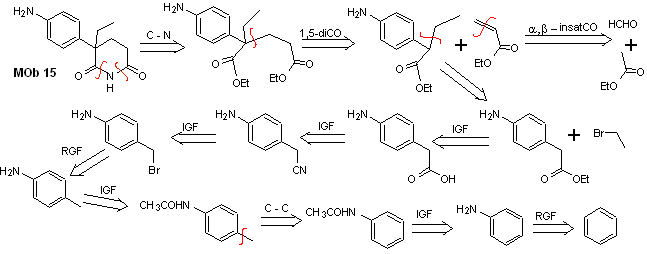 synthèse . Todas las reacciones, hasta el momento han sido reiteradamente explicadas, por lo que en el presente ejercicio, se dará por sentado que, la química los compuestos dioxigenados, requiere de medidas de control de la síntesis, para rectificar la misma a la luz de los résultats obtenus.
synthèse . Todas las reacciones, hasta el momento han sido reiteradamente explicadas, por lo que en el presente ejercicio, se dará por sentado que, la química los compuestos dioxigenados, requiere de medidas de control de la síntesis, para rectificar la misma a la luz de los résultats obtenus.