La condensation d'acyloïne transforme les esters [1] en alpha-hydroxycétones [2]. Cette réaction est effectuée avec du sodium métallique dans un solvant inerte. 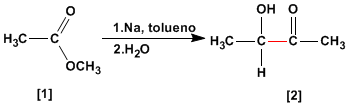
Mécanisme
Dans le mécanisme de la réaction, le sodium métallique réagit avec l'ester [1] pour former un anion-radical, qui se dimérise pour former le dianion [4]. 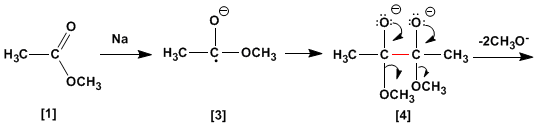
La dicétone [5] se forme par perte de deux équivalents de méthylate. La réaction avec deux équivalents de sodium métallique convertit la dicétone [5] en ènediolate [6], qui génère un ènediol [7] lors d'un traitement aqueux. 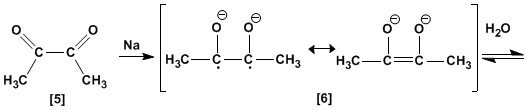
La dernière étape est l'interconversion entre l'énol et la cétone, connue sous le nom de tautomérie céto-énol. 
La condensation d'acyloïne est également une méthode importante pour préparer des cycles moyens et grands. 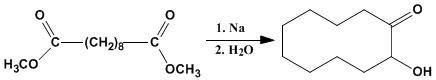
Les références
1. N. Allinger, Org. Synthé. IV:840(1963)
2. J.-P. Sauvage, Acc.Chem.Res.1990, 23, 319-327.
3. SM McElvain, Org. réagir. 1948, 4, 256-268.
4. M. Makosza et k. Grela, Synlett. 1997 :267.







