Halogenwasserstoffe addieren sich zu Alkenen und bilden Halogenalkane. Das Proton wirkt als Elektrophil und wird in der ersten Stufe vom Alken angegriffen. Als Reagenzien in dieser Reaktion können HF, HCl, HBr, HI verwendet werden.
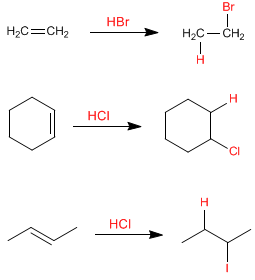
In diesen Beispielen ist das Alken symmetrisch und es spielt keine Rolle, an welchen Kohlenstoff des Alkens die Wasserstoffbrücken gebunden sind. Bei asymmetrischen Alkenen können zwei Arten von Produkten angegeben werden, je nachdem, an welchen sp 2 -Kohlenstoff der Wasserstoff addiert wird. Sehen wir uns ein Beispiel an:
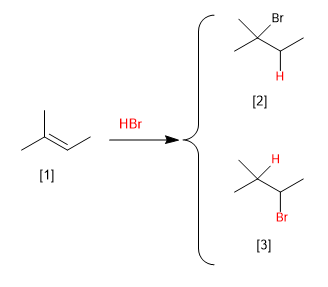
[1] 2-Methyl-2-buten
[2] 2-Brom-2-methylbutan
[3] 2-Brom-3-methylbutan (nicht gebildet)
Die Addition von HBr an 2-Methyl-2-buten kann zwei Produkte erzeugen, je nachdem, ob der Wasserstoff an die Methylkohle oder an die benachbarte addiert wird. Experimentell wird beobachtet, dass 2-Brom-2-methylbutan erhalten wird und 2-Brom-3-methylbutan nicht als Reaktionsprodukt auftritt.
Wie ist diese experimentelle Tatsache zu erklären? Die Antwort liegt im Reaktionsmechanismus, den wir weiter unten spezifizieren werden.
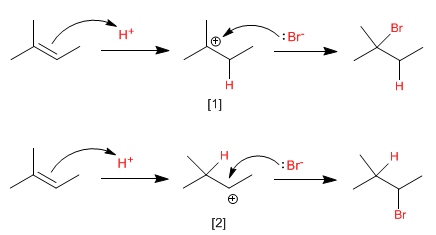
Die limitierende Stufe dieses Mechanismus ist der elektrophile Angriff auf das Proton (erster Schritt), in dieser Stufe wird ein sehr instabiles Reaktionsintermediat gebildet, das als Carbokation bezeichnet wird.
Die größere Stabilität des [1] (tertiären) Carbokations im Vergleich zu der des [2] (sekundären) Carbokations macht den ersten Mechanismus günstiger als den zweiten.