Molekul organik mendistribusikan elektronnya dalam tingkat elektronik yang berbeda yang disebut orbital molekul. Orbital molekul dengan energi terendah adalah $\sigma$, diikuti oleh orbital $\pi$. Ketika dalam molekul terdapat atom dengan pasangan elektron bebas (oksigen, belerang, nitrogen, halogen) kita akan memiliki tingkat non-ikatan n. Tingkat elektronik ini diatur dalam daerah ikatan diagram. Di daerah antiikatan kita menemukan orbital molekul $\pi^{\ast}$ dan $\sigma^{\ast}$. Molekul dalam keadaan dasarnya memiliki orbital ikatan dan nonikatan yang terisi dan orbital antiikatan kosong.
Dari apa yang telah dibahas di atas, dapat disimpulkan bahwa transisi elektronik harus dimulai dari orbital ikatan dan nonikatan yang diakhiri dengan orbital antiikatan. Dengan demikian kita dapat memiliki 5 jenis transisi elektronik yang ditunjukkan pada diagram berikut.
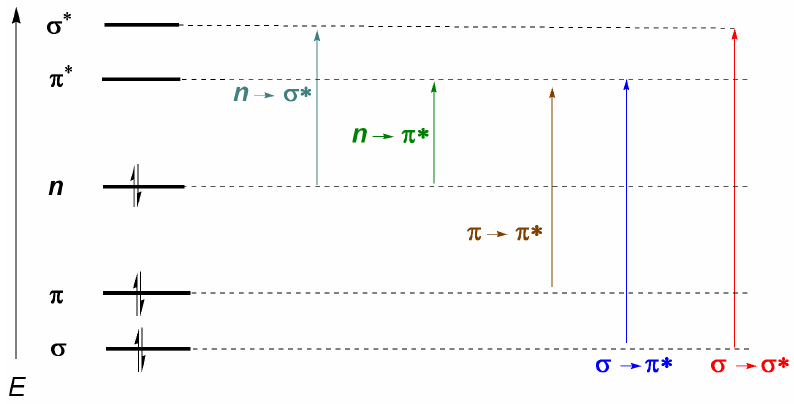
Transisi elektronik yang paling penting biasanya dari HOMO (orbital terakhir yang diduduki) ke LUMO (orbital kosong pertama) yang sesuai dengan lompatan energik terkecil dan sesuai dengan panjang gelombang yang panjang.
Dalam alkana hanya $\sigma \rightarrow \sigma^{\ast}$ transisi dimungkinkan (ethane: $\lambda =135\;nm$). Pita ini tidak dapat diamati dengan spektrofotometer komersial, karena mereka memindai dari 200 nm. Namun, molekul yang menghadirkan ikatan rangkap terkonjugasi menghadirkan transisi $\pi \rightarrow \pi^{\ast}$ yang dapat diamati (butadiena: $\lambda =217\;nm$).
Ketika ada atom dengan pasangan mandiri dalam molekul, transisi dengan energi terendah (panjang gelombang terbesar) adalah $n\panah kanan \pi$. Namun, ini adalah transisi yang tidak mungkin, karena tidak ada tumpang tindih antara kedua orbital, menyebabkan pita yang sangat lemah. Dari komentar terakhir ini aturan pemilihan untuk spektroskopi UV-tampak sebagai berikut: $n\rightarrow \pi^{\ast}$ transisi adalah "terlarang". Transisi dengan probabilitas rendah dianggap dilarang.