Stereochemie
Stereochemie ist die Untersuchung organischer Verbindungen im Weltraum. Um die Eigenschaften organischer Verbindungen zu verstehen, ist es notwendig, alle drei räumlichen Dimensionen zu betrachten. Die Grundlagen der Stereochemie wurden von Jacobus van't Hoff und Le Bel im Jahr 1874 sowie von Ernest L. Eliel im 20. Jahrhundert gelegt. Sie schlugen unabhängig voneinander vor, dass die vier Substituenten an einem Kohlenstoff zu den Eckpunkten eines Tetraeders zeigen, wobei sich der Kohlenstoff in der Mitte des Tetraeders befindet.
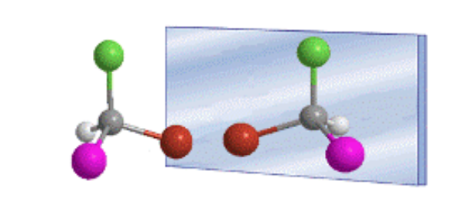
Die tetraedrische Anordnung von Substituenten an einem sp 3 -Kohlenstoff führt zur Existenz von zwei möglichen Verbindungen, die nicht überlagerbare Spiegelbilder sind, genannt Enantiomere.
Allgemein werden Moleküle, die sich durch die räumliche Anordnung ihrer Atome unterscheiden, als Stereoisomere bezeichnet.
Isomerie
Isomere sind solche Verbindungen, die identische Summenformeln haben, sich aber in der Art oder Anordnung der Bindungen zwischen ihren Atomen oder in der Anordnung ihrer Atome im Raum unterscheiden.
Um Unterschiede in den Eigenschaften zu interpretieren, stellten sich Chemiker im letzten Jahrhundert vor, dass die Atome eines Moleküls bestimmte räumliche Anordnungen hätten, die ihr unterschiedliches Verhalten erklärten.
Die Klassifizierung nach chemischer Funktion, die gemäß dem Verhalten der Verbindungen festgelegt wurde, wurde mit dem Vorhandensein einer Gruppe von Atomen im Molekül in Verbindung gebracht, die als funktionelle Gruppe bezeichnet wird.
Zusätzlich zur Bedeutung der funktionellen Gruppe gibt es einen Unterschied im Verhalten, der durch geringfügige Unterschiede in der Anordnung der verschiedenen Atome hervorgerufen wird, aus denen der Rest des Moleküls besteht. Diese Unterschiede können auf verschiedene Klassen von Isomerie reagieren:
Funktionsisomerie
Zu dieser Art von Isomerie gehören Konstitutionsisomere, die sich durch unterschiedliche funktionelle Gruppen voneinander unterscheiden.
Die funktionelle Gruppe in beiden Isomeren ist unterschiedlich
C2H6O _
Ethanol (CH 3 -CH 2 -OH) und Dimethylether (CH 3 -O-CH 3 )
Alkohol reagiert mit Natrium, während mit Ether keine Reaktion beobachtet wird.
Physikalisch gesehen ist Alkohol eine Flüssigkeit mit einem Siedepunkt von 78,5 °C, während Ether ein Gas ist, das sich bei -23 °C verflüssigt.
Positions- und/oder Skelettisomerie.
Die funktionellen Gruppen sind identisch, befinden sich aber an unterschiedlichen Positionen am Molekülgerüst (Positionsisomere).
Bsp.: 2-Hexanol und 3-Hexanol:
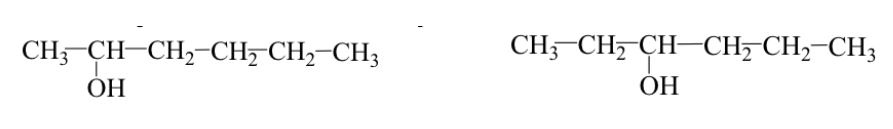
Manchmal hat die Alkylgruppe eine andere Anordnung (Hauptkette oder Verzweigungsisomere).
Beispiel: 3-Methyl-2-pentanol und 2-Hexanol
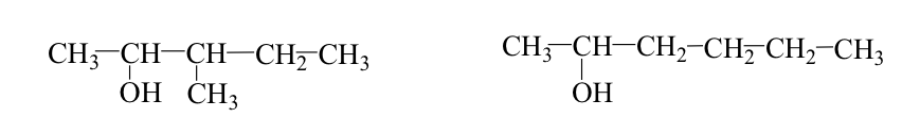
Beide Fälle können gleichzeitig auftreten:
Beispiel: 3-Methyl-2-pentanol und 3-Hexanol
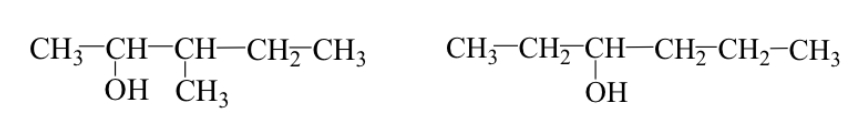
Tautomerie
Sie sind konstitutionelle Isomere, die sich leicht ineinander umwandeln lassen, da sie in einem schnellen Gleichgewicht miteinander stehen. Das Phänomen wird Tautomerie genannt und besteht normalerweise aus einem Atom, normalerweise Wasserstoff, das sich in einer Triade von Atomen befindet, und einer Doppelbindung, die gleichzeitig ihre Position ändert.
Das klassischste Beispiel ist das Keto-Enol-Gleichgewicht ( -en für die Doppelbindung und -ol für den Alkohol).
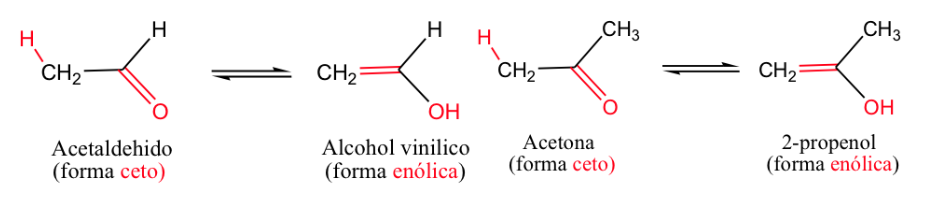
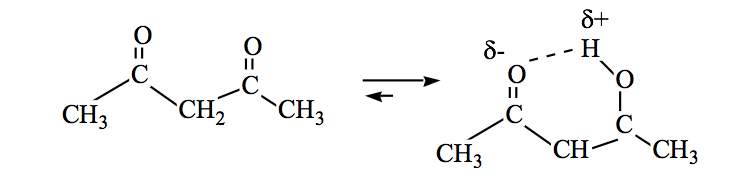
Im Allgemeinen sind die Ketonformen am stabilsten, aber wenn sich die Enolform stabilisiert (durch Wasserstoffbindung oder durch Resonanz), verschiebt sich das Gleichgewicht.
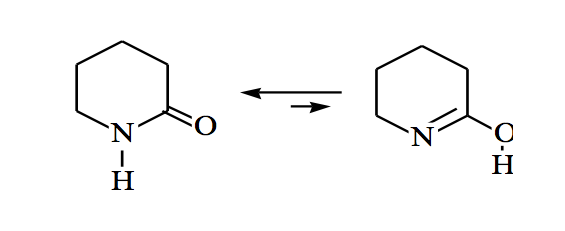
Amide können auch im Keto-Enol-Gleichgewicht stehen:
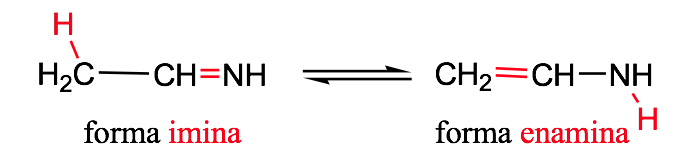
Imin-Enamin -Tautomerie:
Nitro-aci
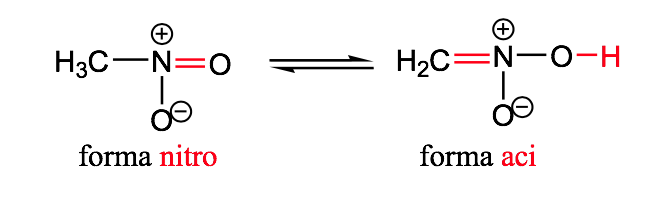
geometrische Isomerie
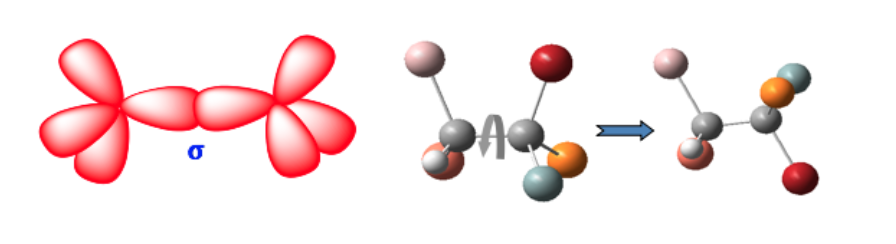
Diese beiden Formen sind keine geometrischen Isomere, da die freie Rotation um die Einfachbindung eine Form in eine andere umwandelt (Konformere).
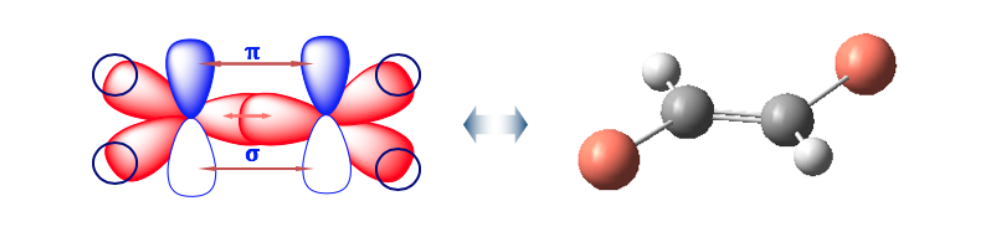
Die Doppelbindung lässt keine freie Rotation zu, was je nach Position der Gruppen A und B im Raum zwei unterschiedliche Strukturen erzeugen kann: Es handelt sich um geometrische Isomere .
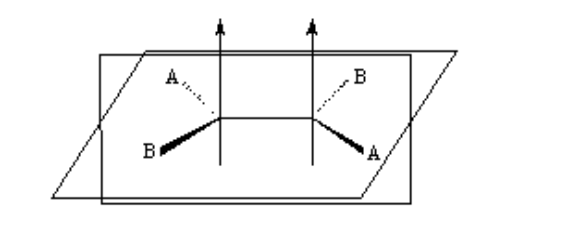
Isomerie in Alkenen
Damit geometrische Isomerie existiert, müssen zwei Bedingungen erfüllt sein:
1.- Gehinderte Rotation (z. B. durch eine Doppelbindung)
2.- Zwei verschiedene Gruppen (A und B), die an beiden Seiten des Links angebracht sind
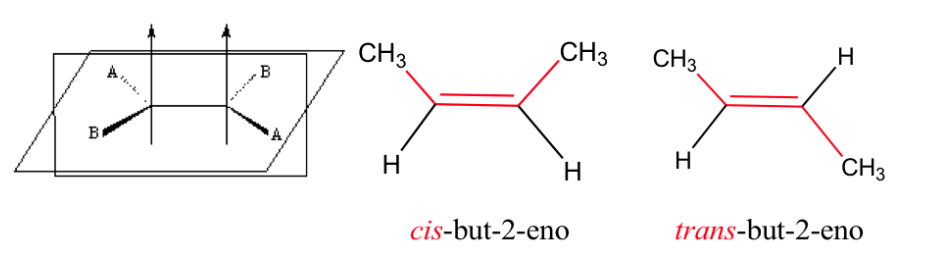
Auswirkung der geometrischen Isomerie auf physikalische Eigenschaften

Geometrische Isomerennomenklatur
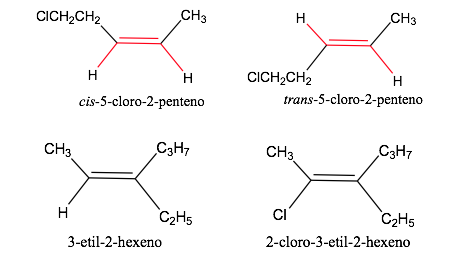 Reihenfolge- oder Prioritätsregeln
Reihenfolge- oder Prioritätsregeln
Die Regeln, die berücksichtigt werden müssen, um die Prioritäts- oder Präferenzreihenfolge von Atomen oder Atomgruppen festzulegen, wurden 1956 von Cahn , Ingold und Prelog aufgestellt und mehrmals modifiziert, um Mehrdeutigkeiten zu vermeiden.
Wenn die Gruppen mit hoher Priorität auf gegenüberliegenden Seiten der Ebene senkrecht zum Molekül liegen, wird das Isomer E genannt.
Wenn sie sich auf derselben Seite dieser Ebene befinden, wird das Isomer Z genannt.
Beispiel: But-2-en:
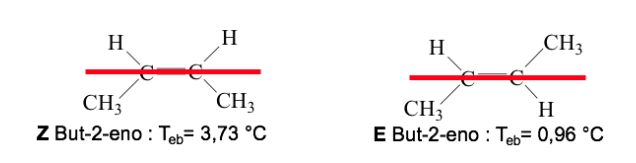
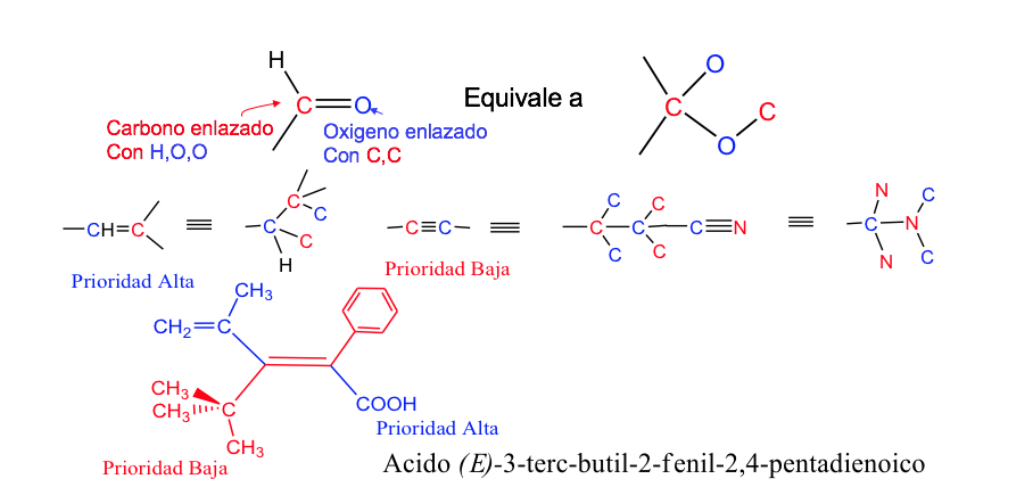
Die Priorität der Substituenten an den Kohlenstoffatomen der Doppelbindung lässt sich aus folgenden Regeln ableiten:
- Regel 1:
- Wenn die an das untersuchte Kohlenstoffatom gebundenen Atome unterschiedlich sind, haben die mit der höheren Ordnungszahl Vorrang vor denen mit der niedrigeren Ordnungszahl, und wenn es zwei Isotope gibt, werden sie in absteigender Reihenfolge der Atommasse betrachtet.
Beispiel: Br (35)> Cl (17)> O (8)> N (7)> C (6)> H (1)
D> H und 13 C> 12 C
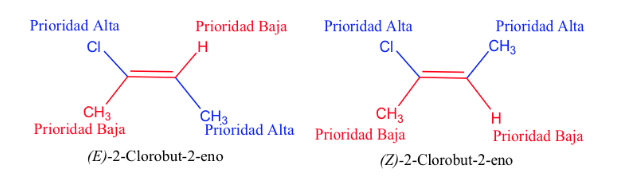
Regel 2 :
Wenn die an das Kohlenstoffatom gebundenen Atome identisch sind (und die erste Regel nicht funktioniert), wird die Reihenfolge befolgt, dh die daran gebundenen Atome werden verglichen und, falls erforderlich, weil sie auch gleich waren, die daran gebundenen Atome verwendet werden, usw., wobei zu berücksichtigen ist, dass bei gleichen Atomen, aber in unterschiedlicher Anzahl, der Substituent mit den höherrangigen Atomen Vorrang hat.
Beispiel: -CH 2 -OH> -CH 3 , weil O> H
-CH 2 -Br> -CH 2 -OH, weil Br> OH
-CH 2 -CH 3> -CH 3 , weil C> H
Regel 3:
Doppel- und Dreifachbindungen werden so behandelt, als ob sie einfach wären und die Atome in der Kette verdoppeln bzw. verdreifachen.
. Isomerie von Zyklen und komplexen Systemen.
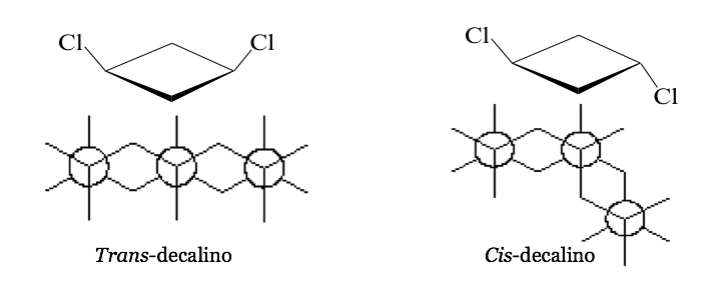
In einigen symmetrischen (mindestens disubstituierten) zyklischen Molekülen definieren die Atome des Zyklus eine Ebene. Ein Substituent liegt auf einer Seite dieser Ebene, während der andere auf der gleichen Seite oder auf der gegenüberliegenden Seite liegen kann.
cis -1,3-Dichlorcyclobutan trans- 1,3-Dichlorcyclobutan
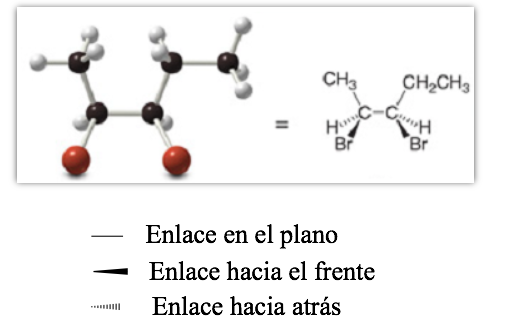
Projektive Darstellung (CRAM)
Perspektivische Darstellung
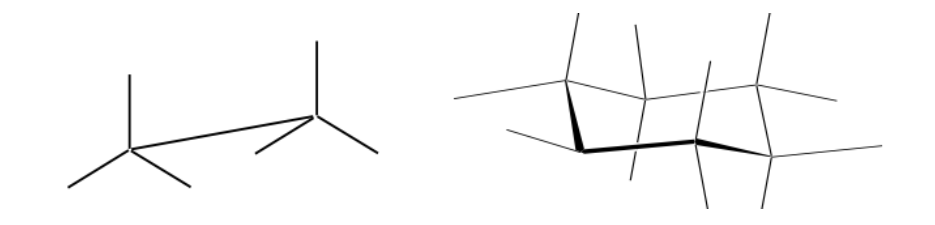
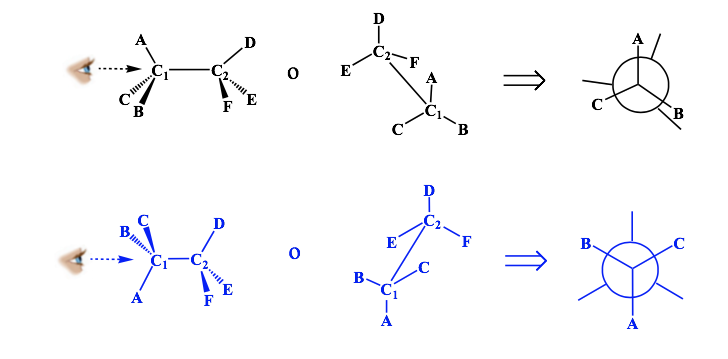
Newman-Vertretung
Eine Newman-Projektion ist eine Form der zweidimensionalen Darstellung, die zum Visualisieren von Konformationen in einer Kohlenstoff-Kohlenstoff-Einfachbindung in einem organischen Molekül nützlich ist.
Fischer Vertretung.
Die Fisher-Projektion ist eine Standardmethode zum Zeichnen von tetraedrischen Kohlenstoffatomen und ihren Substituenten in zwei Dimensionen.
In dieser Projektion wird jeder tetraedrische Kohlenstoff als Kreuz dargestellt, bei dem die horizontalen Linien aus dem Papier heraus und die vertikalen nach innen gerichtet sind.
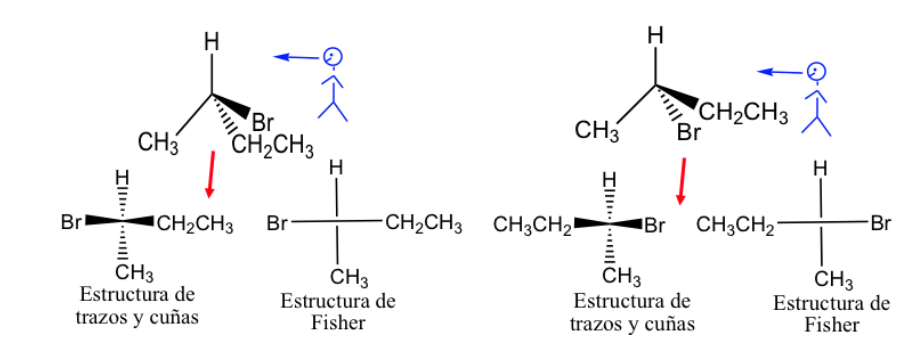
Die Fisher-Darstellung kann erfolgen, indem die Bindungen, die sich vor der Ebene befinden, mit einer dicken Linie und die Bindungen, die sich dahinter befinden, mit einer gestrichelten Linie markiert werden, aber im Allgemeinen werden die verschiedenen Bindungen mit normalen Linien dargestellt, obwohl es sich versteht, dass die Substituenten dargestellt werden rechts und links der vertikalen Linie liegen über der Darstellungsebene und die darüber und darunter Dargestellten liegen unter dieser Ebene.
Nach allgemeiner Konvention wird die Kohlenstoffkette vertikal dargestellt, wobei der am stärksten oxidierte Kohlenstoff an der Spitze steht.
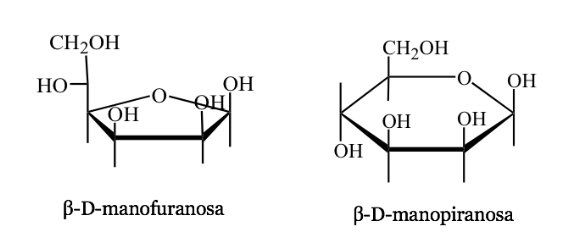
Harwoth-Vertretung
- Es ist eine perspektivische Darstellung der zyklischen Formen von Zuckermolekülen mit 5 oder 6 Atomen (Furanosen, Pyranosen).
- Z.B:
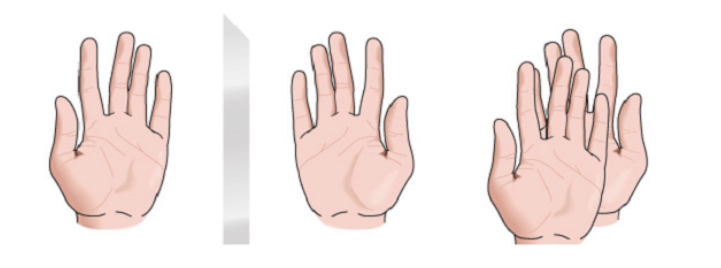
Chiralität
Jede geometrische Figur oder jede Gruppe von Punkten, deren Bild in einem ideal realisierten Planspiegel nicht mit sich selbst zur Deckung gebracht werden kann, heißt chiral. Einige Moleküle sind wie Hände. Die Linke ist das Spiegelbild der Rechten, aber sie sind nicht überlagerbar und daher nicht identisch. Sie werden als chiral bezeichnet.
Es gibt andere Moleküle, die einem Paar Socken ähneln. Die Socken sind Spiegelbilder voneinander und können auch übereinandergelegt werden.
Ein Molekül oder ein Objekt, das seinem Spiegelbild überlagert werden kann, wird achiral genannt.
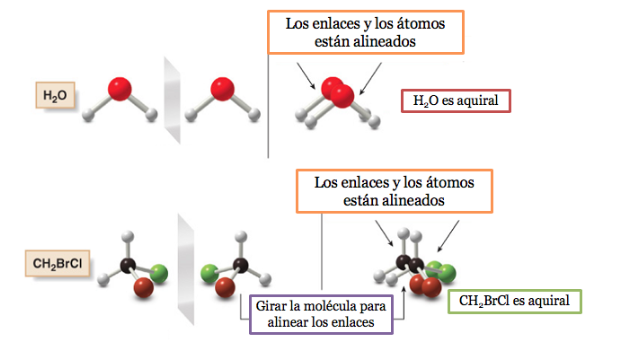
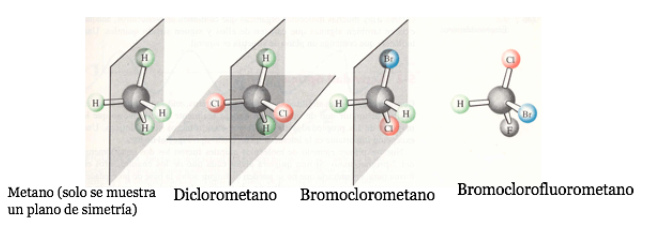
Besitzt ein Molekül eine Symmetrieebene, handelt es sich um ein achirales System.
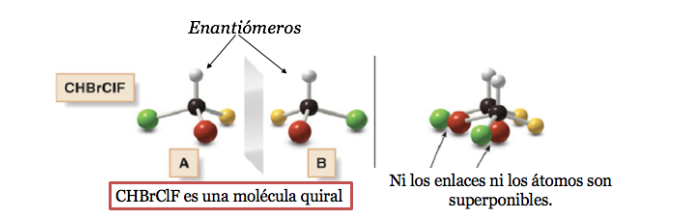
Ein chirales Molekül existiert in zwei stereoisomeren Formen, die als Enantiomere bezeichnet werden. Dies sind nicht überlagerbare Objekte mit ihren Spiegelbildern.
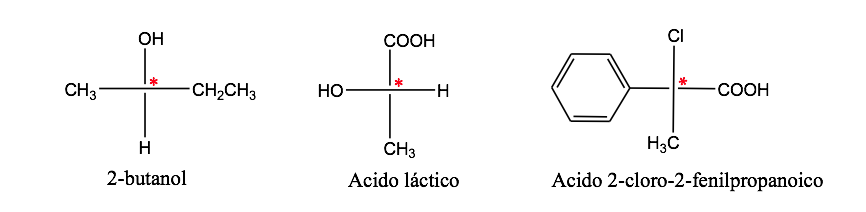
Ein Kohlenstoffatom, das an 4 verschiedene Substituenten gebunden ist, wird als asymmetrisches Kohlenstoffatom bezeichnet. Seine Existenz ist jedoch keine Garantie für Chiralität (wie später zu sehen sein wird). Auch stereogener Kohlenstoff oder Stereozentrum genannt.
optische Isomerie
Die physikalischen Eigenschaften zweier Enantiomere sind identisch: Sie haben dieselben Siede- und Schmelzpunkte, dieselbe Löslichkeit, dieselbe Dichte, denselben Brechungsindex, dieselbe Leitfähigkeit usw.
Die optische Aktivität der Enantiomerenpaare ist die charakteristische Eigenschaft, um sie zu unterscheiden.
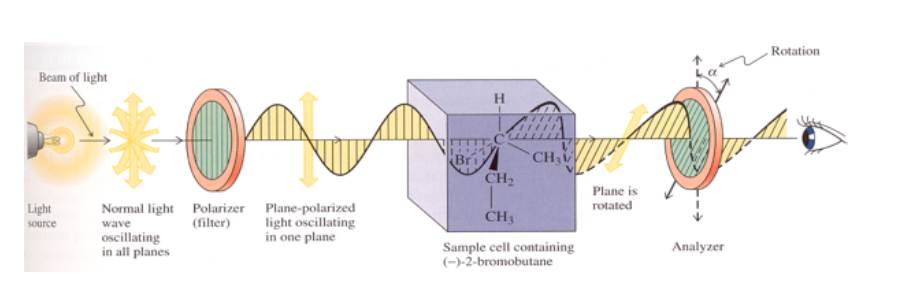
Wenn die Substanz nicht optisch aktiv ist, wird keine Änderung der Schwingungsebene des emittierten polarisierten Lichts beobachtet.
Wenn die Substanz optisch aktiv ist, wird eine Drehung der Schwingungsebene des emittierten polarisierten Lichts um zwei Grad beobachtet.
Ist die Drehung der Lichtebene nach rechts (gleichzeitig im Uhrzeigersinn), ist die Substanz rechtsdrehend und dem Wert α wird ein positives Vorzeichen zugeordnet.
Bei Drehung nach links (gegen den Uhrzeigersinn) ist die Substanz linkshändig und α erhält ein negatives Vorzeichen.
Die spezifische Drehung eines optisch aktiven Moleküls ist eine charakteristische physikalische Konstante dieses Moleküls.

Spezifische Rotation einiger chiraler Verbindungen
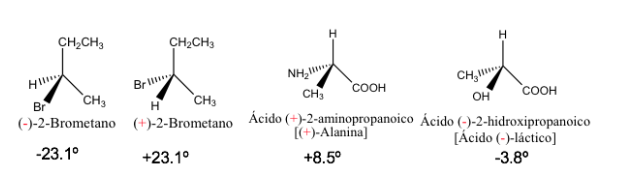
Die reinen Enantiomere haben den gleichen Wert der spezifischen Drehung, jedoch mit entgegengesetztem Vorzeichen.
Daher ist die resultierende optische Drehung einer 1:1-Mischung von Enantiomeren null, dh sie ist optisch inaktiv. Diese Art von Mischung wird als Racemat oder racemische Mischung bezeichnet.
Die Benennung der absoluten Konfiguration eines stereogenen Zentrums basiert auf den gleichen Prioritätsregeln, die von Cahn, Ingold und Prelog entwickelt wurden.
Diese Regeln erlauben die Benennung und Beschreibung der räumlichen Anordnung von Substituenten an einem stereogenen Zentrum, unabhängig vom Vorzeichen der optischen Drehung des Moleküls.
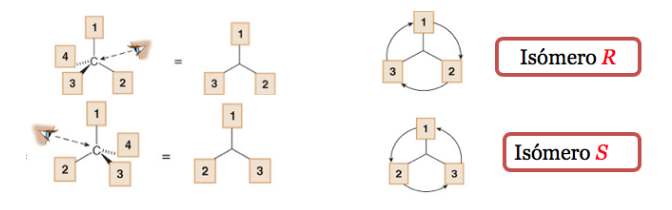
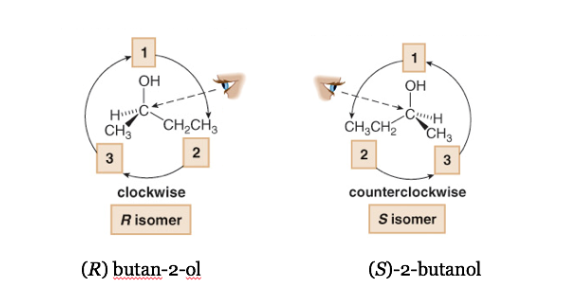
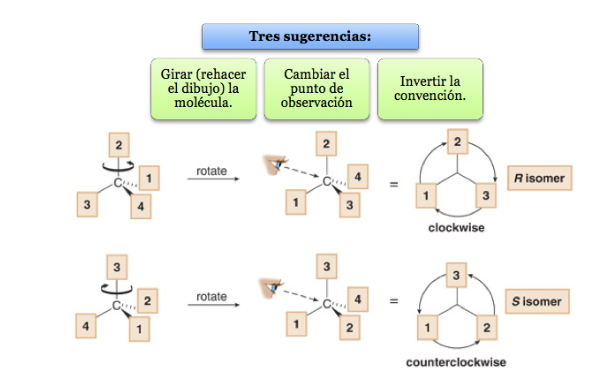
Der Substituent mit der niedrigsten Priorität befindet sich so weit wie möglich vom Beobachter entfernt.
Wenn der Schritt von 1 nach 2 nach 3 im Uhrzeigersinn erfolgt, ist das Chiralitätszentrum R (rectus, lateinisch, rechts).
Wenn die Schritte 1 bis 2 bis 3 gegen den Uhrzeigersinn ausgeführt werden, heißt die Konfiguration des Chiralitätszentrums S (finster, lateinisch, links).
In der systematischen Nomenklatur werden R oder S in Klammern als Präfix zum Namen der chiralen Verbindung hinzugefügt.
Es ist wichtig, sich daran zu erinnern, dass die Symbole R und S keinerlei Korrelation mit dem Vorzeichen von α aufweisen.
Was tun, wenn ein Molekül nicht so ausgerichtet ist, dass die Gruppe mit der niedrigsten Priorität weit entfernt ist?
Eine Verbindung mit n stereogenen Zentren hat maximal 2 n Stereoisomere.
Beispiel:
Eine Verbindung mit zwei stereogenen Zentren hat maximal 4 Stereoisomere.
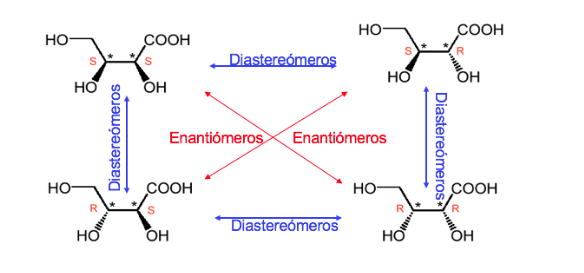
Jedes Stereoisomer, dessen Molekül nicht chiral ist, obwohl es stereogene Zentren hat, wird als meso- Form oder -Verbindung bezeichnet.
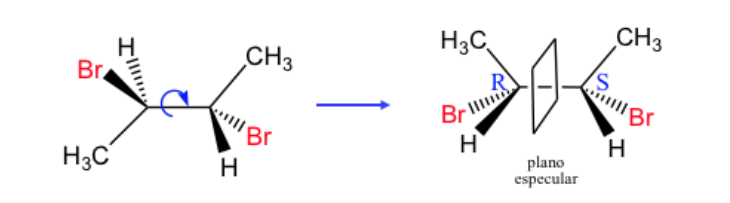
Eine Verbindung mit zwei asymmetrischen Kohlenstoffen wird dominiert , wenn die beiden Kohlenstoffe die gleiche absolute Konfiguration haben und anders als im umgekehrten Fall.
erythro- und threo-Verbindungen
Wenn zwei Kohlenstoffe mindestens zwei identische Substituenten haben, kann die Bezeichnung threo und erythro verwendet werden.
Ein erythro-Enantiomerenpaar ist eines, bei dem identische Gruppen in der verdeckten Position platziert werden können.
Es besteht keine direkte Beziehung zwischen der R- und S- Nomenklatur und der Erythro/Treo-Nomenklatur.
Wenn zwei Kohlenstoffe drei identische Substituenten haben, ist die Erythro-Form meso , da sie eine Symmetrieebene darstellt.
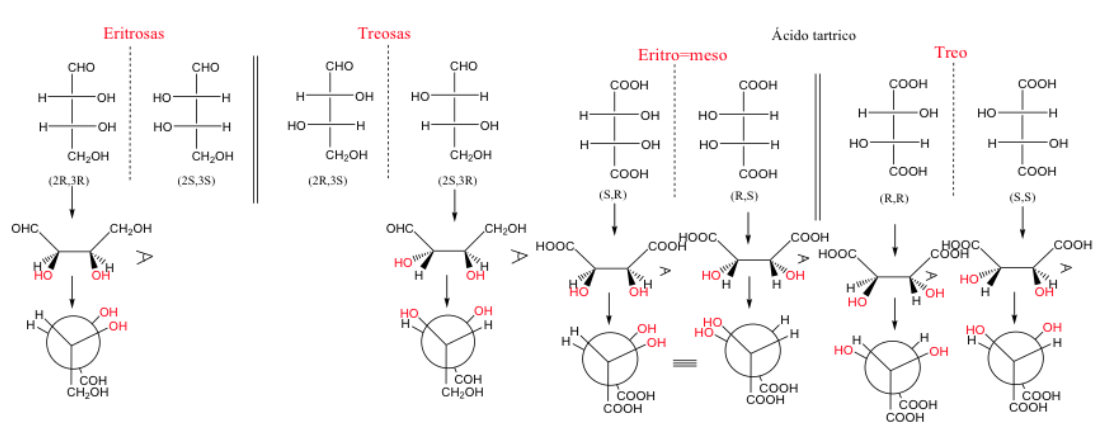
Ein Molekül wird als Erythro bezeichnet, wenn sich in seiner Fischer-Darstellung gleiche oder ähnliche Gruppen auf derselben Seite befinden.
Ein Molekül ist drei, wenn diese Gruppen auf gegenüberliegenden Seiten sind.
(allgemein für Zucker (Osas) verwendet)
Es ist eine Nomenklatur, die älter ist als die R- und S- Nomenklatur.
Ein Zucker wird D genannt, wenn sich in der Fischer-Projektion (mit dem am stärksten oxidierten Kohlenstoff oben) das Hydroxyl, das mit dem asymmetrischen Kohlenstoff mit der höchsten Nummer verbunden ist, rechts befindet.
Sein Enantiomer wird L genannt und hat das OH-Äquivalent auf der linken Seite.
Glucose und Fructose kommen in ihrer natürlichen Form als D.
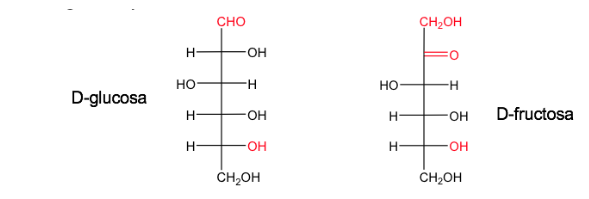
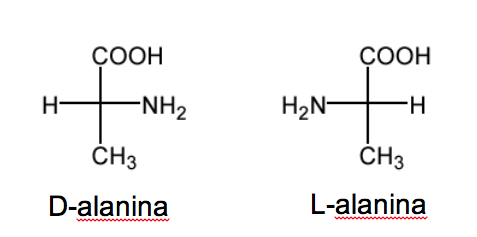
Die D/L-Nomenklatur wird auch in der Reihe der Aminosäuren verwendet.
RCH( NH2 )COOH.
Bei Zuckern hängt diese Nomenklatur von der Position der Hydroxylgruppe ab. In diesem Fall bestimmt die Position der Aminogruppe die Nomenklatur. Wenn in der Fisher-Projektion (mit dem am stärksten oxidierten Kohlenstoff oben) die NH 2 -Gruppe rechts ist, ist das Ethereoisomer D und sein Enantiomer ist L .
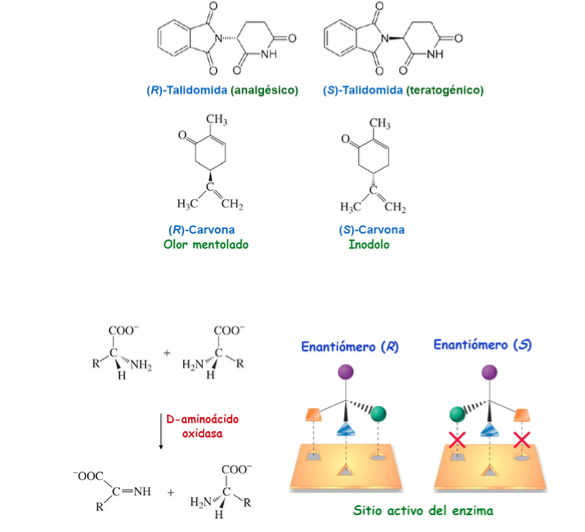
Bedeutung der Chiralität
Quellen zur Erweiterung der Wissenssuche:
1) Juaristi E. „Einführung in die Stereochemie und Konformationsanalyse“. CINVESTAV, Mexiko, 1988 Juaristi E. . CINVESTAV, Mexiko, 1994.
2) Neil SI „Physical Organic Chemistry“ Longman, Mailand, 1995.
3) March J., „Advanced Organic Chemistry“, John Wiley & Sons, New York, 1992 4) Jones RAY „Physical and Mechanistic Organic Chemistry“, 2nd. Ed Cambridge University Press, Cambridge, 1984.
5) Woodward RB und Hoffmann R. „Die Erhaltung der Orbitalsymmetrie“, Academic Press, New York, 1979.
6) Carpenter BK „Bestimmung organischer Reaktionsmechanismen“, John Wiley & Sons, New York, 1984.