Stéréochimie
La stéréochimie est l'étude des composés organiques dans l'espace. Pour comprendre les propriétés des composés organiques, il est nécessaire de considérer les trois dimensions spatiales. Les bases de la stéréochimie ont été posées par Jacobus van't Hoff et Le Bel, en 1874, ainsi que par Ernest L. Eliel au XXe siècle. Ils ont proposé indépendamment que les quatre substituants sur un point de carbone vers les sommets d'un tétraèdre, avec le carbone au centre du tétraèdre.
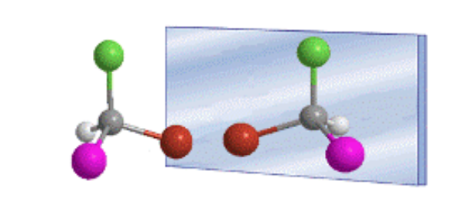
L'arrangement tétraédrique des substituants sur un carbone sp 3 donne lieu à l'existence de deux composés possibles, qui sont des images miroir non superposables, appelés énantiomères.
En général, les molécules qui diffèrent par la disposition spatiale de leurs atomes sont appelées stéréoisomères.
Isomérie
Les isomères sont des composés qui ont des formules moléculaires identiques mais qui diffèrent par la nature ou la disposition des liaisons entre leurs atomes ou par la disposition de leurs atomes dans l'espace.
Pour interpréter les différences de propriétés, les chimistes du siècle dernier ont imaginé que les atomes d'une molécule avaient des arrangements spatiaux particuliers qui rendaient compte de leurs différents comportements.
La classification par fonction chimique, établie selon le comportement des composés, a été liée à la présence dans la molécule d'un groupe d'atomes appelé groupe fonctionnel.
Outre l'importance du groupement fonctionnel, il existe une différence de comportement induite par de légères différences dans l'arrangement des différents atomes qui composent le reste de la molécule. Ces différences peuvent répondre à différentes classes d'isomérie :
isomérie de la fonction
Les isomères constitutionnels, qui diffèrent les uns des autres en ce que leurs groupes fonctionnels sont différents, appartiennent à ce type d'isomérie.
Le groupe fonctionnel des deux isomères est différent
C2H6O _
Éthanol (CH 3 -CH 2 -OH) et éther diméthylique (CH 3 -O-CH 3 )
L'alcool réagit avec le sodium alors qu'avec l'éther aucune réaction n'est observée.
D'un point de vue physique, l'alcool est un liquide dont le point d'ébullition est de 78,5°C, tandis que l'éther est un gaz qui se liquéfie à -23°C.
Isomérie de position et/ou de squelette.
Les groupes fonctionnels sont identiques mais sont placés à des positions différentes sur le squelette moléculaire (isomères de position).
Ex : 2-hexanol et 3-hexanol :
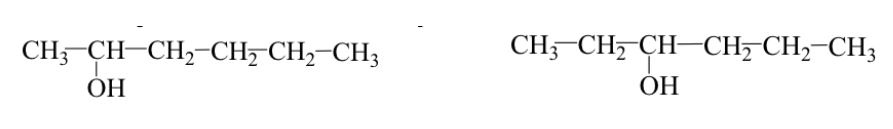
Parfois, le groupe alkyle a une disposition différente (squelette ou isomères de ramification).
Ex : 3-méthyl-2-pentanol et 2-hexanol
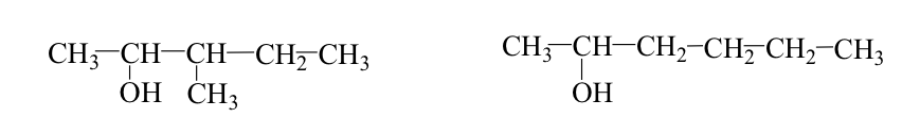
Les deux cas peuvent se produire simultanément :
Ex : 3-méthyl-2-pentanol et 3-hexanol
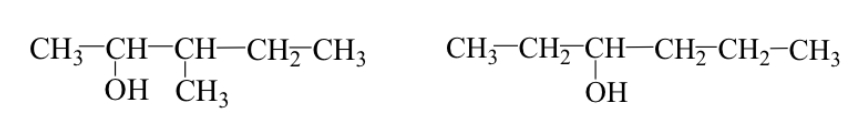
tautomérie
Ce sont des isomères constitutionnels d'interconversion facile car ils sont en équilibre rapide les uns avec les autres. Le phénomène est appelé tautomérie et se compose généralement d'un atome, généralement d'hydrogène, situé dans une triade d'atomes, et d'une double liaison changeant de position simultanément.
L'exemple le plus classique est l'équilibre céto-énol ( -ène pour la double liaison et -ol pour l'alcool).
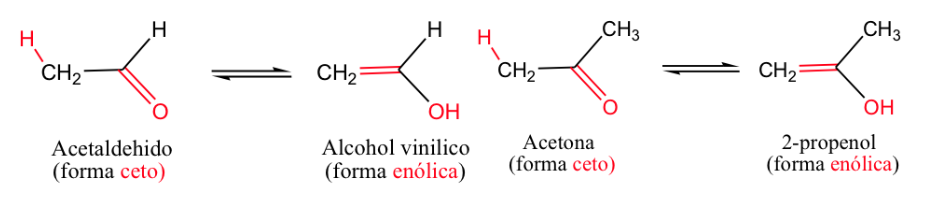
Généralement, les formes cétones sont les plus stables, mais lorsque la forme énol se stabilise (par liaison hydrogène ou par résonance) l'équilibre se déplace.
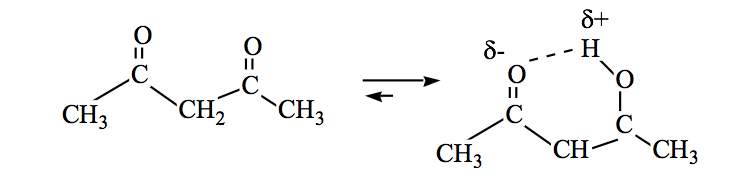
Les amides peuvent également être en équilibre céto-énol :
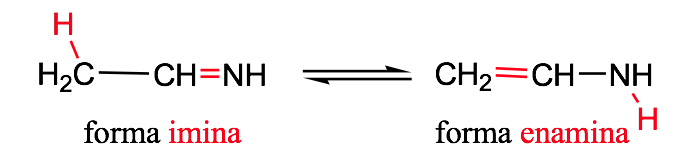
Tautomérie imine-énamine :
nitro-aci
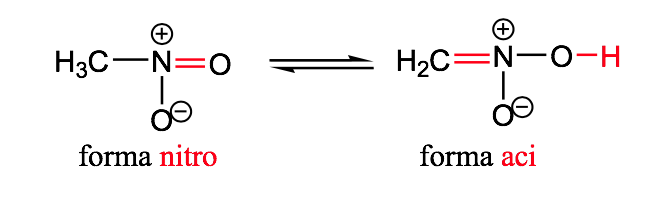
isomérie géométrique
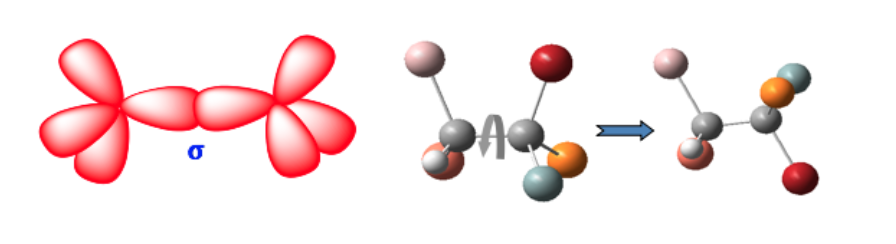
Ces deux formes ne sont pas des isomères géométriques puisque la rotation libre autour de la liaison simple convertit une forme en une autre (conformistes).
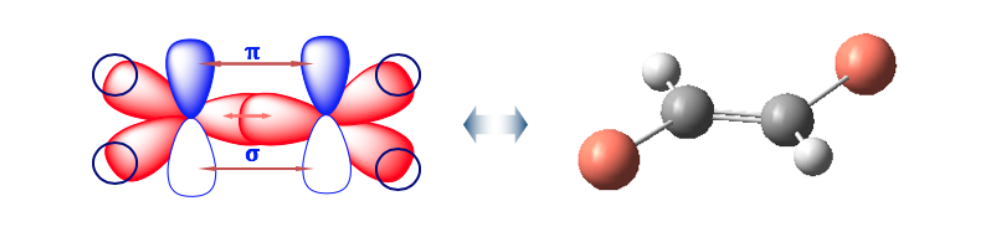
La double liaison ne permet pas la libre rotation, ce qui peut générer deux structures différentes selon la position des groupes A et B dans l'espace : ce sont des isomères géométriques .
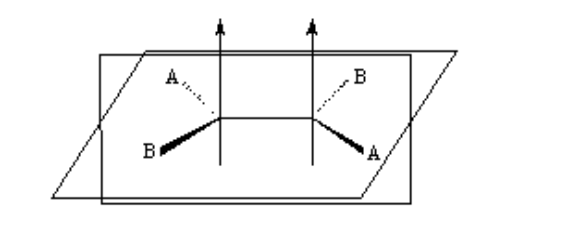
isomérie dans les alcènes
Pour qu'une isomérie géométrique existe, deux conditions doivent être remplies :
1.- Rotation entravée (par exemple par une double liaison)
2.- Deux groupes différents (A et B) attachés des deux côtés du lien
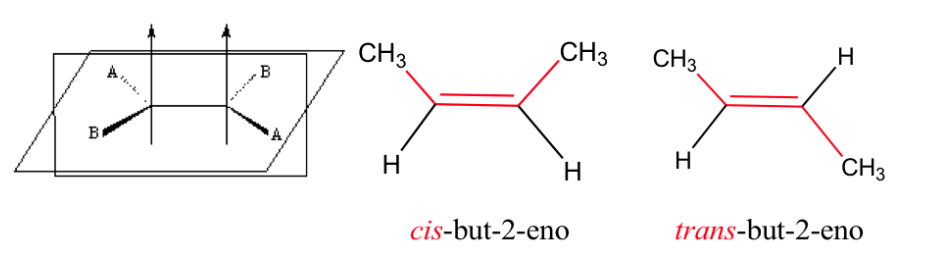
Effet de l'isomérie géométrique sur les propriétés physiques

Nomenclature géométrique des isomères
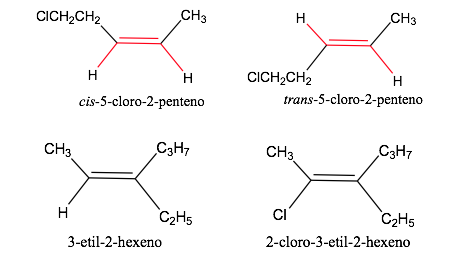 Règles de séquence ou de priorité
Règles de séquence ou de priorité
Les règles dont il faut tenir compte pour établir l'ordre de priorité ou de préférence des atomes ou groupes d'atomes ont été établies en 1956 par Cahn , Ingold et Prelog et modifiées plusieurs fois pour éviter les ambiguïtés.
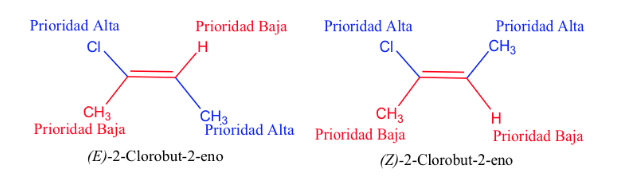
Lorsque les groupes hautement prioritaires se trouvent sur les côtés opposés du plan perpendiculaire à la molécule, l'isomère est appelé E.
Lorsqu'ils sont du même côté de ce plan, l'isomère est appelé Z.
Exemple : but-2-ène :
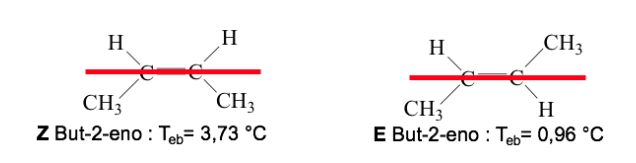
La priorité des substituants sur les carbones de la double liaison peut être déduite des règles suivantes :
- Règle 1:
- Si les atomes attachés à l'atome de carbone étudié sont différents, ceux qui ont le numéro atomique le plus élevé ont priorité sur ceux qui ont le numéro atomique le plus bas et s'il y a deux isotopes, ils sont considérés par ordre décroissant de masse atomique.
Ex : Br (35)> Cl (17)> O (8)> N (7)> C (6)> H (1)
D> H et 13 C> 12 C
Règle 2 :
Lorsque les atomes attachés à l'atome de carbone sont identiques (et que la première règle ne fonctionne pas), la séquence est suivie, c'est-à-dire que les atomes qui leur sont attachés sont comparés et, si nécessaire parce qu'ils étaient également égaux, les atomes qui leur sont attachés sont utilisés, suivants, etc., en tenant compte du fait que si les atomes sont identiques mais en nombre différent, le substituant avec plus d'atomes de rang supérieur a la priorité.
Ex : -CH 2 -OH> -CH 3 car O> H
-CH 2 -Br> -CH 2 -OH car Br> OH
-CH 2 -CH 3> -CH 3 car C> H
Règle 3 :
Les doubles et triples liaisons sont traitées comme si elles étaient respectivement simples, doublant ou triplant les atomes de la chaîne.
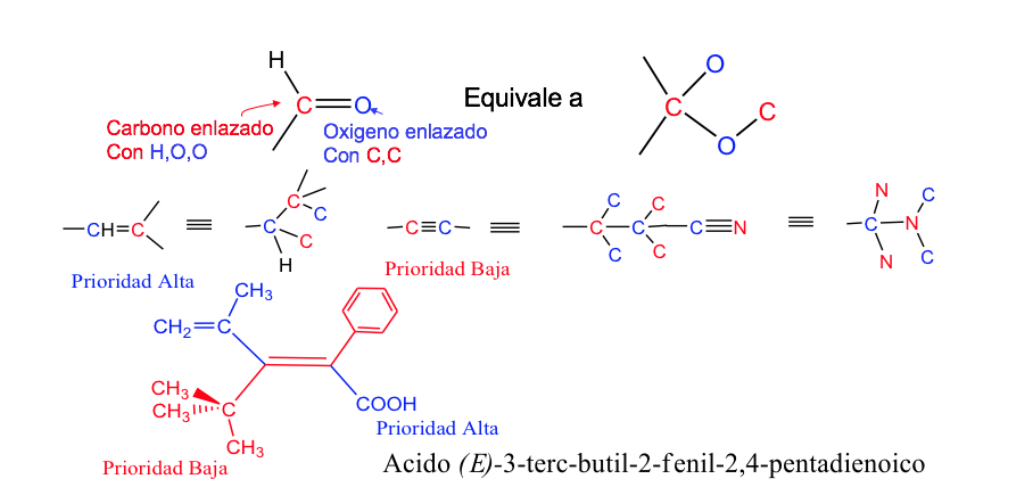
. Isomérie des cycles et des systèmes complexes.
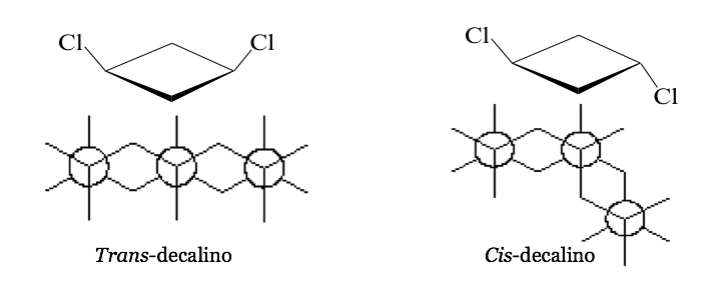
Dans certaines molécules cycliques symétriques (au moins disubstituées), les atomes du cycle définissent un plan. Un substituant se trouve vers une face de ce plan tandis que l'autre peut se trouver vers le même côté ou vers le côté opposé.
cis- 1,3-Dichlorocyclobutane trans- 1,3-Dichlorocyclobutane
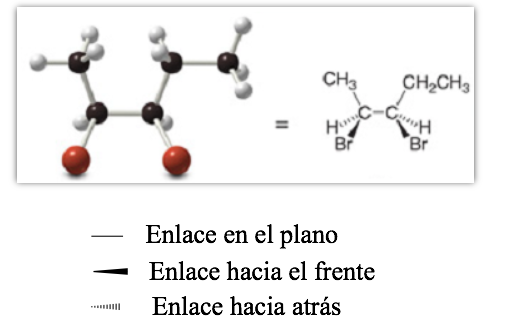
Représentation projective (CRAM)
représentation en perspective
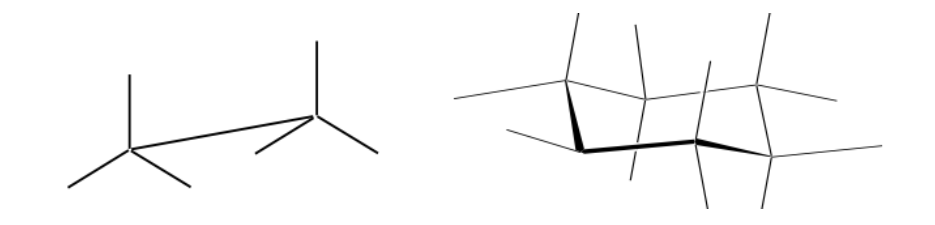
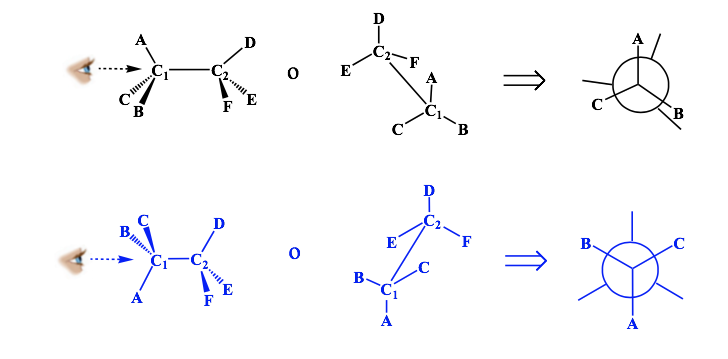
Représentation de Newman
Une projection de Newman est une forme de représentation bidimensionnelle utile pour visualiser les conformations d'une simple liaison carbone-carbone dans une molécule organique.
Représentation de Fisher.
La projection de Fisher est un moyen standard de dessiner des atomes de carbone tétraédriques et leurs substituants en deux dimensions.
Dans cette projection, chaque carbone tétraédrique est représenté par une croix dans laquelle les lignes horizontales sont dirigées vers l'extérieur du papier et les verticales vers l'intérieur.
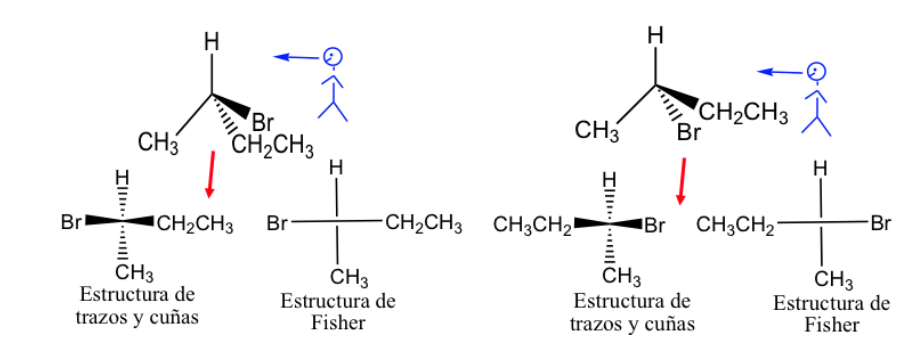
La représentation de Fisher peut se faire en marquant les liens qui sont devant le plan d'un trait épais et ceux situés derrière d'un trait pointillé, mais généralement les différents liens sont présentés avec des traits normaux, bien qu'il soit entendu que les substituants représentés à la droite et la gauche de la ligne verticale sont au-dessus du plan de représentation et celles représentées au-dessus et au-dessous sont en dessous de ce plan.
Par convention générale, la chaîne carbonée est présentée verticalement, mettant le carbone le plus oxydé au sommet.
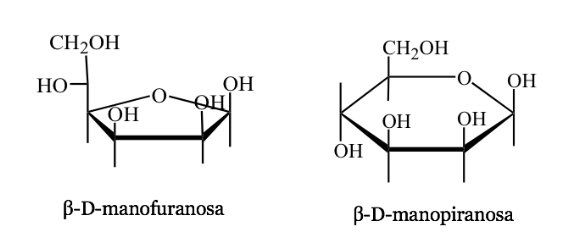
Représentation d'Harwoth
- C'est une représentation en perspective des formes cycliques des molécules de sucre à 5 ou 6 atomes (furanoses, pyranoses).
- Par exemple:
chiralité
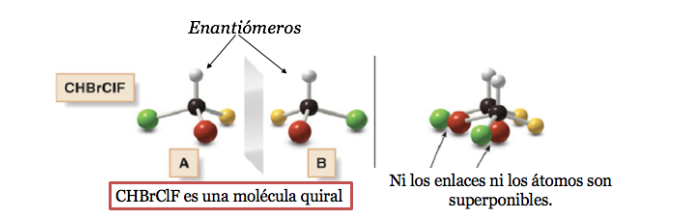
Toute figure géométrique, ou tout groupe de points, dont l'image dans un miroir plan, idéalement réalisé, ne peut être faite coïncider avec elle-même, est dite chirale. Certaines molécules sont comme des mains. La gauche est l'image miroir de la droite mais elles ne sont pas superposables et donc pas identiques. Ils sont dits chiraux .
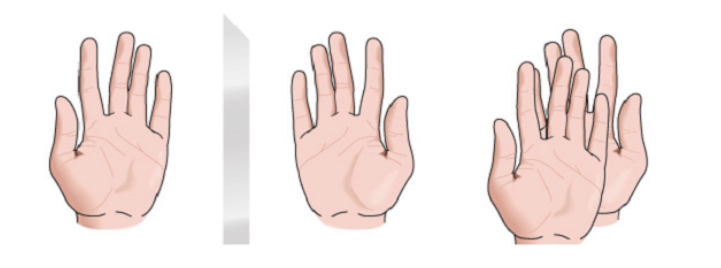
Il existe d'autres molécules similaires à une paire de chaussettes. Les chaussettes sont des images miroir les unes des autres et sont également superposables.
Une molécule ou un objet superposable à son image miroir est dit achiral .
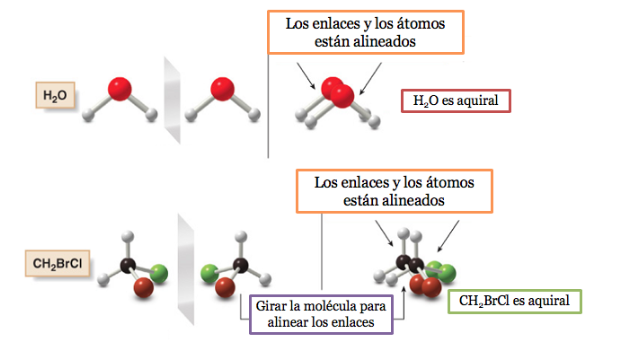
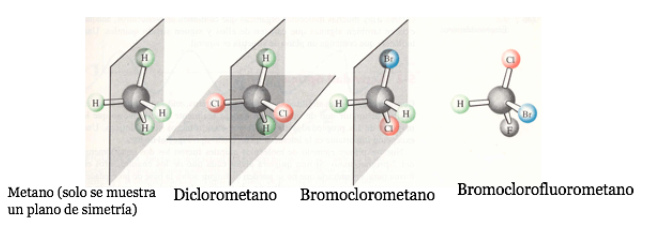
Si une molécule a un plan de symétrie, c'est un système achiral.
Une molécule chirale existe sous deux formes stéréoisomères appelées énantiomères . Ce sont des objets non superposables avec leurs images miroir.
Un atome de carbone attaché à 4 substituants différents est appelé un carbone asymétrique . Cependant, son existence n'est pas une garantie de chiralité (comme on le verra plus loin). Aussi appelé carbone stéréogénique ou stéréocentre.
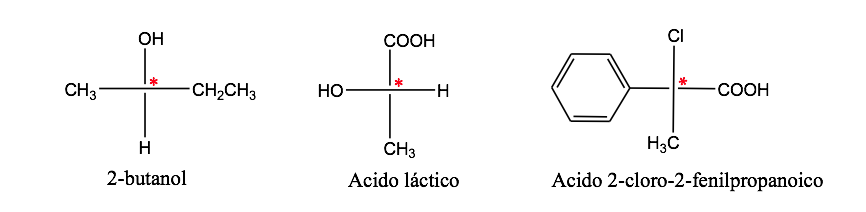
isomérie optique
Les propriétés physiques de deux énantiomères sont identiques : ils ont les mêmes points d'ébullition et de fusion, la même solubilité, la même densité, le même indice de réfraction, la même conductivité...etc.
L'activité optique des paires d'énantiomères est la propriété caractéristique de les différencier.
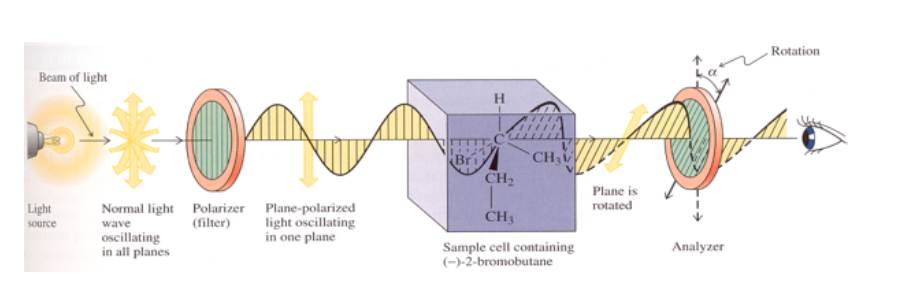
Si la substance n'est pas optiquement active, aucune modification du plan de vibration de la lumière polarisée émise n'est observée.
Si la substance a une activité optique, on observe une rotation de à degrés du plan de vibration de la lumière polarisée émise.
Si la rotation du plan de la lumière est vers la droite (dans le même sens des aiguilles d'une montre), la substance est dextrogyre et la valeur α est affectée d'un signe positif.
Si la rotation est vers la gauche (sens antihoraire), la substance est gaucher et α est affecté d'un signe négatif.
La rotation spécifique d'une molécule optiquement active est une constante physique caractéristique de cette molécule.

Rotation spécifique de certains composés chiraux
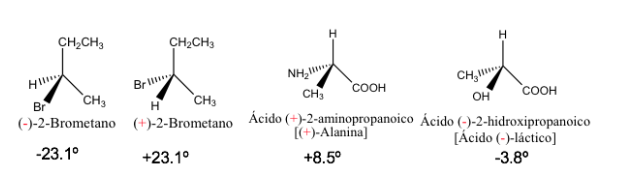
Les énantiomères purs ont la même valeur de rotation spécifique mais de signe opposé.
Par conséquent, la rotation optique résultante d'un mélange 1:1 d'énantiomères est nulle, c'est-à-dire qu'elle est optiquement inactive. Ce type de mélange est appelé racémate ou mélange racémique .
La dénomination de la configuration absolue d'un centre stéréogène est basée sur les mêmes règles de priorité développées par Cahn, Ingold et Prelog .
Ces règles permettent de nommer et de décrire l'arrangement dans l'espace des substituants sur un centre stéréogène, quel que soit le signe du pouvoir rotatoire de la molécule.
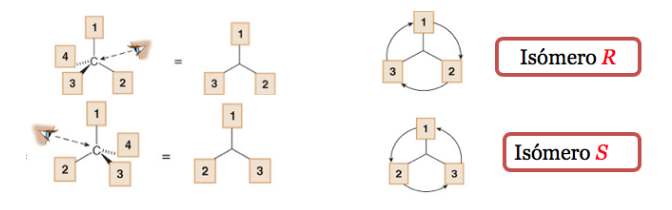
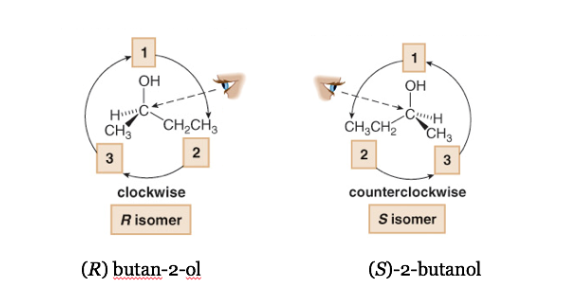
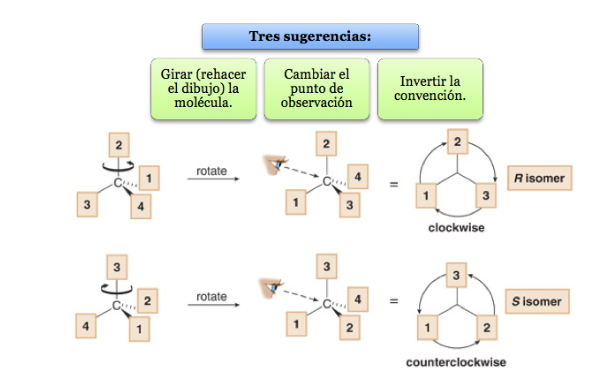
Le substituant le moins prioritaire est situé aussi loin que possible de l'observateur.
Si le pas de 1 à 2 à 3 se fait dans le sens des aiguilles d'une montre, le centre chiral est R (rectus, latin, droite).
Si l'étape 1 à 2 à 3 se fait dans le sens inverse des aiguilles d'une montre, la configuration du centre chiral est appelée S (sinistre, latin, gauche).
Dans la nomenclature systématique, R ou S sont ajoutés entre parenthèses comme préfixe au nom du composé chiral.
Il est important de se rappeler que les symboles R et S ne présentent aucune sorte de corrélation avec le signe de α .
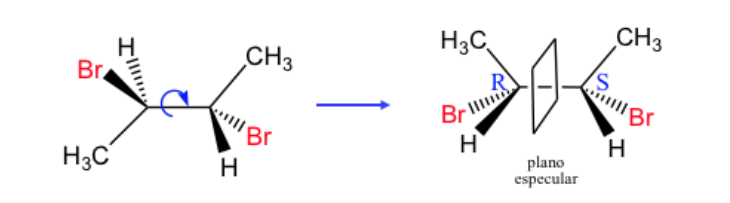
Que faire lorsqu'une molécule n'est pas orientée de manière à ce que le groupe le moins prioritaire soit éloigné ?
Un composé avec n centres stéréogènes a un maximum de 2 n stéréoisomères.
Exemple:
Un composé avec deux centres stéréogènes a un maximum de 4 stéréoisomères.
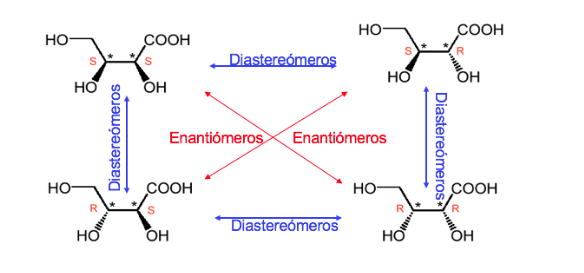
Tout stéréoisomère dont la molécule n'est pas chirale malgré ses centres stéréogènes est appelé forme ou composé méso .
Un composé à deux carbones asymétriques est dominé comme lorsque les deux carbones ont la même configuration absolue et contrairement dans le cas contraire.
composés érythro et thréo
Lorsque deux carbones ont au moins deux substituants identiques, la désignation thréo et érythro peut être utilisée.
Une paire d'énantiomères érythro est une paire dans laquelle des groupes identiques peuvent être placés en position éclipsée.
Il n'y a pas de relation directe entre la nomenclature R et S et la nomenclature Erythro/Treo.
Lorsque deux carbones ont trois substituants identiques, la forme érythro est méso car elle présente un plan de symétrie.
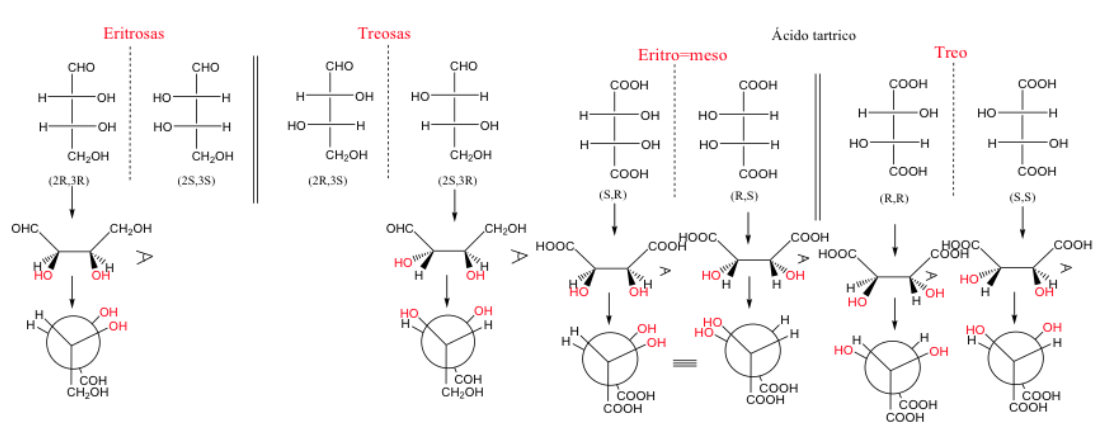
Une molécule est appelée érythro lorsque, dans sa représentation de Fischer, des groupes identiques ou similaires se trouvent du même côté.
Une molécule est trois si ces groupes sont sur des côtés opposés.
(généralement utilisé pour les sucres (osas))
C'est une nomenclature antérieure à la nomenclature R et S.
Un sucre est nommé D lorsque, dans la projection de Fischer (avec le carbone le plus oxydé situé en haut), l'hydroxyle associé au carbone asymétrique numéroté le plus élevé est à droite.
Son énantiomère s'appellera L et aura l'équivalent OH à gauche.
Le glucose et le fructose sous leurs formes naturelles existent sous le nom de D.
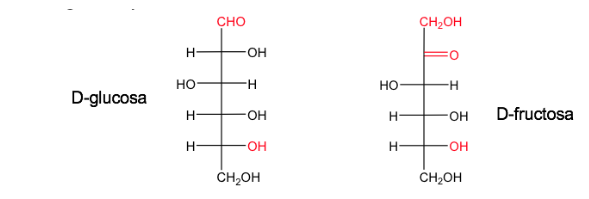
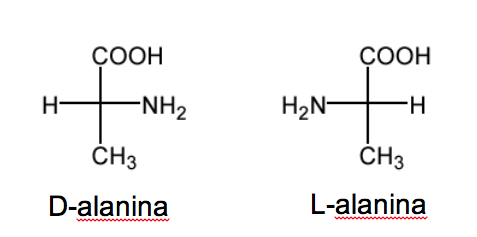
La nomenclature D/L est également utilisée dans la série des acides aminés.
RCH( NH2 )COOH.
Dans les sucres, cette nomenclature dépend de la position de l'hydroxyle. Dans ce cas c'est la position du groupe amino qui définit la nomenclature. Lorsque dans la projection de Fisher (avec le carbone le plus oxydé en haut), le groupe NH 2 est à droite, l'étheroisomère est D et son énantiomère est L .
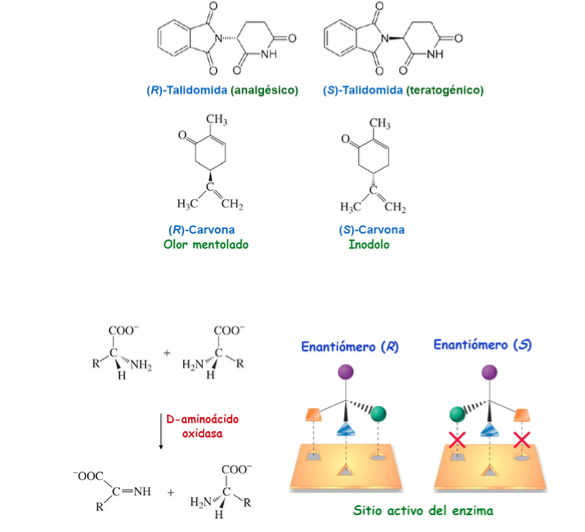
Importance de la chiralité
Sources pour élargir la recherche de connaissances :
1) Juaristi E. "Introduction à la stéréochimie et à l'analyse conformationnelle". CINVESTAV, Mexique, 1988 Juaristi E. . CINVESTAV, Mexique, 1994.
2) Neil SI "Chimie organique physique" Longman, Milan, 1995.
3) March J., "Advanced Organic Chemistry" John Wiley & Sons, New York, 1992 4) Jones RAY "Physical and Mechanistic Organic Chemistry", 2nd. Ed Cambridge University Press, Cambridge, 1984.
5) Woodward RB et Hoffmann R. "La conservation de la symétrie orbitale", Academic Press, New York, 1979.
6) Carpenter BK "Détermination des mécanismes de réaction organique", John Wiley & Sons, New York, 1984 .