SCHWEFEL, PHOSPHOR UND SILIKON
- Details
- Germán Fernández
- SCHWEFEL, PHOSPHOR UND SILIKON
- Zugriffe: 3178
Thiole sind dadurch gekennzeichnet, dass sie die funktionelle -SH-Gruppe enthalten. Sie werden benannt, indem der Hauptkettenname auf -thiol endet, analog zu Alkoholen, deren Endung -ol ist
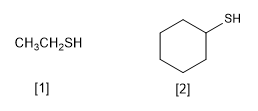
[1] Ethanothiol
[2] Cyclohexanthiol
Thiole haben aufgrund der größeren Schwefelgröße im Vergleich zu Sauerstoff einen höheren Säuregehalt als Alkohole. Die pKa-Werte liegen bei etwa 10-11, verglichen mit Alkoholen, die Werte zwischen 16-18 haben.
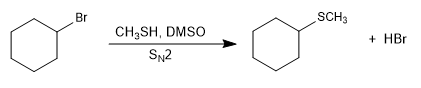
- Details
- Germán Fernández
- SCHWEFEL, PHOSPHOR UND SILIKON
- Zugriffe: 2998
Es handelt sich um etherähnliche Verbindungen, bei denen Sauerstoff durch Schwefel (RSR) ersetzt ist. Sie werden auch Sulfide genannt.
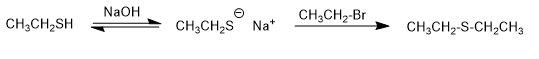
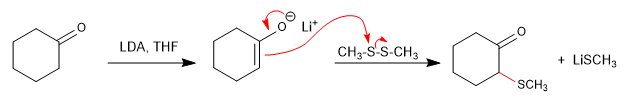
- Details
- Germán Fernández
- SCHWEFEL, PHOSPHOR UND SILIKON
- Zugriffe: 1680
Sulfoxide gehen unter leichtem Erhitzen Eliminierungsreaktionen ein, um Alkene zu bilden. Das Sulfoxid kann leicht durch Oxidation eines Thioethers hergestellt werden, der sich leicht an der alpha-Position eines Carbonyls aus einem Disulfid bilden lässt. Dieses Verfahren ermöglicht die Herstellung von α,β-ungesättigten Carbonylen.
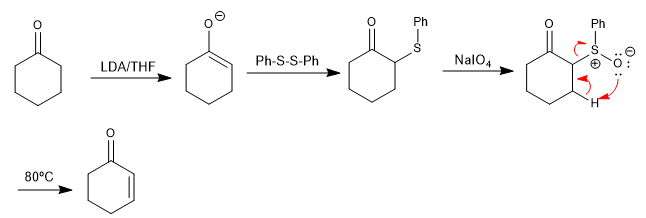
- Details
- Germán Fernández
- SCHWEFEL, PHOSPHOR UND SILIKON
- Zugriffe: 2456
Schwefelylide werden aus Thioethern durch Alkylierung und anschließende Deprotonierung hergestellt.
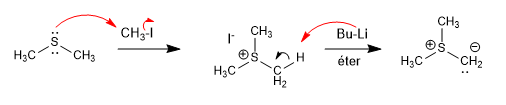
[1] Schwefelylid
- Details
- Germán Fernández
- SCHWEFEL, PHOSPHOR UND SILIKON
- Zugriffe: 3199
Die Reaktion von Carbonylen mit Thiolen bildet Thioacetale, die als Schutzgruppen oder zur Reduktion des Carbonyls zu einem Alkan verwendet werden können.
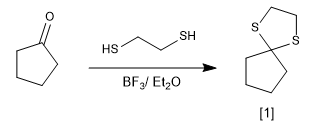
[1] Thioacetal
Thioacetal ist in sauren Medien stabil, kann aber mit Quecksilber(II)-Salzen hydrolysiert werden.
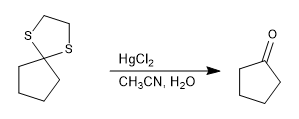
Weiterlesen: Thioacetale, Hydrolyse und Reduktion zu Alkanen
- Details
- Germán Fernández
- SCHWEFEL, PHOSPHOR UND SILIKON
- Zugriffe: 2564
Die 1,3-Dithiane ermöglichen es, die Polarität des Carbonylkohlenstoffs der Aldehyde durch Subtraktion des sauren Wasserstoffs zu ändern, wodurch ein Organolith erhalten wird, das in der Lage ist, eine Vielzahl von Elektrophilen anzugreifen.
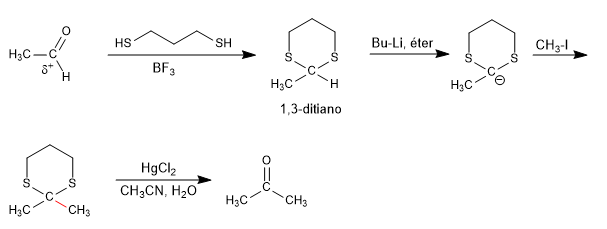
Das anfängliche Carbonyl, mit positiver Polarität am Kohlenstoff, wandelt sich bei der Umpolungsreaktion in ein Carboanion um. Die Schwefelatome von 1,3-Dithian sind entscheidend für die Stabilisierung der negativen Ladung, und die Reaktion mit dem sauerstoffhaltigen Äquivalent ist nicht durchführbar.
Weiterlesen: Synthese von 1,3-Dithianen. UMPOLUNG-Reaktionen
- Details
- Germán Fernández
- SCHWEFEL, PHOSPHOR UND SILIKON
- Zugriffe: 2203
Phosphine werden durch Umsetzung von Phosphortrichlorid mit metallorganischen Reagenzien erhalten. So reagiert Phosphortrichlorid mit Phenylmagnesiumbromid zu Triphenylphosphin.
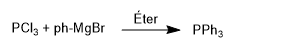
Diese Reaktion ist gut kontrolliert und ermöglicht die Einführung von nur zwei Gruppen.