SULFUR, FOSFOR DAN SILIKON
- Detail
- Germán Fernández
- SULFUR, FOSFOR DAN SILIKON
- Dilihat: 3496
Tiol ditandai dengan mengandung gugus fungsi -SH. Mereka diberi nama dengan mengakhiri nama rantai utama di -thiol, analog dengan alkohol yang diakhiri dengan -ol
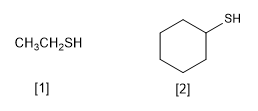
[1] Etanotiol
[2] Sikloheksanetiol
Tiol memiliki keasaman yang lebih tinggi daripada alkohol karena ukuran belerang yang lebih besar dibandingkan dengan oksigen. Nilai pKa sekitar 10-11, dibandingkan dengan alkohol yang memiliki nilai antara 16-18.
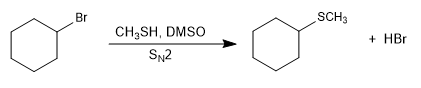
- Detail
- Germán Fernández
- SULFUR, FOSFOR DAN SILIKON
- Dilihat: 2892
Mereka adalah senyawa yang mirip dengan eter di mana oksigen digantikan oleh belerang (RSR). Mereka juga disebut sulfida.
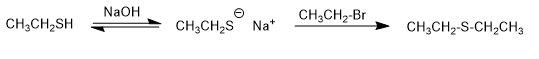
- Detail
- Germán Fernández
- SULFUR, FOSFOR DAN SILIKON
- Dilihat: 2062
Sulfoksida mengalami reaksi eliminasi, dengan sedikit pemanasan, untuk membentuk alkena. Suloksida dapat dengan mudah dibuat dengan oksidasi tioeter, yang mudah dibentuk pada posisi alfa karbonil dari disulfida. Prosedur ini memungkinkan pembuatan karbonil tak jenuh α,β.
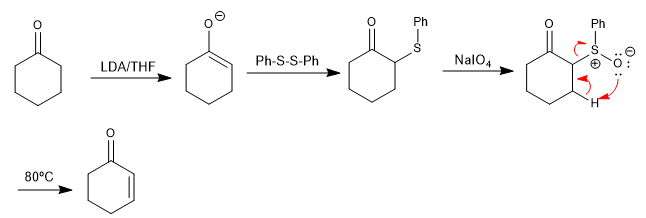
- Detail
- Germán Fernández
- SULFUR, FOSFOR DAN SILIKON
- Dilihat: 2644
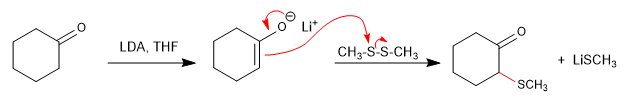
Silida belerang dibuat dari tioeter dengan alkilasi, diikuti dengan deprotonasi.
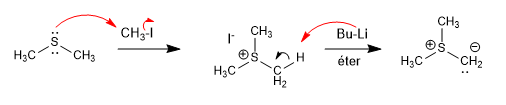
[1] Belerang ilida
- Detail
- Germán Fernández
- SULFUR, FOSFOR DAN SILIKON
- Dilihat: 2871
Reaksi karbonil dengan tiol membentuk tioasetal yang dapat digunakan sebagai gugus pelindung atau untuk mereduksi karbonil menjadi alkana.
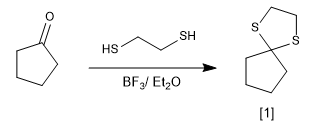
[1] Thioacetal
Tioasetal stabil dalam media asam tetapi dapat dihidrolisis dengan garam raksa(II).
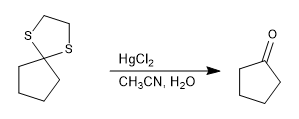
Selengkapnya: Tioasetal, hidrolisis dan reduksi menjadi alkana
- Detail
- Germán Fernández
- SULFUR, FOSFOR DAN SILIKON
- Dilihat: 3035
The 1,3-dithianes memungkinkan untuk mengubah polaritas karbon karbonil dari aldehida dengan pengurangan asam hidrogen, memperoleh organolitik yang mampu menyerang berbagai macam elektrofil.
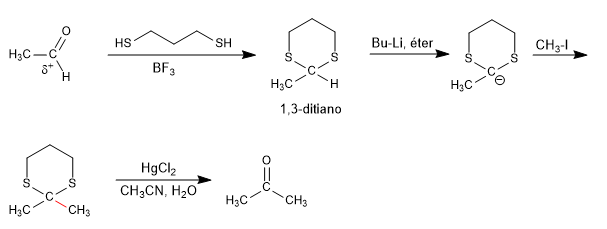
Karbonil awal, dengan polaritas positif pada karbon, berubah dalam reaksi umpolung menjadi karboanion. Belerang 1,3-dithiane sangat penting dalam menstabilkan muatan negatif, dan reaksi dengan ekivalen teroksigenasi tidak dapat berlangsung.
- Detail
- Germán Fernández
- SULFUR, FOSFOR DAN SILIKON
- Dilihat: 2747
Fosfin diperoleh dengan mereaksikan fosfor triklorida dengan reagen organologam. Jadi, fosfor triklorida bereaksi dengan fenilmagnesium bromida untuk membentuk trifenilfosfin.
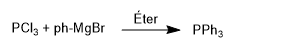
Reaksi ini dikontrol dengan baik dan hanya memungkinkan dua kelompok untuk diperkenalkan.