Alkohole sind amphotere (amphiprotische) Spezies, sie können als Säuren oder Basen wirken. In wässriger Lösung stellt sich ein Gleichgewicht zwischen Alkohol, Wasser und ihren konjugierten Basen ein.
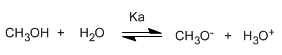
Schreiben der Gleichgewichtskonstante (Ka)
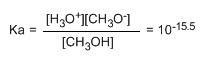
Der kleine Wert der Konstante sagt uns, dass das Gleichgewicht vollständig nach links verschoben ist. Der veränderte Logarithmus der Gleichgewichtskonstante ergibt den pKa-Wert von Methanol, ein Parameter, der den Säuregrad einer organischen Verbindung angibt.
pKa = - logka = 15,5
Eine Erhöhung des pKa impliziert eine Verringerung des Säuregehalts. So ist Methanol mit einem pka von 15,5 etwas saurer als Ethanol mit einem pka von 15,9.
Der pKa von Alkoholen wird durch einige Faktoren wie die Größe der Kohlenstoffkette und die elektronegativen Gruppen beeinflusst.
Mit zunehmender Kohlenstoffkettenlänge wird der Alkohol weniger sauer.
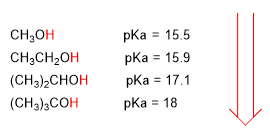
geringerer Säuregehalt
Elektronegative Gruppen (Halogene) erhöhen den Säuregehalt von Alkoholen (senken den pKa)
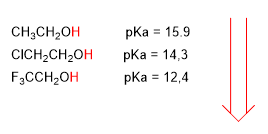
höherer Säuregehalt