Les oxiranes agissent comme des bases de Lewis, protonant sur l'oxygène en milieu acide. Le deuxième type de réactivité est lié à la déformation du cycle qui favorise les réactions d'ouverture.
Isomérisation en composés carbonylés : Les oxiranes en présence d'acides de Lewis s'isomérisent pour former des aldéhydes ou des cétones. Ainsi, l'oxirane en présence de BF 3 se transforme en acétaldéhyde
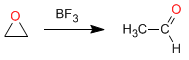
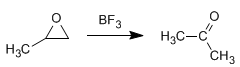
Exemple : Proposez un mécanisme pour la transformation suivante :
Solution - Le BF 3 protone l'oxygène de l'oxirane, le transformant en un bon groupe partant et favorisant l'ouverture du cycle. Un réarrangement en hydroxycarbocation donnera le produit attendu.
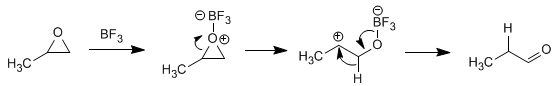
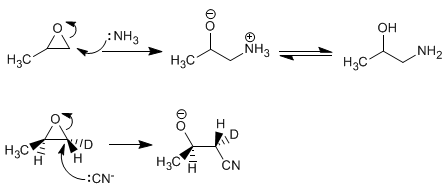
Ouverture des oxiranes en milieu basique - Les bons nucléophiles attaquent et ouvrent les oxiranes sur le carbone le moins substitué. Le mécanisme d'ouverture est de type S N 2 et implique l'attaque du nucléophile du côté opposé à l'oxygène, qui se comporte comme un groupe partant.
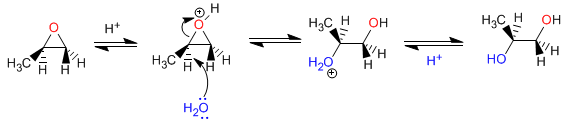
Ouverture des oxiranes en milieu acide - En milieu acide, l'oxygène est protoné, favorisant l'attaque nucléophile du carbone. L'ouverture se produit sur le carbone le plus substitué. Avec H + /H 2 O on obtient des antidiols.
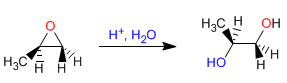
Mécanisme:
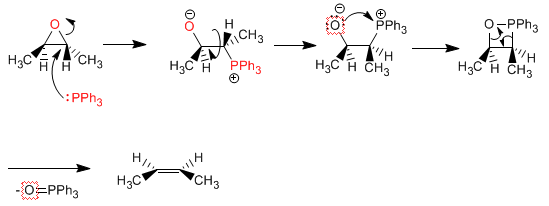
Désoxygénation des oxiranes : Les oxiranes avec des substituants trans peuvent être transformés en cis alcènes. Alors que les oxiranes avec des groupes cis sont convertis en trans alcènes. Voyons un exemple :